巴西苏木素对MRSA丙氨酸消旋酶抑制作用的初步研究
2024-01-26陈泽慧周小仙余孟飞杨智芳李明哲
黎 瑞,陈泽慧,周小仙,余孟飞,杨智芳,李明哲
(1.遵义医科大学附属医院 医学检验科,贵州 遵义 563099;2.遵义医科大学 检验医学院,贵州 遵义 563099)
金黄色葡萄球菌是临床上一种重要的病原菌,可引起一系列人类疾病,包括轻微的皮肤感染、严重的组织感染和败血症[1]。目前,主要依靠抗菌药物治疗金黄色葡萄球菌引发的感染。然而,随着耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,MRSA)的出现,耐药问题日渐严重[2],该类细菌不但对β-内酰胺类,还对糖肽类、大环内酯类等多种抗菌药物出现了耐药性[3-4],使得临床治疗变得极为困难。因此,开发具有抗MRSA感染的新型药物迫在眉睫。
在探索新药物的过程中,天然产物一直是重要来源[5]。巴西苏木素(Brazilin,BN)是一种从中药材苏木中分离提取的天然产物,是苏木主要活性成分之一,分子式为C16H14O5。其具有抗肿瘤、抗氧化、抗菌的作用,同时还具备降血糖和免疫调节等多种生物学活性[6]。研究发现BN对MRSA具有抗菌作用,可导致MRSA细胞膜通透性增加、DNA与RNA等大分子物质外渗增加以及可溶性蛋白表达减少[7]。然而,目前尚无BN通过影响MRSA细胞壁合成来发挥抑菌作用的报道。细胞壁是细菌及植物细胞所特有的结构,可保持细胞的完整性,对细菌的生长和分裂至关重要。参与细菌细胞壁合成过程中的关键酶一直是研发抗菌药物靶标的热点。其中丙氨酸消旋酶(alanine racemase, Alr)是一种吡哆醛-5'-磷酸依赖性细菌酶,参与细菌细胞壁的合成,为其提供肽聚糖交联所必需的前体D-丙氨酸,对细菌的存活至关重要[8-9]。由于人类细胞没有细胞壁结构,而Alr广泛存在于细菌中[10-11]。因此,Alr成为抗菌药物研发的理想靶标。课题组前期研究发现BN能够破坏MRSA细胞壁肽聚糖的合成,在对BN作用MRSA菌株前后的转录组数据进行分析后,发现BN可以下调细胞壁肽聚糖合成过程中D-Ala代谢途径的关键酶Alr的调控基因Alr。因此,基于BN对MRSA有较好的抗菌效果,进一步的探明该效果是通过抑制Alr的活性而发挥的作用,现报道如下。
1 材料与方法
1.1 主要试剂 巴西苏木素(成都普思生物科技股份有限公司),纯度≥98%;细菌基因组DNA提取试剂盒(TIANGEN公司)、通用型DNA纯化回收试剂盒(TIANGEN公司);限制性内切酶HindⅢ、XhoⅠ、T4DNA连接酶(大连TaKaRa公司)、蛋白Marker(Solarbio公司)、磷酸吡哆醛(MACKLIN公司)、L-丙氨酸(Solarbio公司)、D-氨基酸氧化酶(Aladdin公司)、4-氨基安替比林(MACKLIN公司)、辣根过氧化物酶(Solarbio公司)、TOOS(MACKLIN公司)、Britton-Robinson缓冲液(北京雷根生物技术有限公司)、Tris-Hcl(Solarbio公司)。
1.2 主要仪器 JY300C型电泳仪(北京君意东方电泳公司)、YJ-SCZ 2+型垂直电泳槽(北京君意东方电泳公司);T100型PCR仪(美国 Bio-Rad公司);K5600型超微量分光光度计(北京凯奥科技发展有限公司);MultisKan型全波长酶标仪(美国Thermo Scientific 公司)。
1.3 实验菌株 MRSA ATCC 43300购于上海宝录生物有限公司。
1.4 方法
1.4.1 丙氨酸消旋酶的克隆、表达及纯化 (1)PCR扩增及切胶回收Alr于NCBI(accession号为NC_002952)检索获得金黄色葡萄球菌Alr基因序列,通过SnapGene软件设计引物。通过聚合酶链反(polymerase chain reaction, PCR)克隆MRSA ATCC 43300的Alr基因,并进行切胶回收。 PCR扩增Alr所需引物(下划线部分分别是HindⅢ和XhoⅠ的酶切位点)及质粒(表1)。

表1 PCR扩增Alr所需引物及质粒
(2)pET-28a-Alr重组质粒的构建与鉴定使用限制性内切酶HindIII和XhoI双酶切Alr基因及pET-28a质粒,将其混合后,进行连接。热激转化至DH5α感受态细胞中,提取重组质粒并送至生工生物工程(上海)股份有限公司进行测序,将正确的命名pET-28a-Alr,于-80 ℃保存备用。(3)pET-28a-Alr重组质粒的诱导、表达及纯化通过热激法获得BL21 (DE3)感受态细胞后,将pET-28a-Alr转入其中,用终浓度为0.05 mmol/L的IPTG,于20 ℃,120 r/min下诱导12~16 h,收集菌体进行超声破菌后,经镍离子金属亲和层析法纯化上清液中的Alr蛋白[12]。然后通过SDS-PAGE法检测Alr的纯度,以超滤杯进行脱NaCl、脱咪唑并浓缩蛋白。使用BCA法对浓缩蛋白定量后分装保存于-80 ℃备用。
1.4.2 BN抑制Alr活性实验 Alr活性测定采用消旋反应及氧化反应两步法进行测定[13]。(1)消旋反应在总体积为200 μL的反应体系中分别加入终浓度为20 mmol/L的Britton-Robinson缓冲液、125 mmol/L L-丙氨酸、10 μmol/L辅酶PLP、适量纯化的Alr及终浓度分别为 8、16、32、64 μg/mL 的BN,同时设立对照组。置于37℃ 培养10 min,然后加入25 μL 2 mol/L HCl终止反应的进行,于冰上静置2 min后加入相同体积的NaOH溶液,将多余的酸中和,得到消旋反应产物,随后将其离心并吸取上清转移至新Ep管中。(2)氧化反应在总体积为200 μL的反应体系中分别加入0.1 mg/L 4-氨基安替吡啉、0.1 U D-氨基酸氧化酶、0.1 mg/L TOOS、100 mmol/LTris-HCl(pH=8.0)、2 U过氧化物酶及适量消旋反应产物。37 ℃培养20 min,用酶标仪测定550 nm处吸光度值。Alr酶活力定义:1 min内催化L-Ala生成1 μmol D-丙氨酸所需的酶量为一个酶活性单位(U) 。每组实验做3个平行,重复3次。
1.4.3 细胞热稳定迁移实验(CETSA) 将pET28a-Alr重组质粒进行诱导表达,超声破菌后离心,从上清液中获得总蛋白。取 600 μL 上清液用128 μg/mL BN进行处理,同时设立对照组。 37 ℃ 孵育1 h,12 000×g离心 20 min。将上清液进行分装,每管60 μL,共6管。分别在30、45.7、50、55.9、59.5、64 ℃ 温度下孵育10 min,将样品在12 000×g下离心 20 min,得到上清液。所有样品进行蛋白免疫印迹检测,独立重复3次实验。
1.4.4 蛋白免疫印迹实验 将上一步所得上清液进行SDS-PAGE电泳。在转膜后,进行封闭2 h,在4℃条件下与抗-Alr多克隆抗体孵育过夜,然后用TBST进行洗涤,1次10 min,共3次,接着用山羊抗鼠抗体孵育,37℃,2 h后,ECL显色杂交条带,以检测Alr的表达水平。
1.4.5 分子对接 在Alphafold数据库检索Alr蛋白结构文件。将Alr蛋白指定为受体,小分子BN指定为配体。PyMOL(4.3.0版)软件(https://pymol.org/)用于分子结构和对接结合物的可视化。
AutodockTools(http://mgltools.scripps.edu/downloads)用于加氢,检查电荷,将原子类型指定为AD4类型,计算gasteiger,并构建受体蛋白的对接网格盒,此外,配体小分子BN应确定Root,在AutodockTools中选择配体的可扭转键。最后,在AutodockTools中,受体分子和配体分子的格式都应该从“.mol2”转换为“.PDBQT”,以便进一步对接。利用Vina对接后,计算小分子BN与该蛋白组合的得分,并使用PyMOL和Discovery Studio软件进行作用力分析和可视化。
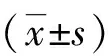
2 结果
2.1 PCR扩增Alr基因及pET-28a-Alr原核表达载体的构建 以MRSA ATCC 43300菌株的DNA为模板进行PCR扩增Alr基因,目的基因片段的大小为1 149 bp,符合预期分子量(图1A)。将目的基因克隆入pET-28a载体中并转化至DH5α中,进行菌液PCR验证,结果显示所有目的条带的大小均符合预期(图1B)。
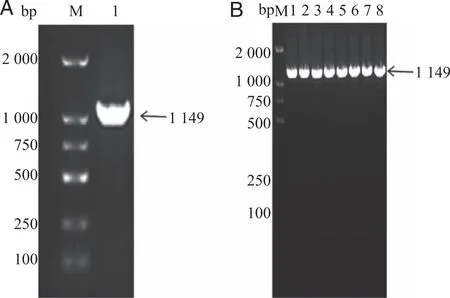
A:Alr基因PCR扩增电泳结果(marker:DNA标记DL2000 bp;1:扩增的Alr基因);B:菌液PCR鉴定结果(M:DNA标记DL2000 bp;1:阳性对照;2~8:阳性克隆菌)。图1 pET28a-Alr重组质粒的构建
2.2 MRSA Alr蛋白的诱导、表达及纯化 用IPTG诱导转化到大肠杆菌BL21 (DE3)感受态细胞的重组质粒,收集超声后的菌上清,再经过镍亲和层析法纯化后,纯度较高的Alr蛋白在60、80、100、150 mmol/L咪唑洗脱液中获得。纯化得到的Alr蛋白的分子量为48 kDa左右(图2),与预期的蛋白分子量一致,检测Alr蛋白浓度约为1.2 mg/mL。

marker:180 kD蛋白标记;1:未诱导;2:诱导全菌;3:诱导离心后上清;4:流穿液;5:10 mmol/L咪唑;6:20 mmol/L咪唑:7:30 mmol/L咪唑;8:40 mmol/L咪唑;9:60 mmol/L咪唑;10: 80 mmol/L咪唑;11:100 mmol/L咪唑;12:150 mmol/L咪唑。 图2 Alr蛋白纯化的SDS-PAGE结果
2.3 BN对Alr酶活性的抑制 与对照组相比,8~64 μg/mL巴西苏木素均抑制了Alr活性(P<0.01),且呈一定剂量相关性,其中64 μg/mL抑制率达到约50%(图3)。
2.4 BN与Alr蛋白的相互作用 CETSA实验结果显示,在55.9~59.5℃下BN处理后的Alr蛋白热稳定性明显高于Mock组(P<0.0001),提示BN与Alr蛋白有直接结合的相互作用关系(图4)。
2.5 分子对接 将单体巴西苏木素(结构见图5)与Alr蛋白进行对接,利用Vina对接后,计算小分子巴西苏木素与该蛋白组合的得分,并使用PyMOL和Discovery Studio软件进行作用力分析和可视化。将Alr蛋白指定为受体,将小分子巴西苏木素指定为配体。结果见图6,配体小分子巴西苏木素与受体蛋白Alr之间的结合能为-8.0 kcal/mol,其可通过5条分别为2.9、3.1、3.4、3.3、4.0 Å的氢键分别与受体蛋白Alr的221号GLY氨基酸残基、204号SER氨基酸残基、219号ARG氨基酸残基、43号TYR氨基酸残基和222号ILE氨基酸残基结合;此外,配体小分子巴西苏木素可通过2条分别为3.5 Å的疏水作用力和3.0 Å的氢键均与受体分子Alr的203号ASN氨基酸残基结合;还可通过1条3.8 Å的疏水作用力和1条4.0 Å的氢键分别与受体分子Alr的352号ILE氨基酸残基和169号PHE氨基酸残基结合;还可通过2条分别为4.0 Å的疏水作用力和4.2 Å的面对面π-π堆叠力均与受体分子Alr的354号TYR氨基酸残基结合。此外,二维作用力分析也得到了相似的结果。

图5 巴西苏木素结构
3 讨论
由于MRSA菌株对大多数抗菌药物均出现了耐药性,导致临床治疗变得非常困难。因此,需要研发新的抗菌药物来预防和治疗MRSA感染。Alr是细菌细胞壁肽聚糖合成的关键酶,因其广泛存在于原核生物中,而在哺乳动物中较少,这使得其成为抗菌药物的靶点。
针对Alr抑制剂的研发已成为重点,根据其抑制机制的不同,可分为以下3种。①底物类似物抑制剂,其与酶的底物结构相似,通过与酶的活性位点竞争性结合,阻止底物的结合和酶的催化活性,从而抑制酶活性。D-环丝氨酸是底物类似物抑制剂,其结构与丙氨酸类似,一般作为二线药物用于治疗结核病。Amorin-Franco等[14]发现D-环丝氨酸除了抑制Alr外,还抑制其他不相关的磷酸吡哆醛(PLP)依赖性酶,引起严重的不良反应,如头痛、抑郁及嗜睡等。因此,开发具有更高特异性的Alr抑制剂仍然十分必要。②非底物类似物抑制剂,用来克服PLP相关的脱靶效应的酶抑制剂,其通过与酶活性中心不同的位点结合,改变酶的构象,从而抑制酶的催化活性。Wang等[15]首次证实了高龙胆酸和对苯二酚对嗜水气单胞菌的抗菌活性,且它们均是非底物类似物抑制剂,通过与Alr活性位点结合发挥抑制作用。虽然非底物类似物抑制剂不与其他PLP依赖性酶结合,但研究发现此类抑制剂仍会产生一定的细胞毒性。因此,寻找对人类毒副作用更小的Alr抑制剂十分重要。③中草药抑制剂,中草药在我国资源丰富,因其成本低,副作用小等优点而广受关注。Kumari等[16]通过气相色谱-质谱联用和分子对接对85种植物的化学成分进行测定,发现1,8-桉叶油脑、庚酸和芳樟醇与Alr结合能比底物丙氨酸的低,具有较高的生物活性评分。尽管BN被发现可以抑制MRSA菌株[17],但目前尚未有研究证明这种抑菌效果是通过抑制Alr来实现的。因此,本研究通过诱导表达Alr,进行体外活性实验初步验证BN作为Alr抑制剂的可能性。结果表明BN能够较好抑制Alr活性,且有浓度依赖关系。为了进一步研究BN抑制Alr活性的机制,首先需要证明BN是否直接与Alr结合,Prabhu等[18]发现当药物与蛋白质结合时,蛋白质的热稳定性会发生变化。因此,本研究通过CETSA实验进行验证,该实验是一种用于评估药物与蛋白质相互作用的方法。实验结果显示BN能够与Alr蛋白相互结合并提高其热稳定性。但它们是如何结合的仍不清楚,为此本研究通过分子对接进行了预测。分子对接是一种计算方法,用于预测药物与蛋白质的结合位点、结合方式及结合能力。文献报道,当结合能为负值时说明配体与受体之间可以自发结合[19]。本文对接结果显示BN与Alr之间的结合能为-8.0 kcal/mol,说明二者可以自发结合。研究表明,在Alr活性位点入口通道的残基有助于确保底物的准确进入和定位到活性位点,从而实现催化反应的进行[20];Alr通常以二聚体形式存在,在其活性位点及结合口袋中存在的残基可提供稳定的蛋白质结构,维持酶的活性[21]。
对接结果显示BN与Alr活性位点的Gly221、Phe169形成氢键作用,与Alr结合口袋中的Asn203形成疏水作用,这些氢键及疏水等作用有助于增加BN与Alr之间的稳定性;与Alr活性位点中的Arg219、Ser204、Ile222和Tyr43等氨基酸残基形成氢键作用,从而影响Alr与PLP结合发挥作用的稳定性;与其活性位点通道的Ile352形成疏水作用,同时与Tyr354形成疏水作用及面对面π-π堆积相互作用,通过占据活性位点通道进而影响Alr活性。
综上所述,BN可能是通过与MRSA 菌株Alr的活性位点及其通道处的氨基酸形成氢键或疏水作用进而抑制Alr的活性,为后续研究BN作为Alr抑制剂进而抗MRSA感染提供了理论依据。
