Duffy 血型不同表型对红细胞储存及清除趋化因子的影响*
2023-12-02周世航潘凌子宋文倩邵林楠范亚欣大连市血液中心辽宁大连116001
周世航 潘凌子 宋文倩 邵林楠 范亚欣(大连市血液中心,辽宁 大连 116001)
Duffy 血型是1950 年发现的血型系统, 基因定位于1q22—q23,包含Fya,Fyb,Fy3,Fy5 和Fy6 共5 个抗原[1-2]。红细胞膜上Fya和Fyb抗原分别由FY*A和FY*B等位基因编码,依据Fya和Fyb抗原的有无,Duffy 血型可分为4 个表型,分别为Fy(a+b-)、Fy(a+b+)、 Fy(a-b+)和Fy(a-b-)。研究发现,红细胞膜上的Duffy 抗原能结合CCL2、CCL5、CXCL8 以及CCL11 等趋化因子,因此被命名为Duffy 抗原趋化因子受体[3]。 在2014 年,又命名为非典型趋化因子受体1(atypical chemokine receptor 1,ACKR1)[4]。
红细胞Duffy 抗原作为趋化因子受体发挥着重要的生物学功能。 目前的研究认为,红细胞Duffy 抗原是炎症反应的调节器,能够结合并清除炎症性趋化因子,在炎症中发挥重要的调节作用[5]。 Duffy 血型抗原Fya及Fyb可能因结构或表达的不同,而导致炎症调节的功能有所不同。 有研究发现,Duffy 抗原阳性的红细胞能够在胞内储存趋化因子CCL2、CCL5 和CCL11[6]。 在本研究中,我们探讨了Duffy 血型不同表型对红细胞储存及清除趋化因子的影响。
1 材料与方法
1.1 研究对象 2022 年3 月在本中心献血的24 名健康献血者被纳入本研究,男性12 人,女性12 人,均为汉族。 Duffy血型表型Fy(a+b-)组:男性6 名,女性6 名,年龄21~55 岁,年龄中位数36.5 岁。 Duffy 血型表型Fy(a+b+)组:男性6名,女性6 名,年龄32~57 岁,年龄中位数49 岁。 抽取以上献血者EDTA-K2抗凝静脉血2 mL。 以上献血者已签署《献血者知情同意及健康状况征询表》,同意血液中心按规定对血液标本进行科研相关检测及使用。 本研究经中心伦理委员会批准(批准号:LL-202203)。
1.2 试剂与仪器 PE 标记鼠抗人Duffy 抗原抗体(BD Biosciences 公司,批号:7230593)、PE 标记鼠IgG1 同型对照(BD Biosciences 公司,批号:9115544); Human CCL2 ELISA Kit(联科生物公司,批号:A18700941)、Human CCL5 ELISA Kit(联科生物公司,批号:A112900142)、Human CXCL8 ELISA Kit(联科生物公司,批号:A10800913)、Human CCL11 ELISA Kit(联科生物公司,批号:A113000724);趋化因子Human CCL2(Peprotech 公 司, 批 号:0410AFC31 L0313)、 Human CCL5(Peprotech 公司,批号:0211AFC33 L0313)、Human IL-8(77a.a.) (CXCL8)(Peprotech 公司,批号:110719 D1519)、Recombinant Human Eotaxin (CCL11)(Peprotech 公司,批号:0318AFC69 D1218);抗-Fya(CE-IMMUNDIAGNOSTIKA 公司,MFyaM210-1)、抗-Fyb(CE-IMMUNDIAGNOSTIKA 公司,批号:MFybM210-1);抗人球蛋白试剂(上海血液生物医药公司,批号:20205001); DMEM 培 养 基( Hyclone 公 司, 批 号:AF29422282);牛血清白蛋白BSA、Triton X-100(索莱宝公司);PBS 速溶颗粒(莫纳公司);离心机D-37520(Heraeus 公司);流式细胞仪FascCanto2(BD 公司);全自动血细胞计数仪XT-1800i(SESMEX 公司);全自动酶免分析仪ADC ELISA500(艾德康公司);恒温水温箱(上海一恒仪器公司);E100 显微镜(尼康公司);5 mL 无菌注射器(BD 公司);1.5 mL 离心管(Corning 公司)。
1.3 方法
1.3.1 红细胞悬液(5×109/mL)制备 将收集的血样,800×g离心20 min;用一次性无菌注射器小心穿透软管底部,匀速、缓慢地收集适量底层红细胞;将收集到的红细胞悬液经涂片镜检证实不含白细胞后,用冷PBS/0.1% BSA 洗涤3 次,使用全自动血细胞计数仪计数,然后用PBS 将红细胞配制成5×109/mL 的红细胞悬液。
1.3.2 红细胞CCL2、CCL5、CXCL8 以及CCL11 储存量测定取红细胞悬液(5×109/mL)200 μL,加入800 μL PBS/1%tritonX,于4℃放置裂解,置于-80℃保存,使用ELISA 方法测定红细胞趋化因子CCL2、CCL5、CXCL8 以及CCL11 含量。
1.3.3 红细胞趋化因子清除功能测定 在试管中加入20 μL红细胞悬液(5×109/mL)、10 μL (100 nmol/L) CCL2/CCL5/CXCL8/CCL11 和470 μL DMEM(含0.1% BSA)孵育液,每个标本同时做无趋化因子对照;将试管轻轻混匀后,于37℃恒温水浴箱孵育30 min(在孵育期间轻轻震荡几次);将孵育好的红细胞悬液轻轻加入500 μL 含30%蔗糖的离心管的上层,13 000×g 离心3 min。 取上述沉淀, 用PBS/0.1% BSA 洗涤3 次,加入500 μL PBS/1% TritonX, 于4℃放置裂解,置于-80℃保存,用ELISA 方法测定趋化因子含量。 加入趋化因子孵育后红细胞裂解液的趋化因子含量减去无趋化因子的对照红细胞裂解液趋化因子含量,代表红细胞趋化因子清除功能。
1.3.4 红细胞膜上Duffy 抗原表达的检测 用2.5 mL PBS/0.1% BSA 将红细胞悬液(5×109/mL)稀释成×107/mL,取100 μL 置于测试管及同型对照管中;样品管加入5 μL PE 标记鼠抗人Duffy 抗原抗体,同型对照管加入20 μL PE 标记鼠IgG1 同型对照;充分混匀后,于暗处放置30 min;用PBS/0.1%BSA 洗涤后,加入0.5 mL PBS/0.1% BSA 充分混匀,用流式细胞仪检测Duffy 抗原表达量。
1.3.5 Duffy 血型表型的检测 使用间接抗人球蛋白方法进行Duffy 血型表型的检测。 在标记Fya和Fyb的试管,分别加入1 滴抗-Fya和抗-Fyb,然后加入3%的红细胞悬液,37℃恒温水浴箱孵育30 min,盐水洗涤3 次,加入2 滴抗人球蛋白试剂,1 000×g 离心15 s。 依据凝集情况,判读结果。
1.4 统计学分析 使用R4.2.3 软件进行数据统计分析。 使用线性回归进行多因素分析,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 Duffy 血型不同表型的红细胞储存趋化因子含量的比较Duffy 血型表型Fy(a+b-)与Fy(a+b+)的红细胞裂解液CCL2 含量(41.1±14.7)pg/mLvs(63.1±20.8)pg/mL 有差异(t=3.008,P<0.05)。 而CCL5 含量(794.5±320.1)pg/mLvs(846.9±359.4)pg/mL 与CXCL8 含量(59.5±34.2)pg/mLvs(49.1± 11.9)pg/mL 及CCL11 含量(109.1±25.1)pg/mLvs(158.6 ±56.0)pg/mL 均无差异(P>0.05)。 因Duffy 血型表型Fy(a+b-)与Fy(a+b+)2 组的年龄不同,为了避免年龄的影响,将年龄纳入线性回归模型进行统计分析,结果表明红细胞裂解液CCL2 含量仍然和Duffy 血型表型有关(t=2.623,P<0.05)。 以上结果表明Fy(a+b+)表型的红细胞储存的CCL2 含量要高于Fy(a+b-)表型,见图1。
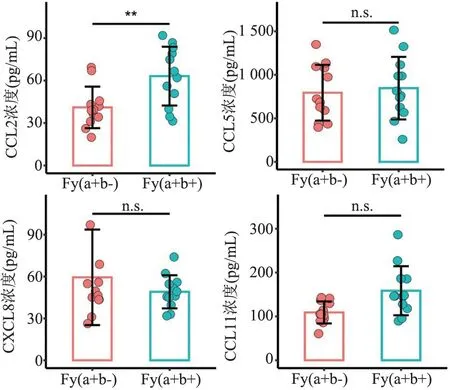
图1 Duffy 血型不同表型的红细胞储存趋化因子含量的比较
2.2 Duffy 血型不同表型的红细胞的趋化因子清除功能的比较 Duffy 血型表型Fy(a+b-)与Fy(a+b+)的红细胞裂解液CCL2 含量(1 471±202.1)pg/mLvs(1 860±267.5)pg/mL 与CCL5 含量(848.5±461.7)pg/mLvs(1 797±546.1)pg/mL)均有差异(t值分别为4.020、4.595,均为P<0.05)。 而CXCL8含量(1 851±180.7)pg/mLvs(1 862± 248.3)pg/mL)与CCL11 含量(691.0±125.7)pg/mLvs(781.7 ±293.8)pg/mL均无差异(P>0.05)。 将年龄纳入线性回归模型进行统计分析,结果表明红细胞裂解液CCL2 及CCL5 含量仍然和Duffy血型表型有关(t值分别为3.220、3.633,均为P<0.05)。 以上表明Fy(a+b+)表型的红细胞清除CCL2 及CCL5 的能力要大于Fy(a+b-)表型,见图2。
2.3 红细胞上Duffy 抗原的表达 使用流式细胞术检测Fy(a+b-)与Fy(a+b+)表型红细胞膜表面Duffy 抗原的表达,图3 为Duffy 血型Fy(a+b-)与Fy(a+b+)表型红细胞各1 例的流式检测图谱。 Duffy 血型表型Fy(a+b-)与Fy(a+b+)的红细胞的Duffy 抗原表达(平均荧光强度(MFI):(105.3±20.45)vs(111.9±18.30)无差异(P>0.05),见图4。
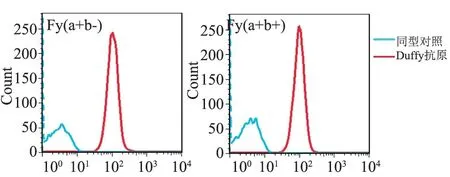
图3 红细胞Duffy 抗原的流式检测
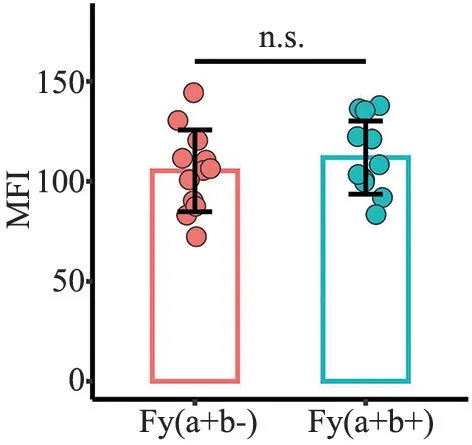
图4 Duffy 血型不同表型Duffy 抗原的表达
3 讨论
Duffy 血型是1 个重要的血型系统,其在临床输血实践中有重要意义。 Duffy 抗原能结合相应的炎症性趋化因子,但无法启动趋化因子胞内信号传导通路[7]。 Duffy 血型抗原在炎症调节、感染、自身免疫性疾病以及肿瘤发生及发展等发挥重要作用[5]。 本研究分析了Duffy 血型Fy(a+b-)与Fy(a+b+)表型对红细胞储存及清除趋化因子的影响,结果表明不同的表型对红细胞储存及清除趋化因子存在差异。
本研究发现Fy(a+b+)表型的红细胞储存的CCL2 含量要高于Fy(a+b-)表型,未发现Fy(a+b-)和Fy(a+b+)表型红细胞储存CCL5、CXCL8 以及CCL11 的含量存在差异。 进一步比较了Duffy 血型不同表型的红细胞的趋化因子清除功能,发现Fy(a+b+)表型的红细胞清除CCL2 及CCL5 的能力要大于Fy(a+b-)表型,但是未发现Fy(a+b-)和Fy(a+b+)表型红细胞清除CXCL8 以及CCL11 的能力存在差异。 以上结果表明,Duffy 血型Fy(a+b-)和Fy(a+b+)表型对红细胞储存及清除趋化因子的影响存在差异。 Duffy 血型抗原Fya及Fyb是由CDS 区125G>A 的碱基变化导致肽链上的第42位氨基酸由甘氨酸转变为天冬氨酸而产生的抗原变化[8]。一些研究发现,Duffy 血型不同基因型或表型的Duffy 抗原的表达是不同的[9-11],这提示Duffy 血型的不同表型影响红细胞储存及清除趋化因子也许是和不同表型的Duffy 抗原的表达差异有关。 然而本研究并没有发现Fy(a+b-)和Fy(a+b+)这2 个表型的红细胞上的Duffy 抗原的表达存在差异。 我们的结果与King 等[12]的研究结果一致。 因此,Duffy 血型的不同表型影响红细胞储存及清除趋化因子的机制和Duffy 抗原的表达量无关。 Schnabel 等[10]发现,Duffy 血型不同基因型和血清CCL2 浓度有关,他们认为其机制与Duffy 血型的不同表型导致的抗原结构或者功能的改变有关。 因此,Duffy血型的不同表型影响红细胞储存及清除趋化因子的机制或许也是和不同表型导致的抗原结构变化引起的功能的改变有关。 值得注意的是,本研究发现Duffy 血型的不同表型红细胞仅仅对储存趋化因子CCL2 以及清除趋化因子CCL2 和CCL5 存在着差异,这可能是和Duffy 抗原结合不同种类的趋化因子能力不同有关。
Mangalmurti 等[13]的研究认为,红细胞储存损伤会导致Duffy 抗原结构的变化,这种变化会引起红细胞Duffy 抗原趋化因子清除功能的下降,进而促进输血相关的肺炎的发生。结合本研究的结果,输注Fy(a+b+)表型的红细胞或许要比输注Fy(a+b-)表型红细胞导致输血相关肺炎的风险要低。还有研究发现,Duffy 血型表型和乳腺癌的发生、淋巴结转移以及生存期有关,Fy(a+b+)表型相对于Fy(a+b-)是保护因素,其机制或许和Duffy 血型不同表型的红细胞趋化因子清除功能差异有关[14]。 对于乳腺癌患者而言,输注Fy(a+b+)表型的红细胞或许要比输注Fy(a+b-)表型红细胞更有益处。
本研究所涉及到的表型并不包含Fy(a-b+)和Fy(a-b-)。 在亚洲人群,Fy(a+b-)、 Fy(a+b+)是常见的表型,而Fy(a-b+)表型是少见的,Fy(a-b-)表型通常存在于非洲人群[15]。 在以后的研究中,可以进一步探讨Fy(a-b+)和Fy(a-b-)表型对红细胞储存及清除趋化因子的影响。 Duffy 抗原结合的趋化因子近20 种,包括强亲和力的趋化因子以及弱亲和力的趋化因子[16]。 考虑到使用弱亲和力的趋化因子,难以获得Duffy 血型不同表型对红细胞储存及清除趋化因子影响的差异,故本研究涉及到的CCL2、CCL5、CXCL8 以及CCL11 这4 种趋化因子均是与Duffy 抗原具有强亲和力的趋化因子。 此外,本研究涉及的趋化因子仅仅是4 种,对于其它与Duffy 抗原结合的趋化因子,还需要进一步研究。
综上所述,Duffy 血型Fy(a+b+)和Fy(a+b-)表型对红细胞储存及清除趋化因子的影响存在差异, Fy(a+b+)表型要比Fy(a+b-)表型红细胞能够储存更多的趋化因子以及具有更强的趋化因子清除功能。
利益冲突:所有作者均声明不存在利益冲突。
