体外光化学疗法预防小鼠急性移植物抗宿主病作用及其机制*
2023-12-02程占睿林雨薇钟妍张阿龙徐海霞田力刘忠
程占睿 林雨薇,3 钟妍 张阿龙 徐海霞 田力△ 刘忠△
(1.中国医学科学院北京协和医学院输血研究所, 四川 成都 610052; 2.中国医学科学院输血不良反应研究实验室;3.安徽医科大学 公共卫生学院)
同种异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)是目前治愈造血功能异常和血液系统恶性肿瘤的有效手段,据中国造血干细胞移植登记组报告,2019 年我国140 家单位实施allo-HSCT 近万例,占全球造血干细胞移植总例数的14.9%[1-3]。 Allo-HSCT 临床应用的同时,aGVHD 依旧是主要并发症和死亡原因[4-5]。aGVHD 的机制研究表明:移植物中的供者T 细胞活化后错误识别受者组织抗原,分化为细胞毒性T 细胞并且异常分泌多种淋巴因子,形成细胞因子风暴,损伤宿主靶器官,造成包括肝、胃肠道、皮肤黏膜等的受累[6]。
预防aGVHD 发生的关键点在于抑制细胞因子风暴的形成,最常见的方法是免疫抑制药物的应用,然而这些药物抑制供者T 细胞的同时,也会非特异性降低全身免疫功能,导致感染和死亡的发生[5,7]。
ECP 是1 种基于白细胞分离技术的免疫调节疗法,1987年由Edelson 等[8]发明并被美国FDA 批准用于皮肤T 细胞淋巴瘤(Cutaneous T Cell lymphoma, CTCL)的治疗。 ECP 程序包括患者外周血白细胞的分离,体外加入光敏剂和紫外线(ultraviolet radiation A,UVA)照射诱导白细胞的凋亡,最后将处理后的白细胞回输给患者以达到治疗目的[9]。 光敏剂8-甲氧基补骨脂素(8-Methoxypsoralen 8-MOP),是1 种天然化合物,存在于多种草本植物中且毒性极低,可被UVA(波长:320-400nm)激活,产生活性氧损伤细胞DNA 和蛋白质[10],同时活化的8-MOP 也可以插入到DNA 之间,交联嘧啶碱基,阻止细胞的增殖从而引起细胞凋亡[11]。 随着研究的不断进展,人们发现ECP 不仅可以介导机体产生特异性的抗肿瘤效应[12],也可以诱导机体产生免疫耐受[13-14],具有广阔的临床应用前景。 1993 年,首次有文献报道ECP 具有治疗GVHD 的作用[15],随后越来越多报道证实了ECP 临床治疗的有效性[16-18],ECP 治疗的安全性也成为了其最大的优势[19]。 1 项最新的RCT 研究表明血液系统恶性肿瘤的患者接受造血干细胞移植后马上预防性进行8 次ECP 治疗后可以降低aGVHD 的发生率[20],但其具体作用机制仍不明确。目前的研究重点在于ECP 诱导的细胞凋亡如何介导免疫耐受[21],随着人们对凋亡的不断研究,发现不同凋亡时期的细胞有不同的免疫功能,早期凋亡的细胞可能会诱导免疫耐受的发生[22]。 而临床观察到ECP 的预防作用是否和早期凋亡细胞相关,这一部分目前仍不清楚,故本实验拟在体外探究ECP 诱导细胞凋亡情况,同时体外建立aGVHD 小鼠模型,观察ECP 的预防效果,探讨早期凋亡细胞在其中的作用机制,为临床ECP 预防aGVHD 的开展奠定实验基础。
1 材料与方法
1.1 实验动物 6 ~8 周龄SPF 级雌性BALB/C 小鼠(H-2Kd)和8~10 周龄C57BL/6 小鼠(H-2Kd),体重(22±2)g,由四川成都达硕实验动物有限公司提供。 实验动物生产许可证号:SCKK(川)2020-0030。 于移植实验前1 周起给予BALB/C 受鼠抗生素饮食至实验全程,实验动物房内12 h 昼夜交替,温度22~26℃,湿度40%~60%,(5 ~6)只/笼,自由进食与饮水,饲喂全价小鼠颗粒饲料。 所有动物实验均通过伦理审查及批准,实验过程遵循国家相关规定,小鼠使用经颈椎脱臼法处死。
1.2 主要试剂 Annexin V-FITC/PI 凋亡检测试剂盒(批号Q10216,北京全氏金生物);8-MOP(批号1003333048,美国Sigma);流式抗体APC-H2KB(批号17-5958-82),PB450-H2Kd(批号17-5957-82)(美国Thermo Fisher Scientific);小鼠流式微球技术(Cytometric Bead Array, CBA)定量检测试剂盒(批 号2140290), 流 式 抗 体, PrECP-Cy5.5-CD45 (批 号2168091),FITC-CD3(批号1349586),PE-CY7-CD4(批号2124924),PE-IFN-γ(批号1277781);红细胞裂解液(批号2096595)(美国BD Biosciences Pharmingen)。
1.3 ECP 处理
1.3.1 小鼠脾脏单个核细胞悬液制备 小鼠引颈脱臼处死,于超净台中无菌剪开脾脏包膜,置于200 目滤网上研磨,用含体积分数2%胎牛血清的RPMI-1640 培养基冲洗滤网数次,收集过滤后的脾脏细胞悬液,22℃下1 200 rpm,120 g,离心10 min 收集细胞,红细胞裂解液室温裂解10 min,加入适量RPMI-1640 培养基终止裂解,离心去上清,PBS 洗涤2 次,最后用预温的RPMI-1640 培养基调整细胞浓度为1×108/mL。
1.3.2 ECP 处理细胞 按上述方法获得的小鼠脾脏单个核细胞悬液加入50 ng/mL, 100 ng/mL, 200 ng/mL, 300 ng/mL, 600 ng/mL 的8-MOP 在CO2孵箱中孵育30 min。 将细胞培养皿置于Ⅰ代体外光化学处理仪(自制)中,UVA 光源照射364s,照射强度为2J/cm2,照射结束后,PBS 洗两次,最后用PBS 调整细胞浓度为1×108/mL。
1.3.3 Annexin V-FITC/PI 双标记联合流式细胞术检测ECP诱导凋亡率 将不同浓度8-MOP 处理过的脾脏单个核细胞悬液各取10 μL 加入流式管中,严格按照Annexin V-FITC/PI凋亡检测试剂盒说明书进行操作,使用100μL 预冷的Annexin V Binding Buffer 重悬细胞,加入5 μL Annexin V-FITC 和5 μL PI 室温避光孵育15 min,最后加入400 μL 预冷的Annexin V Binding Buffer,流式细胞仪检测细胞凋亡情况,收集数据并使用FlowJo 软件分析。
1.4 aGVHD 模型的建立
1.4.1 移植前处理及实验分组 移植前1 周喂食BALB/C小鼠含有125 mg/L 庆大霉素和100 mg/mL 红霉素的无菌酸化水,移植当天将小鼠置入RS2000 生物学X 射线辐照仪中,8Gy 一次性照射6 min,根据表1 的实验分组,照射4 h 后从BALB/C 小鼠的尾静脉回输不同细胞,建立aGVHD 模型。

表1 实验分组
1.4.2 骨髓有核细胞悬液的制备 小鼠引颈脱臼处死,于超净台中无菌取股骨和胫骨,注射器插入骨髓腔用含体积分数2%胎牛血清的RPMI-1640 培养基冲出骨髓,收集冲出的骨髓细胞悬液,22℃下1 200 rpm,120 g,离心10 min 收集细胞,红细胞裂解液室温裂解10 min,加入适量RPMI-1640 培养基终止裂解,离心去上清,PBS 洗涤2 次,最后用预温的RPMI-1640 培养基调整细胞浓度为1×108/mL。
1.4.3 尾静脉输注细胞悬液 根据表1 的实验分组将上述的细胞悬液混合后经尾静脉缓慢输入。
1.5 小鼠预防效果评价
1.5.1 小鼠生存时间分析及aGVHD 症状评分 移植后每天观察记录小鼠生存情况,通过Kaplan-Meier 的方法绘制生存曲线,Long-rank 分析方法比较各组小鼠生存率之间的差异。同时观察和记录小鼠的一般情况,包括体重变化(每3 d 测量1 次,减少操作应激对小鼠的影响)、皮毛、腹泻、活动度和食欲,判断小鼠是否发生了aGVHD。 根据Cooke 等[23]的临床aGVHD 评分标准,见表2,在移植后d8 对各组小鼠的aGVHD 症状进行评分。

表2 aGVHD 的临床评分标准
1.5.2 嵌合分析 取移植后d7 aGVHD 组小鼠和健康对照组BALB/C 小鼠的骨髓细胞制备单个核细胞悬液,加入2 μL APC 标记的H2KB 和PB450 标记的H2Kd 抗体,30 min 后流式细胞仪检测受鼠骨髓中供鼠细胞的植入情况,嵌合度=(H-2KB+细胞数)/ (H-2KB+细胞数+H-2Kd+细胞数) ×100%,移植后小鼠显示供鼠组织相容性抗原H-2KB 大于90%以上表明骨髓移植成功。
1.5.3 CBA 细胞炎性因子定量检测 取移植后d7 aGVHD组小鼠和ECP 预防组不含抗凝剂的外周血,4℃静置2 h,4℃下3 000 g 离心20 min,取上清严格按照CBA 试剂盒说明书进行操作,染色3 h 流式细胞仪检测各组之间IFN-γ、IL-2、TNF、IL-4 和IL-6 细胞因子的分泌情况。
1.5.4 流式细胞术检测Th1 类反应 取移植后d7 aGVHD组小鼠和ECP 预防组脾脏单个核细胞悬液,加入淋巴细胞刺激剂,8h 后收集细胞加入2μL PrECP-Cy5.5 标记的CD45,FITC 标记的CD3 和PE-CY7 标记的CD4 进行表面染色,而后加入破膜剂离心去上清,加入2 μL PE 标记的IFN-γ 和APC 标记的IL-4 进行胞内染色,最后重悬细胞流式细胞仪检测。
1.6 统计学分析 应用Graph Prism9 进行图像处理,采用SPSS 25.0 软件进行统计学分析,数据用±s表示,多组间比较采用单因素方差分析,事后比较采用Bonferroni 矫正,P<0.05表示差异具有统计学上的意义。
2 结果
2.1 ECP 处理中200~300 ng/mL 的8-MOP 诱导小鼠脾脏细胞早期凋亡效率最高 通过Annexin V-FITC/PI 凋亡检测试剂盒检测ECP 处理中不同浓度8-MOP(50 ng/mL, 100 ng/mL, 200 ng/mL,300 ng/mL,600 ng/mL)的C57BL/6 小鼠脾脏单个核细胞的凋亡率。 Annexin V-/PI-标记的细胞是未凋亡细胞,Annexin V+/PI-标记的细胞是早期凋亡的细胞,Annexin V+/PI+标记的细胞是晚期凋亡细胞。 FlowJo 软件分析流式细胞仪测得的不同浓度8-MOP 的ECP 处理后小鼠脾脏细胞的早期凋亡率(%):14.18±0.865vs16.76±0.407vs18.83±0.404vs19.27±0.404vs14.5±0.529。 发现50 ng/mL,100 ng/mL 和600 ng/mL 的8-MOP 早期凋亡率均显著低于200 ng/mL 和300 ng/mL 的8-MOP(P<0.000 1,P<0.01,P<0.000 1,图1),而200 ng/mL 和300 ng/mL 的8-MOP 早期凋亡率不存在统计学差异(图1)。 故诱导小鼠脾脏细胞早期凋亡效率最高的8-MOP 浓度在200 ~300 ng/mL 之间,考虑到8-MOP 的低毒性本实验后续研究选取的8-MOP 浓度均为200 ng/mL。
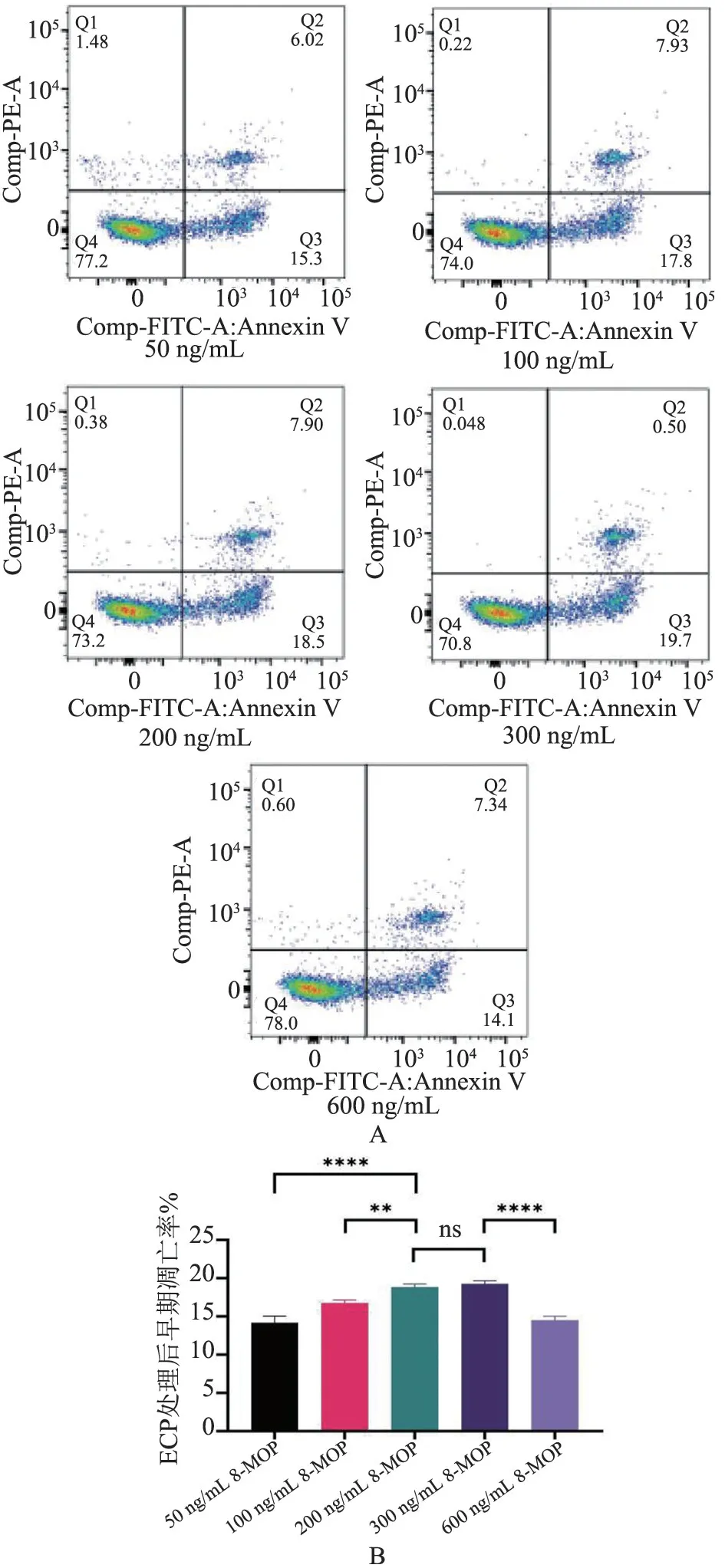
图1 ECP 处理中不同浓度8-MOP 的小鼠脾脏单个核细胞的凋亡率
2.2 aGVHD 小鼠模型的建立 如表1 所示构建各组小鼠实验模型,从临床症状来看,单纯照射组小鼠从d4 开始出现死亡,到d7 全部死亡,体重一直下降(图2A,B,C),小鼠不仅食欲下降而且活动明显减少,但是未出现典型的aGVHD 表现。所有同基因骨髓移植组小鼠在移植后健康存活,异基因骨髓移植小鼠也只在d6 死亡1 只,其余均健康存活,无aGVHD症状。 aGVHD 组小鼠在移植后d7 开始陆续死亡,至移植后12 d 无存活,存活率显著低于同基因和异基因骨髓移植组小鼠(P<0.01,P<0.01,图2B)。 而且aGVHD 组小鼠在移植后d4~d5 开始出现典型的aGVHD 的临床表现:弓背、立毛、腹泻、活动度下降和秃毛等症状(图2A);而其它组别小鼠无上述表现。 所有组别小鼠在移植后4 d 内体重急剧下滑,但随后同基因和异基因骨髓移植组小鼠体重逐渐恢复,而与aGVHD 组小鼠相比其体重则持续下降(P<0.01,P<0.01,图2C)。

图2 aGVHD 小鼠临床症状和移植后各组小鼠生存时间和体重变化
为了进一步明确移植后供者小鼠骨髓细胞是否嵌合成功,在移植后d7 取移植小鼠与健康对照BALB/C 小鼠的骨髓细胞进行流式染色分析,结果显示对照小鼠骨髓细胞未检测到H-2Kb 表达(图3A),移植小鼠则高表达H-2Kd 且嵌合度大于90%表明骨髓移植成功(图3B)。 以上数据说明异基因造血干细胞移植后骨髓细胞和供者淋巴细胞混合输注可成功诱导小鼠aGVHD 模型。
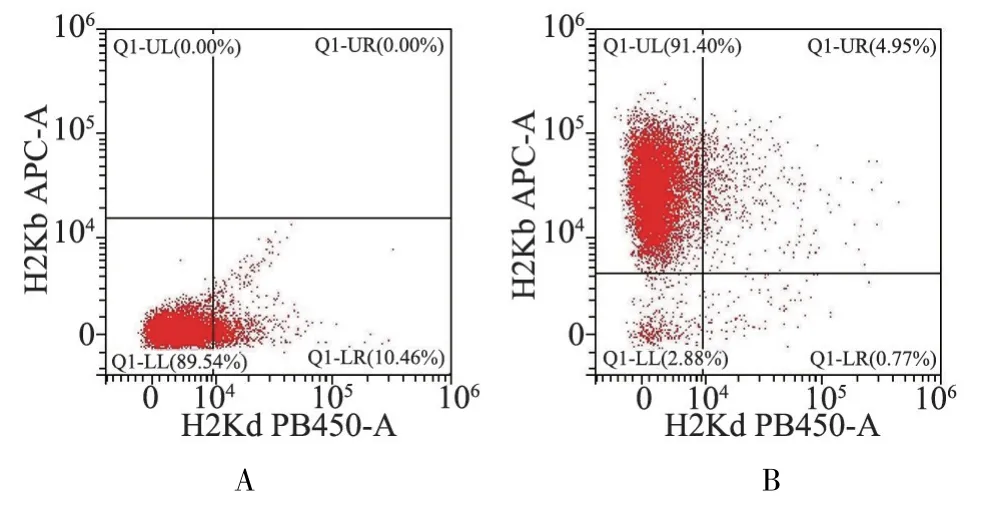
图3 流式细胞术检测移植后小鼠的嵌合度
2.3 ECP 预防aGVHD 的发展 比较aGVHD 组小鼠和ECP预防组小鼠的生存曲线可以发现,ECP 预防处理明显延长了aGVHD 小鼠的生存周期(P<0.05,图4A)。 移植后两组小鼠体重均在4 d 内出现急剧下降,ECP 预防组小鼠体重略高于aGVHD 组小鼠,但是差异无统计学意义(图4B)。 骨髓移植后d5 开始,aGVHD 组小鼠开始出现典型的aGVHD 的临床症状:弓背、立毛、腹泻、活动度下降和秃毛,ECP 预防组虽然也有上述表现,但是相比之下症状较轻微,且没有进一步恶化,其临床评分显著低于aGVHD 组(P<0.05,图4C)。
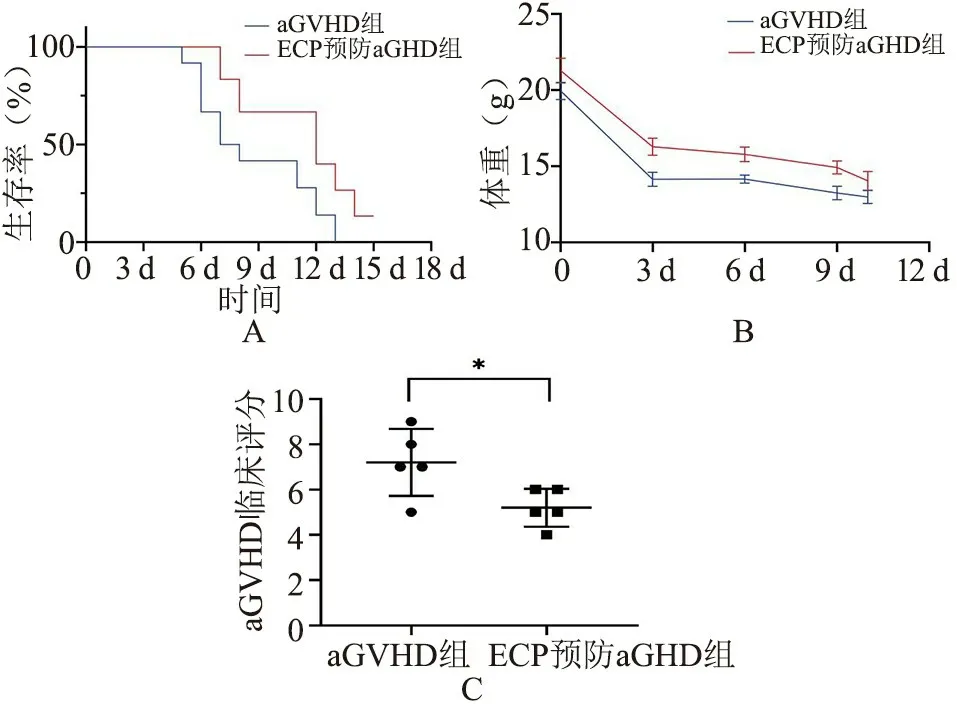
图4 移植后ECP 预防组和aGVHD 组小鼠生存时间、体重和临床评分的变化
2.4 ECP 降低aGVHD 小鼠体内炎症,抑制Th1 类反应 移植后7 d,取aGVHD 组和ECP 预防组小鼠的外周血,用CBA法检测血清中Th1/Th2 细胞因子的浓度变化,可见ECP 预防组小鼠血清中Th1 类细胞因子(IFN-γ,IL-2 和TNF)浓度较aGVHD 组显著下降(P<0.05,图5A),而Th2 类细胞因子(IL-4 和IL-6)浓度两者无统计学差异(图5B)。
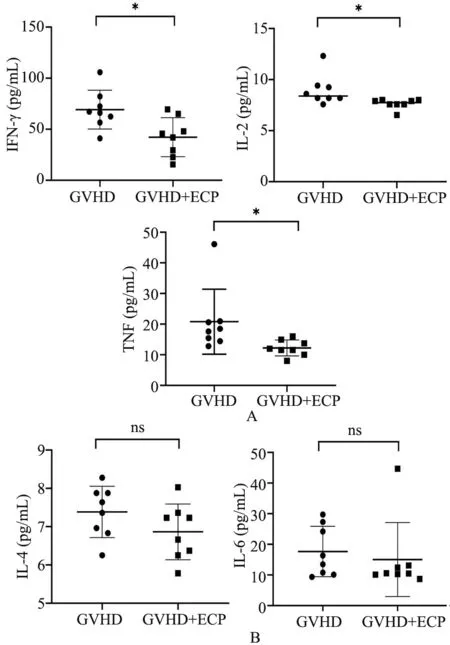
图5 ECP 预防组和aGVHD 组小鼠外周血Th1/Th2 细胞因子浓度比较
取各组小鼠移植后7 d 的脾脏行流式细胞术检测CD4+T 淋巴细胞中Th1 类细胞占比,计算Th1 类细胞绝对数(每1万个脾脏有核细胞中的数量),可见ECP 预防组中Th1 类淋巴细胞绝对数<aGVHD 组(P<0.05,图6A、B、C)。
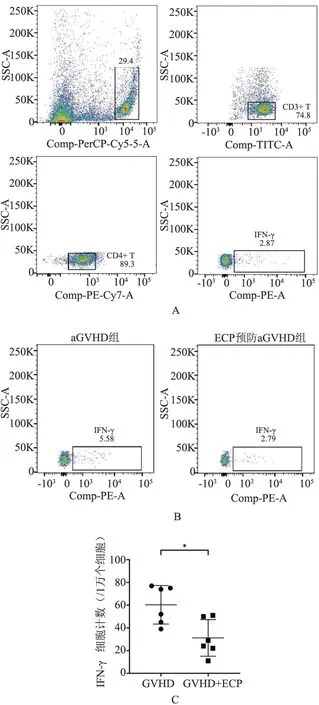
图6 ECP 降低了aGVHD 组小鼠体内Th1 类反应
3 讨论
aGVHD 是造血干细胞移植是否治愈以及决定患者移植后长期生存的重要因素[24]。 然而,传统药物在有效缓解排异症状的同时不可避免地降低了机体的免疫功能,导致部分患者出现严重感染,甚至原有疾病复发[3,25]。 近年来细胞疗法作为1 种新兴手段,在aGVHD 的动物模型和临床研究上已有很多成功的探索与实践,多种细胞在调控aGVHD 发生与发展的过程中更有特异性,相较传统药物疗法更具有安全性[26-28]。
ECP 不仅仅是1 种细胞疗法,同时也是aGVHD 患者临床治疗的重要二线方案和潜在的一线治疗手段[29],治疗的有效性和安全性是其最大的优势。 美国单采协会(AmeriCAn SoCieTy for Apheresis,AFSA)收集了近年来临床ECP 治疗aGVHD 的临床数据发现患者的部分缓解率约为65%,显著延长了患者的生存周期,虽然不同的治疗方案、不同部位的受累器官和aGVHD 严重程度导致ECP 的疗效差异较大,但患者均未出现严重的不良反应[30]。 但是ECP 对机体免疫功能的影响,在不同疾病和不同患者中是十分复杂和多变的,故本实验成功构建小鼠aGVHD 模型,证实了移植前单剂量ECP 处理过的细胞可以减少aGVHD 的发生,并且显著延长了小鼠骨髓移植后的存活率,这部分研究结果与Alin 等[20]的临床研究结果一致,提示了ECP 作为1 种细胞疗法在aGVHD 预防中的潜力。
GVHD 的发生主要包括3 个过程:1)放化疗损伤组织器官,引发宿主细胞分泌各种炎性因子,并激活抗原呈递细胞(antigen-presenting cell,APC);2)供者T 细胞通过识别宿主APC 提呈的异基因抗原而被异常激活和扩增,尤其是Th1 类细胞的扩增,分泌大量IFN-γ 同时分化为效应T 细胞,;3)最后大量炎性因子的分泌形成“细胞因子风暴”和效应T 细胞作用于小肠、皮肤、肝脏和肺脏等靶器官和组织,造成临床aGVHD 的 发 生[4]。 2002 年Francine 等[31]第1 次 揭 示 了ECP 用于治疗aGVHD 的免疫机制,发现ECP 治疗后体内Th1 向Th2 转变,说明ECP 抑制了“细胞因子风暴”,建立特异性免疫耐受。 2006 年人们对ECP 治疗aGVHD 引起的免疫耐受有了更加进一步的认识和了解,认为ECP 治疗主要通过回输凋亡的淋巴细胞来触发体内的一系列免疫耐受机制,从而抑制细胞因子风暴[32]。 然而不同于临床在aGVHD发生之后采取ECP 治疗,我们则是在aGVHD 发生之前回输了单剂量的ECP 处理过的细胞,不仅观察到一定的临床预防作用,后续进一步的流式细胞术也发现与aGVHD 组相比,ECP 预防组小鼠Th1 类细胞数量明显减少(P<0.05),同时IFN-γ,IL-2 和TNF 细胞因子的浓度也显著下降(P<0.05),说明ECP 可能依赖早凋的细胞来预防小鼠aGVHD 的发生,这可能是其抗aGVHD 的关键机制之一。 移植前回输单剂量ECP 诱导的早期凋亡的脾脏单个核细胞抑制了Th1 类细胞的异常扩增,也减弱了“细胞因子风暴”的影响,阻止了aGVHD 的发生发展,说明ECP 不仅仅可以治疗aGVHD,也能起到一定的预防作用。 由此可见,ECP 无疑是1 种十分有前景的细胞治疗手段,这部分的结果为临床使用ECP 预防aGVHD 提供了新的实验证据。
尽管我们的研究结果表明了ECP 在防治aGVHD 方面的巨大潜力,但仍存在一些研究限制。 首先,本研究使用小鼠作为模型进行实验,结果仍需要在人体中进行验证。 其次,我们仅观察了ECP 处理对细胞的早期凋亡的影响,对于ECP 处理后细胞的长期影响仍需要进一步研究。 ECP 发挥免疫调控的机制十分复杂,涉及许多方面,目前已得到公认的基础机制:细胞因子分泌模式从促炎转变为抑炎[33],诱导耐受性树突状细胞(tolerogenic dendritic cell,TolDC)和调节性T 细胞(regulatory T cells, Treg)的产生[34]。 有研究表明ECP 处理的细胞所提供的凋亡信号会直接影响宿主APC[14],而DC 则是迄今为止功能最强大的APC,具有免疫应答和免疫耐受两种功能,对维持免疫平衡具有重要作用[35]。 从功能讲,能够诱导免疫耐受的DC 群定义为TolDC,TolDC 主要由未成熟DC(immature DC,imDC)组成。imDC 低水平表达CD83,同时还低水平表达与T 细胞激活密切相关的MHC-Ⅰ、MHC-Ⅱ类分子、协同刺激分子(CD80 和CD86),因此imDC 抗原摄取、加工处理能力较强,但诱导T细胞免疫应答能力较弱,故可介导耐受作用[36-37]。 2008 年一项临床研究[38]发现,aGVHD 患者经ECP 治疗后的凋亡淋巴细胞与imDC 共培养后,可以截断imDC 的成熟,故本实验中经ECP 处理后的早凋细胞也可能通过宿主DC 来调节机体的免疫功能,DC 细胞不仅仅是目前ECP 研究领域的热点,也是本课题的下一步研究方向。
综上所述,本研究通过以C57BL/6 小鼠作供鼠,BALB/C小鼠作受鼠,经X 射线8Gy 全身照射后,尾静脉输注供鼠骨髓细胞和脾细胞,可成功建立小鼠aGVHD 模型。 通过预防性输注ECP 诱导的早期凋亡细胞可减少aGVHD 的发生,显著延长了小鼠骨髓移植后的存活率。 本研究为ECP 在aGVHD 预防中的应用提供了理论基础,为进一步研究ECP的机制和优化治疗方案提供了方向。 未来的临床研究可以进一步在人体中验证ECP 的预防作用,并探索其在不同类型GVHD 中的作用机制。
利益冲突:所有作者均声明不存在利益冲突。
