应用16S rRNA基因测序比较分析不同品系1型糖尿病小鼠肠道菌群的异同*
2023-11-02丁登峰牛苗苗
刘 军 丁登峰 高 伟 陈 华 牛苗苗
(中国人民解放军总医院,北京 100853)
糖尿病已成为当今社会最严重和最常见的慢性疾病之一[1]。流行病学研究显示,2022年1型糖尿病(type 1 diabetes mellitus,T1DM)患者有875万人,是2017年的8倍,其中152万T1DM患者的年龄不到20岁,严重影响儿童和青少年的生命健康[2-3]。T1DM是一种复杂的自身免疫性疾病,其特征是由自身反应性T细胞引起的β细胞功能障碍和死亡,导致胰岛素合成和分泌异常[4-5],使患者出现以胰岛素绝对缺乏和高血糖为特征的葡萄糖代谢紊乱[6-8]。目前虽然已有大量研究关注T1DM的病理生理机制,但其确切机制仍不明确。目前已知的T1DM病因涉及多种因素,主要包括自身免疫、遗传易感、病毒感染、饮食、肠道菌群等[9-11]。近年的大量研究显示,肠道菌群在T1DM的发生和发展中起着越来越重要的作用[12]。B6和FVB小鼠T1DM模型是研究T1DM的重要动物模型,对于其肠道菌群特征目前研究报道较少。本研究采用腹腔注射STZ的方法制备B6和FVB小鼠T1DM模型,采集各组小鼠成模后6周的粪便进行16S rRNA测序,研究两种T1DM模型小鼠肠道菌群的组成特征和功能,并分析与人类T1DM患者肠道菌群的异同,为探索两模型在T1DM相关肠道菌群研究中的进一步应用提供背景数据。
所有数据输入SPSS 16.0软件进行统计分析,计量资料均以表示,符合正态性分布,两组独立样本均数比较使用t检验,多组间比较使用方差分析,组间相互比较使用LSD检验,计数资料使用χ2分析。
1 材料和方法
1.1 材料
1.1.1实验动物分组及处理:SPF级B6小鼠,雄性,8周龄,体质量22~25 g左右,20只,购自斯贝福(北京)生物技术有限公司,生产许可证号【SCXK(京) 2019-0010】。SPF级FVB小鼠,雄性,8周龄,体质量22~25 g左右,20只,购自北京华阜康生物科技股份有限公司,生产许可证号【SCXK(京) 2020-0004】。动物饲养于中国人民解放军总医院实验动物中心屏障系统内,使用许可证号【SYXK(军) 2017-0019】,室温22~24 ℃,相对湿度在40%~60%,适应性喂养1周后,每只小鼠每天按照40 mg/kg的剂量腹腔注射STZ(pH 4.5的0.01 mmol/L柠檬酸盐缓冲液配制),连续注射5 d。小鼠空腹血糖连续2周≥11.1 mmol/L为T1DM建模成功。本实验通过解放军总医院实验动物福利伦理委员会的审查,伦理审批号:2022-x18-130,实施过程中严格遵守其指导原则。
1.1.2主要试剂及仪器:STZ(西格玛奥德里奇公司),血糖仪(Johnson &Johnson公司),MOBIO强力粪便基因组DNA提取试剂盒(QIAGEN公司),Microfuge R22R Centrifuge台式高速低温离心机(贝克曼库尔特公司);NanoDrop 2000/2000C超微量分光光度计(Thermo公司);PCR仪(杭州朗基科学仪器有限公司的 A200 基因扩增仪)。
1.2 方法
1.2.1粪便标本的收集、保存及DNA的提取:分别收集两组小鼠出现糖尿病症状6周后的粪便各10份。每次收集粪便前将每只小鼠单独放在一个消毒的动物笼盒里,自由活动30 min,收集小鼠粪便约0.2 g,粪便置于1.5 mL无菌EP管中,-80 ℃冰箱保存待用。按照QIAGEN粪便基因组DNA提取试剂盒说明书提取实验动物粪便中的细菌DNA;测量DNA浓度后,将样品置于-80 ℃冰箱储存待用。
1.2.2细菌DNA的扩增及测序结果分析:使用杭州联川生物技术股份有限公司合成的Barcode 通用引物341F (5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)在16S rRNA V3-V4高可变区进行PCR扩增,PCR反应扩增条件:98 ℃预变性30 s;随后98 ℃变性10 s,54 ℃退火30 s,72 ℃延伸45 s,共计扩增35个循环;最后72 ℃延伸10 min。对扩增产物采用2%的琼脂糖凝胶电泳定量检测后,进行16S rRNA基因高通量测序(DNA建库测序工作由杭州联川生物技术股份有限公司完成)。获得原始数据Raw Data,利用overlap将双端数据进行拼接,并进行质控、嵌合体过滤,获得高质量的Clean Data。DADA2(Divisive Amplicon Denoising Algorithm)不再以序列相似度进行聚类,而是通过“去重复”等步骤,进而获得单碱基精度的代表序列,大大提升了数据精确度与物种分辨率。DADA2的核心是去噪,然后使用ASVs (Amplicon Sequence Variants)的概念构建类OTUs (Operational Taxonomic Units)表,获得最终的ASVs特征表以及特征序列,进一步进行多样性分析、物种分类注释和差异分析等。
1.3 统计学分析
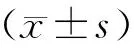
2 结果
2.1 16S rRNA测序
那是我离满目星河最近的时刻,站在天与地之间,踩着4000米海拔的色达。那时夏天初来,我裹着棉袄,脚踝冰冷,耳垂滚烫。
注:A.两组小鼠粪便测序得到无重复的ASVs数目;B.两组小鼠粪便测序得到平均ASVs数目。 Note:A. Faecal sequencing of two groups of mice yielded the number of ASVs without duplication;B. The average number of ASVs was obtained by fecal sequencing of two groups of mice.图1 两组T1DM小鼠粪便测序得到的ASVs数量Fig.1 Number of ASVs obtained from fecal sequencing of two groups of T1DM mice
2.2 两组小鼠肠道菌群物种组成分析
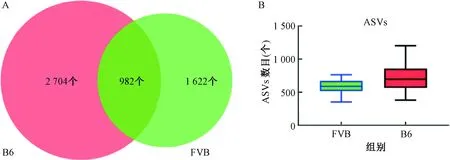
在“科”水平上,B6组主要以属于拟杆菌门的Muribaculaceae菌科(33.91%)和普雷沃菌科(Prevotellaceae,5.25%),属于厚壁菌门的乳酸杆菌科(Lactobacillaceae,30.22%)、毛螺菌科(Lachnospiraceae,5.6%)、未分类梭菌科菌属(Clostridiales_unclassified,2.20%)、未分类梭菌属_UCG-014(Clostridia_UCG-014_unclassified,1.11%)和丹毒丝菌科(Erysipelotrichaceae,1.02%),属于脱硫杆菌门的脱硫弧菌科(Desulfovibrionaceae,3.38%),属于疣微菌门的阿克曼菌科(Akkermansiaceae,2.67%),属于髌骨细菌门的Saccharimonadaceae菌科(1.04%)为主,优势菌科为Muribaculaceae、Lactobacillaceae、Lachnospiraceae、Prevotellaceae、Desulfovibrionaceae、Akkermansiaceae;FVB组主要以属于厚壁菌门的毛螺菌科(Lachnospiraceae,21.02%)、乳酸杆菌科(Lactobacillaceae,15.63%)、未分类梭菌科菌属(Clostridiales_unclassified,4.36%)、链球菌科(Streptococcaceae,3.18%)、瘤胃球菌科(Ruminococcaceae,2.89%)和丹毒丝菌科(Erysipelotrichaceae,2.64%)和未分类梭菌属_UCG-014(Clostridia_UCG-014_unclassified,1.31%),属于拟杆菌门的Muribaculaceae菌科(17.15%)、普雷沃菌科(Prevotellaceae,4.84%)、Marinifilaceae菌科(3.25%)、拟杆菌科(Bacteroidaceae,2.44%)和理研菌科(Rikenellaceae,2.32%),属于髌骨细菌门的Saccharimonadaceae菌科(3.33%),属于疣微菌门的阿克曼菌科(Akkermansiaceae,2.03%)为主,优势菌科为Lachnospiraceae、Muribaculaceae、Lactobacillaceae、Prevotellaceae、Clostridiales_unclassified、Saccharimo-nadaceae、Marinifilaceae,见图2B。
注:A.两组小鼠肠道菌群在菌门水平的分类组成;B.两组小鼠肠道菌群在菌科水平的分类组成。 Note:A. Taxonomic composition of the gut microbiota at the phylum level; B. Taxonomic composition of the gut microbiota at the family level.图2 分类图显示两组在不同分类水平的相对丰度Fig.2 Taxonomic plots showing relative abundance of the two groups at phylum and family levels
在“门”水平上,B6组主要以厚壁菌门(Firmicutes,45.91%)、拟杆菌门(Bacteroidetes,42.21%)、脱硫杆菌门(Desulfobacterota,3.38%)、疣微菌门(Verrucomicrobia,2.67%)、变形菌门(Proteobacteria,2.59%)、放线菌门(Actinobacteriota,1.55%)、髌骨细菌门(Patescibacteria,1.05%)为主,优势菌门为Firmicutes、Bacteroidetes和Desulfobacterota;FVB组主要以厚壁菌门(Firmicutes,58.68%)、拟杆菌门(Bacteroidetes,30.15%)、髌骨细菌门(Patescibacteria,3.34%)、变形菌门(Proteobacteria,2.62%)、疣微菌门(Verrucomicrobia,2.03%)、放线菌门(Actinobacteriota,1.77%)为主,优势菌门为Firmicutes、Bacteroidetes、Patescibacteria和Patescibacteria,见图2A。
2.3 两组小鼠粪便中菌群多样性分析
为了进一步评估宿主肠道菌群的功能及作用,本研究使用PICRUSt2软件对T1DM小鼠肠道菌群的16S rRNA基因进行功能通路的预测。PICRUSt2对肠道菌群的通路分析显示,B6和FVB组T1DM小鼠中共有30个代谢通路发生了显著改变。两组相比,有9条通路在B6组T1DM小鼠中表达上调(P< 0.05);其余21条通路在FVB组T1DM小鼠中表达下调(P<0.05);这些功能通路集中在以氨基酸代谢、糖代谢及核苷酸代谢为主的代谢途径中,如图8所示。两组T1DM小鼠的肠道菌群都参与了多条代谢途径,在T1DM小鼠体内有更多的代谢途径被激活,这与T1DM的代谢性疾病相一致。
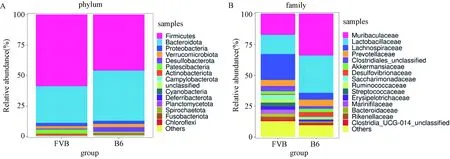
注:A.Observed species指数;B. Chao1指数;C. Simpson指数;D. Shannon指数。Note:A. Observed species index; B. Chao1 index; C. Simpson index; D. Shannon index.图3 两组T1DM小鼠肠道菌群Alpha多样性指数的比较Fig.3 Comparison of Alpha diversity index of gut microbiome in two groups of T1DM mice
2.3.2Beta多样性分析:B6组与FVB组相比肠道菌群组成不同。在菌门水平上,UPGMA聚类树和PCoA分析结果都表明,B6与FVB组小鼠在菌群构成上明显不同,见图4A(ANOSIMP=0.001)和C;从PCA和NMDS分析结果来看,B6与FVB组小鼠在菌群构成上有一定的相似性,见图4B(ANOSIM,P=0.001)和D。上述分析结果表明,B6组和FVB组小鼠T1DM模型的肠道菌群构成存在差异,但也有一定相似性。
B6和FVB组20份糖尿病小鼠粪便样本16S rRNA测序共观察到5 308个独特的扩增子序列变异(ASVs)数目,B6组特有2 704个ASVs,FVB组特有1 622个ASVs,两组共有982个ASVs,见图1A。B6组平均每个样品获得726个ASVs,FVB组平均每个样品获得584个ASVs(包括两组间重复的ASVs),对两组的ASVs数据进行比较分析,差异无统计学意义(P>0.05),见图1B。平均每个样品测序序列数为75 672条,经过筛选后有效序列占86.88%,两组样品平均覆盖率(goods coverage)为100%,差异无统计学意义(P>0.05)。序列长度为400~500 bp,与16S rRNA V3-V4 区域序列长度吻合,该数据符合后续结果分析标准。
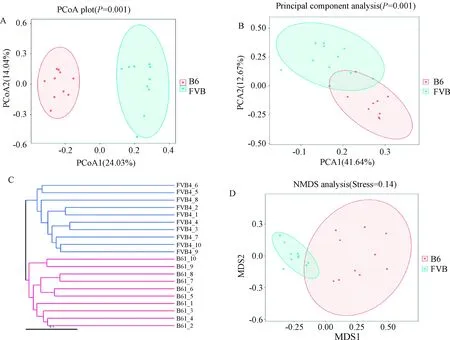
注:A.肠道菌群加权的主成分分析图;B.肠道菌群主坐标分析图;C.肠道菌群加权的UPGMA聚类分析图;D.肠道菌群加权的NMDS分析图。Note:A. PCoA Map of the weighted mice gut microbiome in two groups; B. PCA Map of the mice gut microbiome in two groups;C. UPGMA cluster analysis of the weighted mice gut microbiome in two groups; D.NMDS Map of the weighted mice gut microbiome in two groups.图4 两组T1DM小鼠肠道菌群Beta多样性指数的比较Fig.4 Comparison of Beta diversity index of gut microbiome in two groups of T1DM mice
2.3.3肠道菌群的差异分析:B6与FVB组小鼠肠道菌群在菌科水平的丰度对比分析热图结果显示,B6组的Muribaculaceae、Lactobacillaceae、Prevotell-aceae、Akkermansiaceae和Desulfovibrionaceae菌科的相对丰度比FVB组高;B6组的Lactobacillaceae、Clostridiales_unclassified、Saccharimonadaceae、Rumino-coccaceae、Streptococcaceae、Erysipelotrichaceae、Marinifil-aceae、Bacteroidaceae、Rikenellaceae和Clostridia_UCG-014_unclassified菌科的相对丰度比FVB组低,见图5A。在菌属水平的热图结果显示,B6组的Muribaculaceae_unclassified、Ligilactobacillus、Lactoba-cillus、Muribaculum、Alloprevotella、Akkermansia和Desulfovibrio菌属的相对丰度比FVB组高;B6组的Lachnospiraceae_NK4A136_group、HT002、Clostridiales_unclassified、Candidatus_Saccharimonas、Prevotell-aceae_UCG-001、Odoribacter、Bacteroides和Lactococcus菌属的相对丰度比FVB组低,见图5B。上述分析结果表明,B6和FVB组T1DM小鼠的肠道菌群构成比例存在差异。
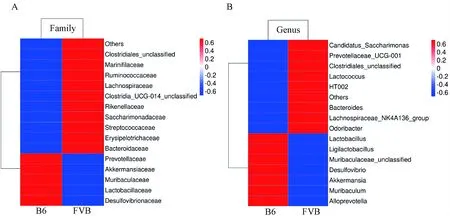
注:A.科水平热图结果;B.属水平热图结果。Note:A. Results of families heat map; B. Results of genus heat map.图5 两组T1DM小鼠肠道菌群在科和属水平热图显示存在不同Fig.5 Heat map comparison of gut microbiome of two groups of T1DM mice at family and genus levels
2.4 肠道菌群生物标志物的筛选分析
LEfse结果分析显示,B6与FVB组相比,有2个菌科、2个菌属和3个菌种有显著差异;FVB组与B6组相比,有1个菌门、2个菌纲、4个菌目、5个菌科、5个菌属和5个菌种有显著差异,见图6A,B。在B6组中,显著改变的菌科是Muribaculaceae和Lactobacillaceae,显著改变的菌属是Muribaculaceae_unclassified和Ligilactobacillus;FVB组中,显著改变的菌门是Patescibacteria,显著改变的菌科是Lachnospiraceae、Marinifilaceae、Streptococcaceae和Saccharimonadaceae,显著改变的菌属是Lachnospiraceae_NK4A136_group、HT002、Odoribacter、Lactococcus和Candidatus_Saccharimonas。
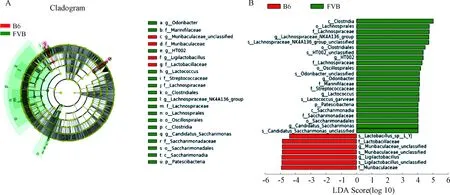
注:A.LEfSe分析提供了门到种的系统发育分布;B.LDA评分识别两组之间的差异菌(LDA评分≥4.0)。Note:A. LEfSe analysis providing phylum-to-species phylogenetic distribution; B. LDA scores identifying differential entities between the two groups (LDA score ≥4.0).图6 B6和FVB组T1DM小鼠肠道差异菌的分布Fig.6 Distribution of gut differential bacteria in T1DM mice in the B6 and FVB groups
2.5 肠道菌群厚壁菌门与拟杆菌门比值分析
4.2 固定资产管理 固定资产管理是整个系统的核心部分,在该部分可以看到每台设备的详细状况,包括固定资产卡片、安装培训、验收、合同、招标、购置申请等整个生命周期的信息,具体运行效果见图5。
研究发现,厚壁菌门和拟杆菌门存在一种相互促进的共生关系,它们共同促进宿主吸收和储存能量,两者在消化道的比例对发酵多糖非常重要,厚壁菌门与拟杆菌门的比值(F/B)升高有助于促进肥胖的发病[14]。厚壁菌门与拟杆菌门的比值升高或降低说明肠道菌群已经失调,机体发生疾病的风险就会增加。B6组T1DM的F/B为1.09,与参考文献[15]研究的B6对照组小鼠在4、7和9周的F/B(分别为0.26、0.23和0.21)的平均值0.23相比增加了3.74倍;FVB组T1DM的F/B为1.95,与参考文献[16]研究的FVB对照组小鼠F/B等于0.53相比增加了3.70倍。结果显示,B6组和FVB组小鼠T1DM肠道菌群的F/B值都增加了,说明两组T1DM肠道菌群发生了失调(图7)。
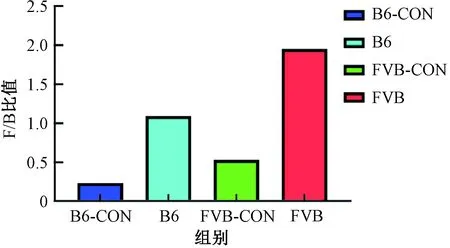
图7 厚壁菌门与拟杆菌门比值Fig.7 Ratio of Firmicutes to Bacteroidetes
2.6 肠道菌群功能预测分析
2.3.1Alpha多样性分析:B6组T1DM小鼠肠道菌群的Observed species指数和Chao1指数都高于FVB小鼠,但差异无统计学意义(P>0.05),见图3A,B;B6组小鼠肠道菌群的Simpson指数和Shannon指数都低于FVB组小鼠,但差异无统计学意义(P>0.05)见图3C,D。B6和FVB组1型糖尿病小鼠肠道菌群的丰富度和多样性无差异,不同品系对T1DM小鼠肠道菌群的丰富度和多样性影响较小。
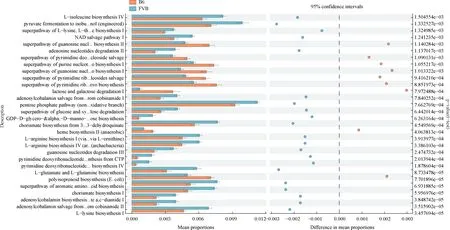
图8 B6组和FVB组T1DM小鼠肠道微生物群的PICRUSt2功能预测结果分析Fig.8 Analysis of PICRUSt2 function prediction results of gut microbiome in two groups of T1DM mice
3 讨论
T1DM动物模型的建立多采用经典的小剂量多次腹腔注射STZ,剂量通常为50 mg/kg,连续5 d,低剂量注射逐步损伤胰岛细胞,可以引发自身对胰岛的免疫应答,最终使模型动物血糖调节失代偿,出现多饮、多尿、血糖持续偏高的1型糖尿病症状,相比于单次大剂量注射,多次低剂量注射的成模率高,且死亡率低[19]。本研究采用经典的小剂量多次腹腔注射STZ的方法建立T1DM小鼠模型,小鼠空腹血糖连续2周≥11.1 mmol/L 为T1DM建模成功。在此基础上,我们重点研究不同品系T1DM小鼠肠道菌群的变化,以了解哪些菌群的改变与T1DM密切相关,以及哪一种T1DM小鼠模型肠道菌群谱的改变与人类T1DM菌群谱相似。前期研究发现,T1DM肠道菌群的多样性和丰富度在患儿和小鼠的肠道中都显著降低,且两者的Beta多样性与对照组相比也显著不同,这些研究结果表明,T1DM的患儿和小鼠肠道菌群的组成和功能发生了显著改变[20-21]。本研究结果显示,B6和FVB组T1DM小鼠肠道菌群的多样性和丰富度在两组中无显著差异(P>0.05),菌群组成以厚壁菌门、拟杆菌门和变形菌群为主,与研究人员[20-21]的T1DM肠道菌群结果基本一致。但是B6和FVB组T1DM小鼠的肠道菌群Beta多样性结果显示在两组间有显著差异(P<0.05)。研究发现,B6组和FVB组T1DM小鼠肠道菌群的优势菌群没有发生改变,但是优势菌群在不同模型中的组成比例发生了改变[20-21],这与本研究中的两组T1DM模型的结果一致。
宿主的健康与肠道菌群的多样性和稳定性密切相关,这些菌群与宿主相互作用有利于宿主营养物质的消化吸收和能量代谢,菌群代谢产物可以调节肠道局部和全身免疫应答,来维持肠道稳态[13]。研究发现,菌群紊乱与糖尿病的发展密切相关,肠道菌群参与T1DM发病机制的自身免疫反应可能与肽能肠神经元有关,它调节免疫细胞功能,影响前抗炎细胞因子的产生,导致神经退行性变和胰岛炎性反应[17-18]。
在本研究中,厚壁菌门和拟杆菌门是两组T1DM小鼠的优势菌门,占比88%左右,研究显示它们与肥胖和糖尿病密切相关,一些学者将厚壁菌门定义为“脂肪细菌”,将拟杆菌门定义为“瘦细菌”,随着厚壁菌门与拟杆菌门(F/B)比例的增加,这代表着肠道菌群已经发生紊乱,导致炎性反应和体质量指数的增加,胰岛素抵抗更容易发生,最终导致糖尿病的发生[22-23]。在本研究中,与其他研究的对照组小鼠相比,B6和FVB组T1DM小鼠肠道中F/B的比例明显增加(图7),提示T1DM的发生可能与F/B的比例变化有关。此外,在B6和FVB组T1DM小鼠肠道菌群中放线菌门丰度显著增加及其所属种类的丰富,可使宿主产生一系列炎性反应,增加代谢性、慢性疾病的发病风险。研究显示,T1DM的发病风险和进展与肠道菌群紊乱有关,与健康儿童相比T1DM患者和胰岛抗体阳性的亲属后来发展为T1DM的儿童表现出肠道菌群紊乱和革兰阳性菌与革兰阴性菌的比率降低,这些失衡可能会产生促炎环境和肠道渗漏,从而激活自身免疫过程导致T1DM的发生[22]。在本研究中B6组T1DM小鼠的优势菌科为Muribaculaceae菌科、乳酸菌科、毛螺菌科、普雷沃菌科、脱硫弧菌科和阿克曼菌科;FVB组T1DM小鼠的优势菌科为Muribaculaceae菌科、乳酸菌科、毛螺菌科、普雷沃菌科、未分类梭菌科菌属和Saccharimonadaceae菌科;毛螺菌科和乳酸杆菌科是厚壁菌门的主要成分,其中乳酸杆菌科是一种典型的能拮抗糖尿病的益生菌,近年来已被用于糖尿病的预防和治疗,在本研究中,B6和FVB组T1DM中乳酸杆菌科和毛螺菌科显著增加,乳酸杆菌科丰度增加可能与T1DM小鼠机体的免疫耐受有关,以便机体更好的应对疾病状态;毛螺菌科可以降解植物多糖,为宿主提供能量,从而使宿主获得更多的能量,毛螺菌科植丰度的异常增加可能是导致糖尿病、肥胖等代谢性疾病发病的因素之一。有研究显示,10岁左右T1DM患儿肠道中的Lachnospiraceae菌科相对丰度为5.8%、Erysipelotrichaceae菌科的相对丰度为0.6%和Ruminococcaceae菌科的相对丰度为0.4%[24],与本研究的B6组T1DM小鼠肠道的Lachnospiraceae菌科(5.6%)、Erysipelotrichaceae菌科(1.0%)和Ruminococcaceae菌科(0.98%)的构成比例基本一致,与本研究的FVB组T1DM小鼠肠道的Lachnospiraceae菌科(21.2%)、Erysipelotrichaceae菌科(2.64%)和Ruminococcaceae菌科(2.89%)的构成比例相差较大。有研究发现,在小于2.9岁的T1DM患儿肠道中的ClostridiumclusterIV的相对丰度为9.1%,与本研究中FVB组T1DM小鼠肠道的Clostridiales_unclassified(4.36%)的比例较为接近[25]。Clostridiumcluster在免疫调节和肠道稳态中发挥重要作用,因为它们通过产生短链脂肪酸(SCFA)来诱导辅助T细胞(Th)17细胞和控制着肠道固有层中Th17细胞的数量[26]。
2.选聘信息平台建设有利于优秀职业经理人的合理流动(使用)及信用体系的建立。有了被各方信任的职业经理人信息库,企业可以从中获得自己需要的职业经理人的真实信息,经理人不诚信行为必然被受到挑战,不敢随意做出损害企业或社会的事件。同时企业也必须建立起诚信的形象,才能吸引优秀的职业经理人加入。这样用人双方都必须维护自己的信用,才能获得更好的发展,良好的信用体系才能被建立。
详细的构建企业年度资金制度,结合企业此年内企业发展方向,收益分配制度、员工薪资待遇制度等实行项目决策,正确掌握企业的发展的经济状况。通过企业在市场上的发展和内部发展形式,将企业的融资方向,准则,方法等进行明确的计划。在实施过程中对可能出现的风险和融资成本进行预算估计,制定融资方案,对于涉及金额大的融资制度还需要进行可执行性的报告。
研究人员通过使用T1DM大鼠16S rRNA基因序列的功能预测显示,主要集中在以碳水化合物代谢、氨基酸代谢、核苷酸代谢、能量代谢、脂质代谢等为主要代谢途径中[27],这与本研究T1DM小鼠16S rRNA基因功能预测结果(集中氨基酸代谢、糖代谢及核苷酸代谢为主的代谢途径中)一致,符合T1DM的代谢机制。
(1)该水源地历年变化分析得出氨氮、总磷等水质指标有逐年好转的趋势,但是COD存在一定的水质恶化风险。
本研究结果显示,B6和FVB两组T1DM小鼠的肠道菌群的Alpha多样性和丰富度相同,但是肠道菌群的组成及比例不尽相同,为两模型在T1DM相关肠道菌群研究中的进一步应用提供了背景数据。
