2023年高考中有关共价键极性的试题探析
2023-10-26倪建娥
倪建娥
(江苏省常熟市教育局教学研究室,江苏 常熟 215500)
共价键的极性在《普通高中化学课程标准(2017年版2020年修订)》中有明确的要求.在“物质结构和性质”模块中的学业要求是“能利用电负性判断共价键的极性,能根据分子结构特点和键的极性来判断分子的极性”;在“有机化学基础”模块中的内容要求是“认识有机化合物分子中共价键的类型、极性及其与有机反应的关系,知道有机化合物分子中基团之间的相互影响会导致键的极性发生改变”[1].本文结合新版课标要求及人教版、苏教版两版教材对2023年各地高考卷中涉及共价键极性的部分试题,进行分类探析.
1 判断共价键的极性
共价键的极性是由成键原子吸引电子能力不同所造成的.苏教版教材选择性必修2“物质结构和性质”模块中对非极性共价键和极性共价键的描述是:当原子间形成共价键时,若两个成键原子吸引电子的能力相同,共用电子对不发生偏移,这样的共价键叫做非极性共价键;若两个成键原子吸引电子的能力不同,共用电子对发生偏移,这样的共价键叫做极性共价键[2].
在教学中,通常会总结这样的规律:同种元素原子间形成的共价键是非极性键,不同种元素原子间形成的共价键是极性键.事实上,同种元素原子吸引电子的能力不一定相同,这与原子在分子中所处的化学环境有关.同种元素原子间形成极性共价键的情况在有机化学中普遍存在,例如CH3COOH中的C—C键就是极性共价键.所以需要严谨地对待平时教学中的经验规律,或在使用时加上某些限定条件.
例1 (2023年江苏卷5节选)下列说法正确的是( ).
C.H2O2分子中的化学键均为极性共价键
解析H2O2分子的结构式为H—O—O—H,由于H和O原子吸引电子的能力不同,分子中的两个O—H键为极性共价键;由于两个氧原子所处的化学环境相同,吸引电子的能力相同,分子中的O—O键为非极性共价键,所以H2O2分子中既有非极性共价键又有极性共价键.此题C选项不正确.
2 利用元素电负性判断共价键极性的强弱
在极性共价键中,成键原子吸引电子能力有差别,共用电子对的偏移程度不同,共价键的极性强弱就不同.通常根据元素电负性差值的大小,判断共价键极性的强弱.两种成键元素间的电负性差值越大,共价键极性就越强.共价键极性的强弱对物质的化学性质有重要的影响.
例2 (2023年北京卷10节选)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( ).
B. 三氟乙酸的Ka大于三氯乙酸的Ka
解析氟的电负性大于氯的电负性,氟和碳的电负性差值大于氯和碳的电负性差值,所以F—C键的极性大于Cl-C键的极性,使F3C-的极性大于Cl3C-的极性,导致三氟乙酸羧基中羟基的极性更大,更容易电离出氢离子[3],酸性更强,所以三氟乙酸的Ka大于三氯乙酸的Ka.此题,B选项能通过比较氟元素和氯元素的电负性进行解释,不符合题意.
例3 (2023年湖北卷16节选)导致SiCl4比CCl4易水解的因素有____.
a.Si—Cl键极性更大 b.Si的原子半径更大
解析a选项:硅的电负性小于碳的电负性,硅和氯的电负性差值大于碳和氯的电负性差值,所以Si—Cl键的极性大于C—Cl键的极性, Si—Cl键更易断裂,SiCl4比CCl4更易水解.b选项:Si的原子半径比C的原子半径大,吸引电子能力弱,所以SiCl4中的共用电子对更偏向于Cl,导致Si—Cl键极性更大, Si—Cl键更易断裂,因此SiCl4比CCl4易水解.此题a、b选项均符合题意.
3 有机化合物分子中基团之间的相互影响导致共价键极性的改变
有机物中某些基团之间的相互影响,可以从化学键的角度去解释,其会导致共价键极性的改变,从化学键极性变化的角度解释和理解有机化合物分子中基团之间的影响,有助于拓展学习的视野和深度.

解析羰基为强吸电子基团,使相邻碳原子上的电子偏向羰基上的碳原子,使得相邻碳原子上的C-H键极性增强,易断裂.
例5 (2023年江苏卷15节选)化合物I是鞘氨醇激酶抑制剂,其合成路线如图1所示.

图1 合成路线
化合物A的酸性比环己醇的____(填“强”或“弱”或“无差别”).
解析化合物A中,羟基直接与苯环相连,羟基中氧原子p轨道上有孤电子对,氧的p电子云与苯环的大π键电子云从侧面重叠,形成p-π共轭体系,氧原子上的p电子云分散到整个共轭体系中,使氧原子上的p电子云向苯环转移,导致氧原子和氢原子间的电子云向氧原子方向转移,即O-H键极性增大,容易离解出H+.在环己醇分子中,环己基与苯基相比,有推斥电子的作用,使O-H键的电子云少偏向氧原子一点,所以O-H键极性较化合物A中酚羟基O-H键极性小.因此化合物A的酸性比环己醇的酸性强.
4 形成新的化学键后引起共价键极性的变化
分子或离子中化学键的极性,可能会在发生化学反应后引起改变,从而造成化学性质的变化.
例6 (2023年浙江卷6月17节选)给出H+的能力:NH3____[CuNH3]2+(填“>”或“<”),理由是____.
解析[CuNH3]2+中Cu2+和NH3形成配位键后,由于Cu2+对电子的吸引,电子云偏向Cu2+,使NH3中的N-H键极性变强,更易断裂,因此给出H+的能力:NH3<[CuNH3]2+.
例7 (2023年湖南卷14节选) N2H4是一种强还原性的高能物质,在航天、能源等领域有广泛应用.我国科学家合成的某Ru(Ⅱ)催化剂(用[L-Ru-NH3]+表示)能高效电催化氧化NH3合成 N2H4,其反应机理如图2所示.下列说法错误的是( ).
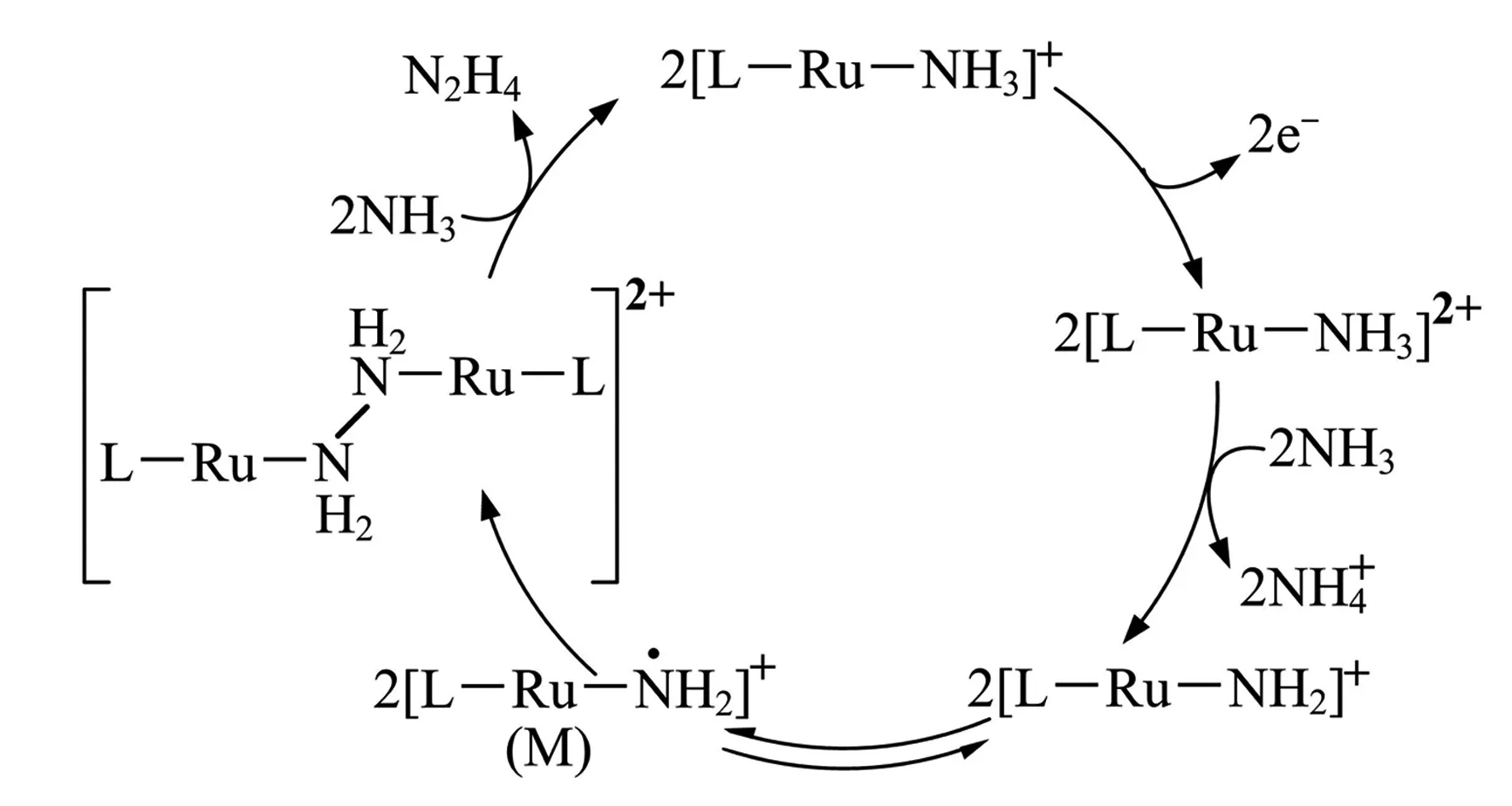
图2 反应机理
A. Ru(Ⅱ)被氧化至Ru(Ⅲ)后,配体NH3失去质子能力增强
解析根据图2[L-Ru-NH3]+→[L-Ru-NH3]2+的过程失去电子,即为Ru(Ⅱ)被氧化至Ru(Ⅲ)的过程.[L-Ru-NH3]2+中的Ru(Ⅲ)带有更多的正电荷,吸引电子的能力比Ru(Ⅱ)强,电子云偏向Ru(Ⅲ)更多,使配体NH3中的N-H键极性变强,更易断裂,因此失去质子(H+)的能力增强.此题A选项正确,不符合题意.
5 根据键的极性和分子结构特点判断分子的极性
对于分子极性的判断,苏教版教材主要是从分子的正电荷重心和负电荷重心是否重合的角度来研究;人教版教材侧重从分子中化学键极性的向量和是否等于零角度来研究.无论是哪个角度,都需要结合共价键的极性和分子的空间结构来确定.

D.H2O为非极性分子
解析水分子中含有两个O—H极性共价键,根据价层电子对互斥模型,水分子的空间结构呈V型,分子的正电荷重心和负电荷重心不重合或者是分子中化学键极性的向量和不等于零,H2O为极性分子.此题D选项不正确,不符合题意.
例9 (2023年北京卷10节选)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( ).
C. 氟化氢分子的极性强于氯化氢分子的极性
解析双原子分子的极性取决于成键原子之间的共价键是否有极性,分子极性的强弱取决于共价键极性的强弱.氟的电负性大于氯的电负性,氟和氢的电负性差值大于氯和氢的电负性差值,F-H键的极性大于Cl-H键的极性,所以HF分子的极性强于HCl分子的极性.此题,C选项能通过比较氟元素和氯元素的电负性进行解释,不符合题意.
