《原子核外电子的运动》教学中有关问题的探讨
2017-07-01周婕
周婕

摘 要:《原子核外电子的运动》(苏教版选修3)的内容纯理论部分,十分抽象,尽管教学的要求有限,让学生弄懂和运用这些知识决非易事。教学过程中学生往往难以理解,似懂非懂,在中学阶段且无法用实验来验证。怎样用浅显易懂的方法帮助学生理解和掌握这部分知识?笔者在教学过程中重点对以下几个问题进行讨论和强化,颇有效果,记录于后,以飨读者。
关键词:电子云;能层;能级;构造原理;几种表达式
中图分类号:G633.7文献标识码:A 文章编号:1992-7711(2017)12-007-2
一、电子云到底是什么?
电子云决不是电子在运动中产生的云雾,電子在核外运动过程中是不产生云雾的。电子是一种微观粒子,在原子极小的空间(直径约10-10米)内作高速运动。核外电子的运动与宏观物体运动不同,没有确定的方向和轨迹,只能用电子云描述它在原子核外空间某处出现机会的大小。
对宏观物体的运动,例如火车在轨道上奔驰,人造卫星按一定轨道围绕地球运行,都可以测定或根据一定的数据计算出它们在某一时刻所在的位置和速度,并能描绘出它们的运动轨迹。而核外电子在核外空间所处的位置及其运动速度不能同时准确地确定,也就是不能描绘出它的运动轨迹。在量子力学中采用统计的方法,即对一个电子多次的行为或许多电子的一次行为进行总的研究,可以统计出电子在核外空间某单位体积中出现机会的多少,这个机会在数学上称为概率密度。例如氢原子核外有一个电子,这个电子在核外好像是毫无规则地运动,一会儿在这里出现,一会儿在那里出现,但是对这个电子的千百万次运动状态统计而言,电子在核外空间的运动是有规律的,在一个球形区域里经常出现,如一团带负电荷的云雾,笼罩在原子核的周围,人们将其称之为电子云。倘若有一高速摄像机跟踪电子并拍摄运动过程,将拍摄后的映像重叠便可得到电子云图像。从图像可看出,电子总是绕核作高速无规则运动,且近核区域出现频率最大,远核区域出现机会较少,也可以说,电子云是电子绕核运动过程中的概率分布图。有一点须强调,电子云上的小黑点决不是电子数,而是电子在核外某个区域运动中留下的痕迹。
例1.氢原子的电子云图中,小黑点离原子核近的区域较密,它表示( )
A.该区域电子较多
B.该区域电子出现的概率较大
C.电子只在该区域运动
D.电子在该区域运动速度快
答案:B
二、怎样理解能层(电子层)?
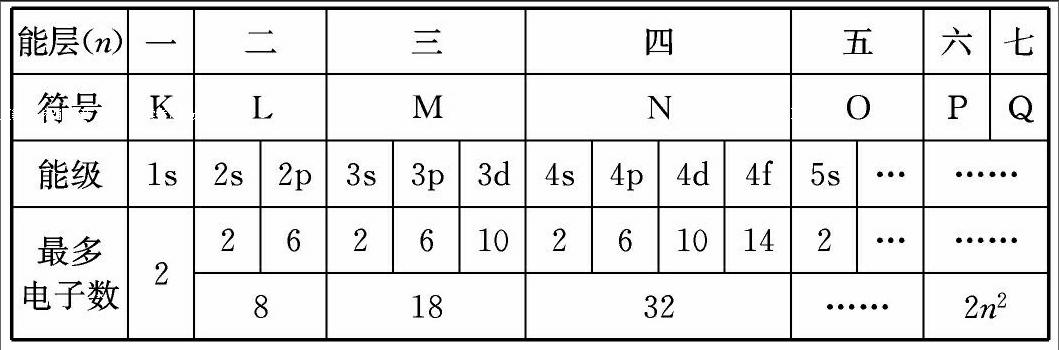
能层又称电子层,它是用来描述核外多电子的原子其电子运动情况的。在含有多个电子的原子中,各个电子的自身能量是不相等的,但能量相近是完全可能的,因此我们把能量相近的一组电子置于同一能层上运动,所以就有了能层(电子层)的出现。从离核的距离由近及远分别为K、L、M、N、O、P、Q(或一、二、三、四、五、六、七层)。随着人类对世界的不断探索,如果又发现了若干种新元素,则能层将继续扩大至R,S,T……(八、九、十层……)。就好像根据我们同学各自接受教育的年份和知识储备一样分为小学、初中、高中、大学等学段。电子自身能量最低的一组电子只能在近核的最内层运动,依能量从低到高序列,进入离核由近到远的不同区域运动。同理,电子自身能量最高的一组电子在最远核区域即最外能层上运动,在最外能层上运动的电子是得还是失,决定其元素的化学性质。能层(电子层)的层数由核外电子的数目决定。
例2.下面关于原子核外电子的运动规律叙述正确的是( )
A.原子核外多电子是分层运动的
B.能量低的电子在离核远的区域运动
C.所有电子在同一区域里运动
D.能量高的电子在离核远的区域运动
答案:A、D
三、如何理解能级(电子亚层)?
能级又称电子亚层,它是用来描述同一能层上电子运动状态的,如上所述同一能层上的电子自身能量相近而并非相等,这些电子又是怎样运动的?就好像我们都是高中学段,但又有高一、高二和高三之分。能层相当于高中部,能级只是高中部的某一个年级。同一能级又分为几个种类,分别为s、p、d、f……,其能量依次升高,它们又叫做能级的原子轨道。这些能级的原子轨道又对应不同的形状,ns能级为球形,np能级为纺锤形,nd能级为梅花瓣形,nf能级为不规则形,但不是每一能层均有相同种类的能级,能级的种类数由能层决定。例如:第一能层只有1s能级,第二能层有2s和2p能级,第三能层有3s、3p和3d能级,第四能层有4s、4p、4d和4f能级,原子轨道种类数与电子层序数相等,即第n层就有n种轨道。除了s电子云是球形外,其余能级的电子云都有方向,有几个方向就有几个轨道。s电子云是球形对称的,只有1个轨道,p电子云在空间有x、y、z 3个伸展方向,所以有3个轨道,分别记作:px、py、pz。d电子云有5个伸展方向,有5个轨道,f电子云有7个伸展方向,有7个轨道。它们的能量完全相同,电子云形状也基本相同。无论何种类型的轨道,一个轨道最多只能填充2个自旋方向相反的电子。
需要强调的是不同能层的相同能级,能层数越大,能量越高,例如:同为s能级,其能量1s<2s<3s<4s,同为p能级,其能量4p>3p>2p。
例3.下列有关说法正确的是( )
A.各能级的原子轨道数按s、p、d、f顺序分别为1、3、5、7
B.各能层含有的电子数为一定为2n2
C.各能层的能级都是从s能级开始至f能级结束
D.同一能层上电子的能量一定相等
答案:A
四、关于构造原理的再提炼
原子核外的多电子按构造原理依次布入运动轨道,但由于能级能量会发生交错的现象,例如:E3d>E4S;E6S 同样又可以用数字组记忆为:1、22、33、434、545、6456、7567。这样学生对于构造原理就易掌握,且书写电子排布式时就不会出错。 有一点须注意,在写电子排布式时,绝不能把同一能层的不同能级分开写,例如23号元素钒的电子排布式应写成:V 1s22s22p63s23p63d34s2,决不能写成:V 1s22s22p63s23p64s23d3,尽管排布时电子先进入4s轨道,再进入3d轨道。 五、关于核外电子的几种表达式 1.原子结构示意图 书写简单,十分明了,例如钠原子结构示意图中:,圆圈表示原子核,圆圈中的数字表示核电核数(质子数),弧形表示电子层,弧形上的数字表示该层的电子数,且能清晰地看出该元素原子核外有几个电子层,最外层上有几个电子,同时能推断出该元素在周期表中位置。但该表示法局限性很大,它只能表示主族元素和0族元素,对于副族元素却无能为力。 2.原子核外电子排布式 利用构造原理,按轨道能量从小到大(注意能量交错现象)依次将电子排入轨道,在书写过程中要注意两个原理和一个规则,例如K 1s22s22p63s23p64s1,该表达式的优点在于周期表中的所有元素均适用,且通过电子排布式准确地推断出该元素在周期表中位置,并推断其性质。 3.轨道表示式 其原理和核外电子排布式相同,且形象地将电子运动轨道用小方框或小圆圈表示,直接用↑↓表示在这个轨道中的两个电子的不同运动方向,直观、形象。至于何种方式表示,按题意要求作出正确选择。 《原子核外电子的运动》相关内容的掌握须通盘考虑,应用须周密思考,在电子排布过程中特别要注意一些特殊情况,只有多练、多思才能学好。
