山羊β-乳球蛋白分离及免疫反应性比较研究
2023-10-16薛海燕贺宝元
薛海燕, 张 磊, 周 妍, 马 军, 贺宝元, 孟 毅
(1.陕西科技大学 食品科学与工程学院, 陕西 西安 710021; 2.陕西科技大学 轻工科学与工程学院, 陕西 西安 710021; 3.陕西金牛乳业有限公司, 陕西 渭南 714000)
0 引言
β-乳球蛋白(β-lactoglobulin,β-Lg)是乳中主要过敏原之一[1],其相对分子量约为18.3 kDa.图1、图2为牛、山羊β-Lg三维立体结构,两者单体都是由162个氨基酸残基组成的.在pH为5~9时,羊乳的乳球蛋白比牛乳的乳球蛋白少3个负电荷,多一个正电荷残基,这也说明了二者结构的不同[2].
图1 牛β-Lg 三维立体结构
图2 山羊β-Lg 三维立体结构
关于羊乳的研究目前仅局限于羊乳掺入牛乳的检测方法[3]、羊乳贮存时间[4]与风味影响[5]等.张光艳等[6]研究了不同来源牛乳酪蛋白的过敏原性,结果表明酶法酪蛋白和胶束酪蛋白具有更高的过敏原性.白娜等[7]研究了不同乳样的过敏免疫原性,表明驼乳的致敏性明显低于牛乳,且与人乳相似.姜玉池等[8]在牛乳配方乳粉与山羊乳配方乳粉之间比较中,得出结论山羊乳配方乳粉的致敏性较弱,可作为牛乳的替代品,确定了羊乳与牛乳致敏性存在差异.尽管羊乳蛋白和牛乳蛋白组成极为相似,但山羊乳相对于牛乳的致敏性水平的高低还存在争议,尤其是山羊乳β-Lg的致敏性[9].
关于食物过敏和耐受的分子机制显示,免疫细胞分泌的细胞因子IL-2 、IL-4、IL-6、IL-12等参与耐受和过敏的网络调节[10].作为免疫系统中细胞与细胞间相互作用的信号分子,在免疫应答、免疫调节和炎症反应中能够发挥多种生物学效应.因此白介素类细胞因子能反映免疫反应性的高低.
本文采用牛、山羊乳β-Lg分别致敏Balb/c小鼠,通过比较致敏后超敏外观评分、体外培养小鼠淋巴细胞增值指数及细胞因子水平来建立牛羊乳β-Lg过敏动物模型,以此来反映牛羊乳免疫反应性差异,为牛羊乳致敏性的研究与探寻羊乳是否能作为牛乳过敏人群的代替乳源,提供一定的支撑依据和理论基础.
1 材料与方法
1.1 主要材料和试剂
山羊乳,陕西金牛乳业有限公司;标准牛乳β-Lg,美国sigma公司;HCl,Balb/c小鼠,购于西安交通大学;弗式完全佐剂,科昊生物工程有限责任公司;弗式不完全佐剂,科昊生物工程有限责任公司;红细胞裂解液,中晖赫彩生物医药科技有限公司;柠檬酸,天津市化学试剂六厂;胎牛血清(FBS),上海远慕生物科技有限公司;磷酸盐缓冲液干粉(PBS),西安赫特生物;SDS,普洛麦格生物技术有限公司;小鼠白细胞介素(IL-2、IL-4、IL-6、IL-12)ELISA试剂盒,江苏酶免实业有限公司;其余试剂均为分析纯.
1.2 主要仪器和设备
酶联免疫检测仪,热电上海仪器有限公司;HC-3018R高速冷冻离心机,安徽中科中佳科学仪器有限公司;PHS-3C型 pH 计,上海仪电科学仪器股份有限公司;HF90二氧化碳培养箱,赛默飞世尔科技有限公司;流式细胞仪,赛默飞世尔上海仪器有限公司;凝胶成像仪,立式压力蒸汽灭菌锅,上海申安医疗器械厂; Q-Sepharose Fast Flow色谱柱,美国GE公司;电泳仪,北京百晶生物技术有限公司;AKTA Purifier蛋白液相纯化色谱,美国GE公司;Bürker细胞计数器,美国sigma公司.
1.3 实验方法
1.3.1 羊乳清蛋白的分离
将鲜羊乳进行离心,离心温度为4 ℃,转速为5 000 r/min,时间为20 min,重复两次并过滤脂肪后即为脱脂羊乳,用HCl将脱脂羊乳的pH值调至4.1,室温下静置1 h后进行离心,离心速度5 000 r/min,时间为30 min,离心结束后上清液为羊乳清蛋白溶液[11].
1.3.2 羊乳β-Lg两种不同分离方法影响探究
(1)化学沉淀法分离羊乳β-Lg
羊乳清蛋白溶液用0.6mol/L的柠檬酸溶液调pH至3.1、3.3、3.5、3.7、3.9后45 ℃恒温水浴保温1 h,充分沉淀后将溶液离心,离心速度为10 000 r/min,时间为40 min,离心后保留上清液.加入7%、8%、9%、10%的NaCl加入上清液中,充分振荡使NaCl溶解,放入4 ℃冰箱冷藏静置一晚.再次将样品离心,速度为10 000 r/min,时间为40 min,上清液为羊β-Lg,将提取的蛋白溶液倒入8 000~14 000孔径的透析袋中充分透析,大约48 h后冷冻干燥,-20 ℃保存[12].
(2)超滤离心法分离β-Lg
选择孔径为50 kDa的超滤离心管,量取10 mL制备好的羊乳清蛋白溶液,离心温度为:4 ℃,速度为5 000 r/min,分别离心10 min、20 min、30 min.离心后透过液利用SDS-PAGE分析结果[13].
1.3.3 致敏小鼠
将Balb/c小鼠随机分成三组:羊乳β-Lg致敏组、牛乳β-Lg致敏组、PBS阴性对照组,每组六只.如图3所示,牛、羊乳β-Lg致敏组均在第0、7和14天用100 μg弗氏佐剂(首次免疫用完全佐剂,加强免疫用不完全佐剂)混合200 ul抗原对小鼠进行腹腔注射免疫,对照组注射等量无菌PBS;在第15天、22天和29天,牛、羊乳β-Lg致敏组改用含有霍乱毒素作为粘膜佐剂的200 ul抗原口服灌胃致敏小鼠,对照组口服等量无菌PBS[14].所有组在末次免疫后分离小鼠淋巴细胞进行体外培养.
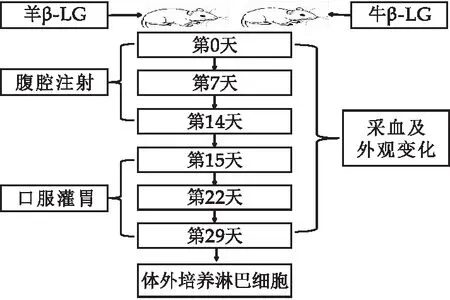
图3 致敏小鼠示意图
1.3.4 小鼠超敏现象外观评分
通过对超敏反应现象的观察,使用改良的报道系统,进行数字量化评分[15]:“1”表示小鼠具有光滑的皮毛,眼睛明亮且具有警觉,没有症状;“2”表示小鼠生理活跃,眼睛明亮,身体略微弯曲偶尔跳跃,在鼻子和头部周围划伤和摩擦;“3”表示小鼠没有警觉或活跃,坐着时驼背,闭着眼睛或眯着眼睛,皮毛微微褶皱;“4”表示小鼠驼背,仍然对环境没什么兴趣,毛皮明显皱起;“5”表示小鼠不反应刺激,皮毛瓶刷外观.
1.3.5 淋巴细胞分离体外培养
收集细胞,在10 ℃和413×g离心10 min并悬浮在1 mL不完全培养基中.将淋巴细胞以1×106个细胞/100 μL的浓度接种于96孔微量培养板中的完全培养基(CM:RPMI-1640,补充有10%胎牛血清(FBS),1 mM非必需氨基酸,1 mM HEPES,1 mM丙酮酸钠,10单位/mL青霉素-链霉素溶液).在37 ℃和5%CO2培养12 h后,用相应抗原以200 μg/mL的浓度刺激细胞.未刺激的细胞用作阴性对照.120 h后,收集细胞,在10 ℃和413×g离心10 min,收集上清液并储存在-80 ℃直至分析.
1.3.6 B淋巴细胞增殖分析
参照于思文等[16]的方法,借助流式细胞仪使用荧光标记快速鉴定分类淋巴细胞,通过使用细胞计数和比色方法测定淋巴细胞指数(PI).在37 ℃和5%CO2温育120 h后,洗涤淋巴细胞并用大鼠抗小鼠CD4抗原和碘化丙啶染色.
根据实验组与对照组结果,利用公式(1)计算细胞增殖抑制率(Cell proliferation inhibition rate,CPIR):
(1)
式(1)中:A1表示对照组吸光值;A0表示空白实验组吸光;A2表示实验组吸光值.
1.3.7 细胞因子谱
使用酶标仪与相应试剂盒配合测定分析抗原刺激后小鼠淋巴细胞分泌到培养基中的IL-2、IL-4、IL-6、IL-12等的水平[17],设置空白孔、待测样品孔(牛乳β-Lg致敏组、羊乳β-Lg致敏组)各组,每组四孔.加样:先加40 μL样品稀释液,再加待测样品10 μL待测样品,空白组加入等体积PBS;加酶:每孔加入酶标试剂100 Ml,空白孔除外;温育:封板膜封住37 ℃温育60 min;洗涤:揭掉封板膜弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去重复5次,拍干;显色:每孔加入50 μL显色剂A后,再加入50 μL显色剂B,轻轻震荡混匀,37 ℃避光显色15 min;终止:每孔加入终止液50 μL,终止反应;测定:以空白孔调零,450 nm波长依序测量各孔OD值.重复三次实验取平均值及分析误差[18].
2 结果与讨论
2.1 羊乳β-Lg两种不同分离方法比较
2.1.1 化学沉淀法分离羊乳β-Lg的影响
羊乳清蛋白中的β-Lg含量高达50%,在NaCl溶液中的溶解度较大,因此选取盐沉淀法进行分离,用柠檬酸溶液调节乳清pH分别至3.1~3.9,加入NaCl进行盐析后离心分离β-Lg.
如图4 所示,1为羊乳清;2~5分别为NaCl浓度7%、8%、9%、10%,样液分别在pH 3.1、3.3、3.5、3.7、3.9时,乳清蛋白中残留的酪蛋白大量去除.由图4(d)、(e)可看出,pH 3.7、3.9条件下,随NaCl浓度的提高,杂蛋白去除率不高,各泳道蛋白质并未发生明显变化,此条件下不能将β-Lg与其他蛋白质分开;由图4(c)可知,当pH达到3.5时,NaCl浓度为9%时,从泳道4可以明显看出少量其他乳清蛋白和酪蛋白;由图4(b)可看出,pH为3.3,NaCl浓度为10%时,从泳道5可知杂蛋白的去除率较高,但从电泳图中可以看出β-Lg并未得到有效分离;当pH为 3.1时,由图4(a)可知,随着NaCl浓度的提高,杂蛋白的去除率明显增加,NaCl浓度达到10%时,能够得到较纯的β-Lg,分离的纯度和得率如图5所示.当pH值为3.1,NaCl浓度为10%时,分离出的β-Lg纯度最高,经Image J灰度值分析,其纯度达到96.70%,得率为87.31%.实验室购买的β-Lg标准品纯度≥95%,故用此方法分离的β-Lg可以进行后续的研究.
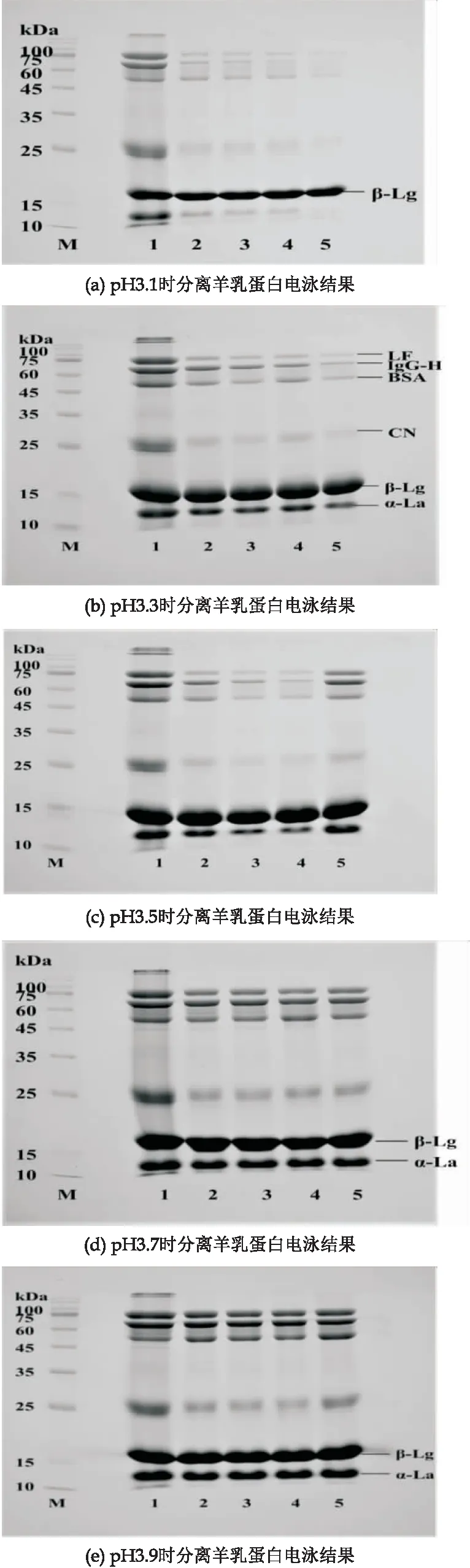
图4 不同pH与NaCl浓度处理后羊乳蛋白电泳结果图
2.1.2 超滤离心法分离羊乳β-Lg的影响
超滤离心管可以用于分子量大小为1 000~3*105的蛋白质,截留分子量广泛,通常包含有3 K、5 K、10 k、30 K、50 K、100 K、300 K、1 000 K、0.2 μL的聚醚砜膜,胶体等大分子有机物,也能分离[19].选择截留分子量为50 kDa的超滤离心管,超滤时间对于分离的结果也有一定影响,将乳清加入超滤管中,分别离心10 min、20 min、30 min,收集透过液进行SDS-PAGE分析[20],结果如图6(b)所示,超滤时间与羊乳β-Lg呈正相关关系,超滤离心10 min时,透过液中含有少量β-Lg,经Image J灰度分析,结果如图6(a)所示,超滤20 min和30 min时,溶液中出现了大量的β-Lg,此时得到的是含有β-Lg的混合物,纯度别为25.29%和26.06%.
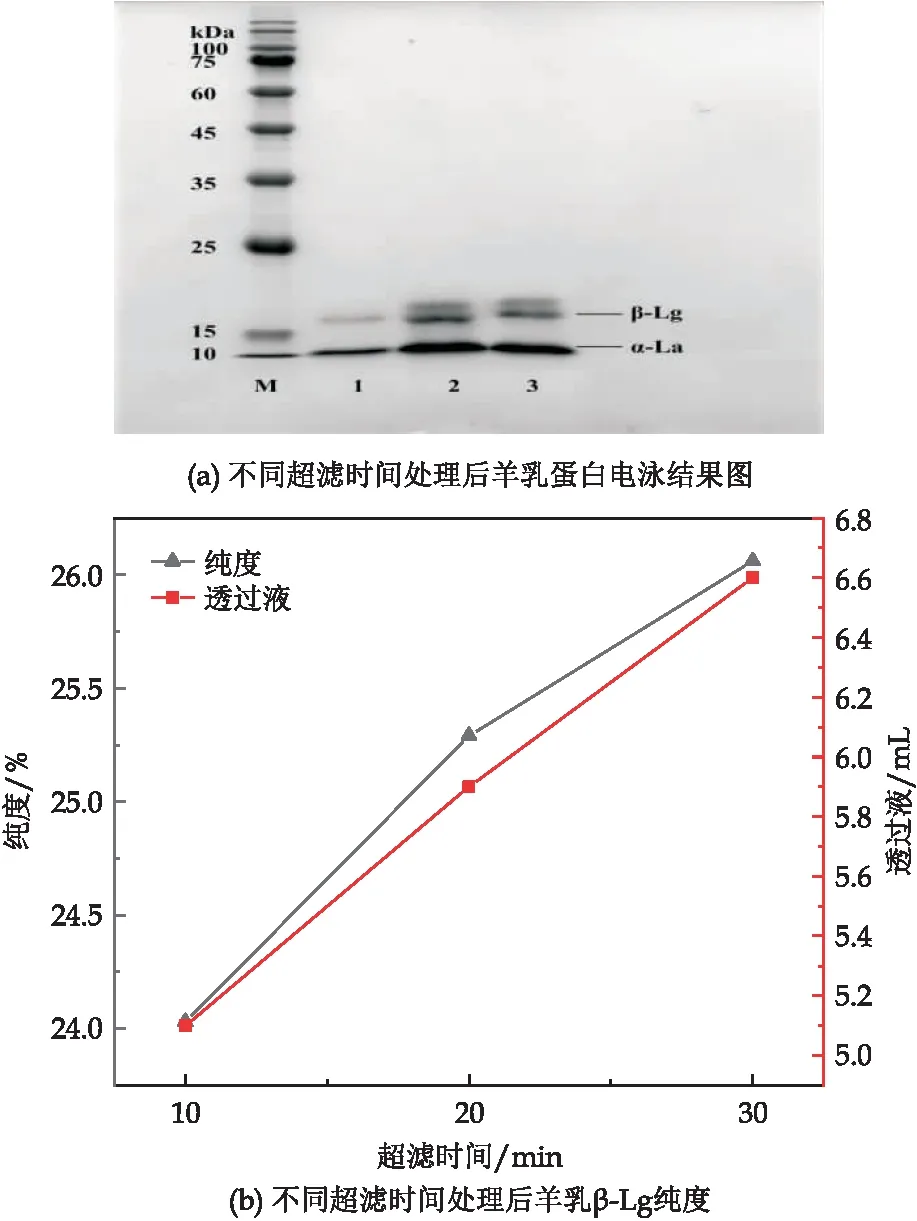
图6 超滤时间对羊乳β-Lg分离影响
2.2 小鼠超敏现象评分表征
牛、羊乳β-Lg口服灌胃和腹腔超敏观察及评分如图7和表1所示,羊乳β-Lg口服灌胃和腹腔超敏评分均在“3~4”之间;牛乳β-Lg口服灌胃和腹腔注射超敏评分均在“4~5”之间;阴性对照组超敏评分均在“1~2”之间.羊乳β-Lg致敏小鼠超敏现象明显低于牛乳β-Lg致敏组,以上表明羊乳β-Lg在两种致敏方式中超敏外观评分低于牛乳β-Lg.
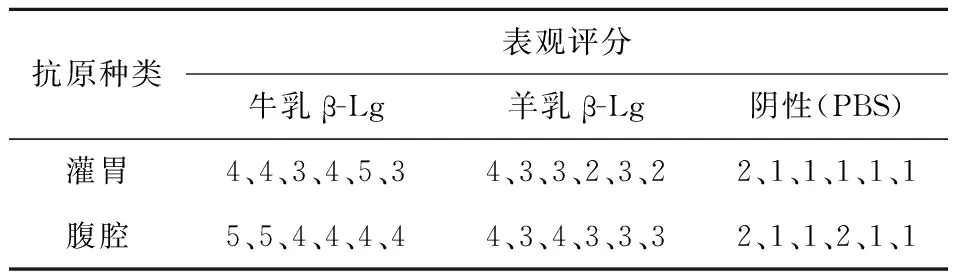
表1 超敏现象外观评分

图7 不同组小鼠超敏现象观察
2.3 淋巴细胞增殖表征
MTT测定法检测小鼠淋巴细胞体外培养液中不同蛋白致敏对淋巴细胞增殖的影响.如图8 所示,羊乳β-Lg致敏组OD均值为0.609,对照组OD均值为0.525;牛乳β-Lg致敏组OD均值为0.579,对照组OD均值为0.443.羊乳β-Lg致敏组抑制率为13.8%;牛乳β-Lg致敏组抑制率23.5%.羊乳β-Lg抑制率明显低于牛乳β-Lg.结果表明了羊乳β-Lg对淋巴细胞的增殖影响比牛乳β-Lg更小.
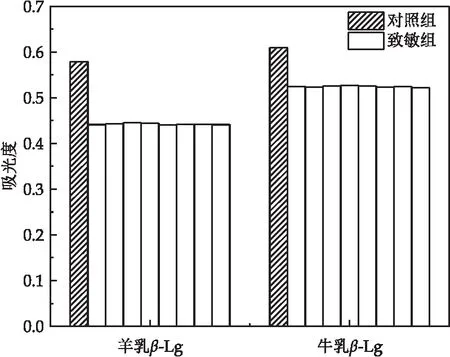
图8 不同致敏组吸光度
2.4 细胞因子水平
白介素细胞因子是免疫过程中具有典型意义的指标,由速发型超敏反应过程中T细胞所分泌,如图9所示,羊乳β-Lg致敏组IL-2、IL-4、IL-6、IL-12水平均低于牛乳β-Lg致敏组,且IL-2 、IL-4的水平显著上升;IL-6、IL-12水平显著上升,但上升幅度较小,且全部细胞因子水平都显著高于只添加PBS的对照组(P<0.05).
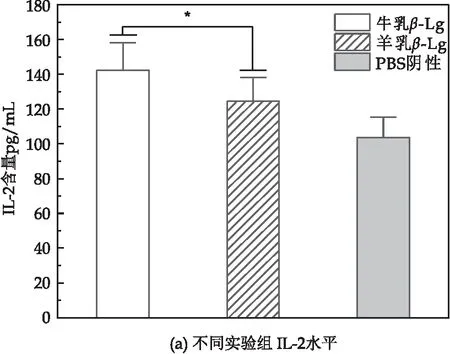
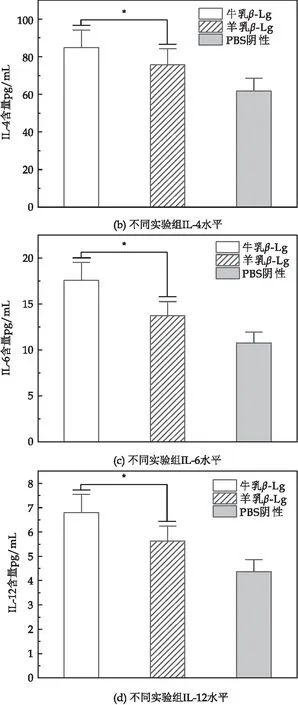
图9 不同致敏组细胞因子水平
结合图10可知,IL-2、IL- 6均具有免疫上调功能,同时IL-2还会促进T细胞生长分泌IL-4,尽管IL-4具有免疫下调功能,但高水平的IL-2会促进较多的IL-4分泌,因此在过敏反应中IL-2 、IL- 4、IL-6水平均呈上升趋势,但细胞中IL-6初始水平较低,故上升幅度较小;IL-12主要作用于T细胞和NK细胞,可刺激活化型T细胞增殖,在过敏反应中参与密切,但其初始水平较低,故在过敏反应中虽呈上升趋势,但波动不明显.由此推测羊乳β-Lg相较于牛乳β-Lg对细胞的损伤程度更小,与MTT法所测结果统一,则羊乳β-Lg的免疫反应性低于牛乳β-Lg.
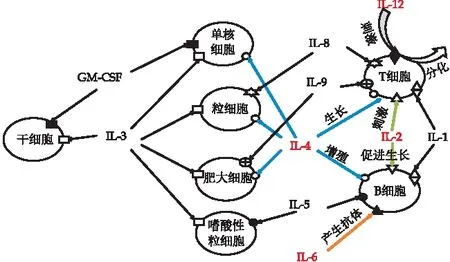
图10 白介素对免疫细胞的调节作用
3 结论
本研究结果表明,羊乳β-Lg灌胃和腹腔注射两种致敏方式下致敏小鼠后的超敏现象外观评分均低于牛乳β-Lg致敏水平,且牛、羊灌胃致敏水平均低于腹腔注射致敏水平,与文献[21]结论中胃液消化后山羊乳β-Lg肽段的减少,可能使致敏性下降的结果吻合,此外,文献[22]结论中牛乳蛋白致敏破坏了大鼠肠道组织的完整性,增加了对过敏原肽段的吸收的结果也佐证牛乳β-Lg灌胃致敏水平高于羊乳β-Lg灌胃致敏水平; MTT测定小鼠淋巴细胞体外培养液发现,羊乳致敏组小鼠淋巴细胞增殖抑制率为13.8%,牛乳致敏组小鼠淋巴细胞增值抑制率23.5%,羊乳β-Lg对淋巴细胞的抑制率明显小于牛乳β-Lg,进一步确定了羊乳β-Lg对淋巴细胞的低致敏性.直接ELISA法测得羊乳β-Lg致敏小鼠淋巴细胞后各细胞因子水平均显著低于牛乳β-Lg致敏水平,其中IL-2、IL-4水平显著上升,IL-6、 IL-12水平虽显著上升,但变化较小.本结果将为羊乳成为牛乳替代低致敏乳源提供一定的支撑依据,同时为羊乳致敏性研究打下基础.
