酶法制备蛹虫草多肽工艺优化及其体外抗氧化活性研究
2023-10-16王小娟杨文娟姚文博陈福欣
龚 频, 岳 山, 王小娟, 杨文娟, 姚文博, 陈福欣
(1.陕西科技大学 食品科学与工程学院, 陕西 西安 710021; 2.西安科技大学 化学与化工学院, 陕西 西安 710054)
0 引言
蛹虫草是一种人工培养的药食同源真菌,早在5世纪便被广泛使用,蛹虫草本身含有丰富的营养成分,包括核苷类、多糖类、糖醇、甾醇类以及SOD酶在内的多种有效成分,具有镇静催眠、提高机体免疫力、抗肿瘤、防止衰老、保护心肺组织等多种药理作用[1],还有研究表明蛹虫草活性功能物质在调节机体的各项生理机能和强身健体等方面都有着显著的功效[1,2].有充分的研究表明蛹虫草与冬虫夏草具有相似的功能和药效[1-3].蛹虫草作为一味使用历史悠久的传统中药之一,在药学研究中具有很大的药用价值,现代科学对其研究越来越多,涉及到蛹虫草中的虫草多糖、虫草素、腺苷类等有效成分[3,4],但对蛹虫草蛋白的研究较少.对人工栽培的蛹虫草的成分进行分析,表明人工培养的蛹虫草中蛋白质含量在30%左右,脂肪含量在8%,是一种高蛋白低脂肪的滋补佳品,一种优秀的蛋白补充剂,具有良好的开发前景[5-7].
碱提酸沉法是最常用的提取蛋白质的方法,利用的原理是植物蛋白易溶于碱性环境,在酸性等电点条件下析出.碱提酸沉法的优点是蛋白质的提取率和纯度都较高,易操作,成本低;缺点是过高浓度的碱液会使部分提取出的蛋白质产生不可逆的变性,使得营养价值的降低.但通过酶解生成生物活性肽可恢复其营养价值,与蛋白质相比生物活性肽具有更加良好的理化性质、良好的水合性质以及更高的生物利用度[8,9].蛋白质经过酶解成为小分子多肽后,随着蛋白质中氨基和羰基的暴露使得酶解后的多肽电荷分布改变,使得表面亲水基团增多,溶解性增大[10,11].同时人体处于水环境因此蛋白质水解为多肽能显著增加人体对多肽的吸收速度,提高蛋白质的生物利用度,同时多肽相较于蛋白质有更高的活性与多样性,无论在吸收还是生物学功能上都有着显著的优势[12].
本研究以蛹虫草作为原料,采用碱提酸沉法从蛹虫草中提取蛋白质、确定最佳提取条件.通过单因素实验与响应面分析确定蛹虫草蛋白提取的温度、pH 值、料液比等最优工艺指标,并分别针对蛹虫草多肽的体外抗氧化活性进行测定与研究,以期为蛹虫草蛋白的深加工以及生物活性肽的制备提供参考.
1 材料与方法
1.1 实验原料
蛹虫草超微粉,(经过超微粉碎后过300目筛);牛血清蛋白标准品,北京奥博星生物技术有限公司;
实验药品:考马斯亮蓝G250,上海源叶化学试剂有限公司;NaOH、无水乙醇、HCL、甲醛、三氯乙酸、双氧水、铁氰化钾,天津市天力化学试剂有限公司,分析纯.
实验仪器:Varioskan fiash全波长扫描式多功能读数酶标仪,赛默飞世尔科技有限公司;HGZF-101-2型电热恒温鼓风干燥箱,上海跃进医疗器械有限公司;FD-1D-50型真空冷冻干燥机,无锡郎宁仪器制造有限公司;MODEL808型pH计,美国奥丽龙公司;HH-2型电热恒温水浴锅,金坛市江南仪器厂.
1.2 实验方法
1.2.1 蛹虫草蛋白的提取
称取蛹虫草粉末2.00 g放入烧杯中,按照一定料液比加入去离子水,搅拌均匀,使蛹虫草粉末与水充分接触混合.滴加1 mol/L的氢氧化钠溶液,调节pH到最适提取酸碱度.然后放入一定温度的水浴锅中水浴浸提一段时间,抽率取上清液,取用1 mol/L的盐酸调节pH值至等电点,常温静止一段时间,8 000 r/min离心20 min去掉上清液,获得蛋白,用少量去离子水溶解蛋白并转移至平皿中,冷冻干燥得到粗蛋白[13].
1.2.2 等电点测定
蛹虫草蛋白粗提液用0.1 mol/L的盐酸溶液调节其pH,在pH计的帮助下设计从3至5共10个点位分别为3、3.3、3.6、3.8、4.0、4.2、4.4、4.6、4.8、5.在5 000 r/min的转速下离20 min,得粗蛋白质沉淀,冷冻干燥后称重[14].
1.2.3 蛋白质提取工艺优化
(1)单因素实验
取2 g蛹虫草超微粉末于烧杯中,分别以料液比(1∶12、1∶14、1∶16、1∶18和1∶20 g/mL)、体系pH(8、9、10、11、12、13)、提取时间(60、90、120、150、180 min)三个因素进行单因素实验,在研究某一因素时,其他因素固定不变,以蛋白质得率为指标进行单因素实验研究分析.
(2)Box-Behnken 实验
在单因素实验基础上,确定三因素三水平的最佳参数进行响应面分析[14-16].
1.2.4 蛋白质酶的筛选
选取胃蛋白酶(37 ℃ pH 2)、木瓜蛋白酶(52 ℃ pH 6.5)、碱性蛋白酶(50 ℃ pH 8.0)三种酶,分别将其置于最适的酶解条件对提取的蛹虫草粗蛋白进行酶解,通过甲醛滴定法测定酶解液中多肽的相对含量,以此判断每种酶的酶解效果[12,17].
1.2.5 酶解工艺流程
准确称量蛹虫草粗蛋白0.50 g,用蒸馏水调节底物浓度使料液比为1∶100,加入50 mL的蒸馏水.调节溶液酸碱度使得溶液pH值到蛋白酶最适pH,水浴温度调节到各蛋白酶的最适温度,加入等体积的蛋白酶(10% m/M),混合均匀后,酶解12 h,水解完成后沸水浴灭活10 min,即得到蛹虫草蛋白的多肽水溶液[18,19].
1.2.6 抗氧化活性研究
(1)总还原力比较
分别取高、中、低(2 mg/mL、4 mg/mL、6 mg/mL)三种浓度的蛹虫草多肽提取液和蛋白质溶液1 mL于试管中,依次加入2.50 mL pH 7.0的磷酸缓冲液、2.50 mL铁氰化钾溶液和1.50 mL蒸馏水混合均匀,在50 ℃的 条件下反应20 min,冷却后加入2.50 mL的三氯乙酸(蛋白质溶液中加入2.50 mL蒸馏水),3 000 r/min条件下离心10 min,取上清液2.50 mL,再加入2.50 ml蒸馏水和0.50 mL三氯化铁溶液,混合均匀后放置10 min.在波长为700 nm处测量其吸光值[20,21].
(2) DPPH自由基清除力的比较
分别取高、中、低(6 mg/mL、4 mg/mL、2 mg/mL)三种浓度梯度的蛹虫草多肽提取液和蛋白质溶液1 mL于试管中,添加1.50 mL的DPPH乙醇溶液.充分混匀后在室温下反应30 min.在527 nm处测量紫外吸收值,进行比较[22].DPPH自由基的清除率为:
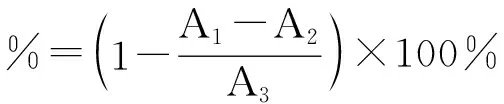
(1)
式(1)中:A1:DPPH溶液+待测液的吸光度;A2:95%的乙醇+待测液的吸光度;A3:DPPH溶液+蒸馏水的吸光度.
(3)羟自由基清除率
分别取高、中、低(6 mg/mL、4 mg/mL、2 mg/mL)三种浓度的蛹虫草多肽提取液和蛋白质溶液1 mL于试管中,分别加入2 mL FeSO4溶液和2 mL的水杨酸-乙醇溶液,加入1 mL的H2O2启动反应,让其置于37 ℃的水浴中反应30 min,待其冷却于510 nm处测其吸光值[23,24].羟自由基清除率为:
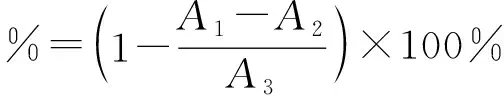
(2)
式(2)中:A1:H2O2+待测样品的吸光度;A2:H2O+待测样品的吸光度;A3:H2O2+蒸馏水的吸光度.
1.3 分析方法
1.3.1 蛋白质检测
Bradford检测法
将提取液稀释一定的倍数,取稀释液1 mL,加入5 mL考马斯亮蓝G-250溶液溶液,充分混匀后常温下反应10 min后,在波长为595 nm处测得其光吸收,计算蛋白质浓度.
1.3.2 甲醛滴定法
取2.50 mL的中性水解液,加入2.50 mL 10%的三氯乙酸,静置10 min,在4 000 r/min的条件下离心15 min,取上清液5 mL,加入5滴30%的双氧水,加入0.20 mol/L的氢氧化钠溶液调节至pH 7,再用于0.02 mol/L氢氧化钠滴定pH 8.1,加入10 mL的三氯甲醛溶液,静置10 min,测量溶液pH,再用0.02 mol/L的氢氧化钠缓慢地均匀滴定至溶液pH浓度等于8.1,并详细记录消耗的各种氢氧化钠及其溶液的用量[18].

(3)
式(3)中:V:为待测液消耗标准NaOH的体积;C:标准NaOH的摩尔浓度.
所有数据均为3次重复试验平均值±标准差,使SPSS19.0 软件进行统计学分析,GraphPad 8.0.2进行绘图,使用 Design-Expert8.0.6 进行响应面设计.
2 结果与讨论
2.1 单因素实验结果与分析
2.1.1 蛋白质等电点的测定
蛋白质是带有正负电荷的两性电解质,蛋白质处于等电点时,其净电荷为零,由于相邻蛋白质分子之间没有静电斥力而趋于聚集沉淀.因此在其他条件相同时,它的溶解度达到最低点.由图1可知,当pH为4.4时,粗蛋白质量为201.10±2 mg,达到最大值,蛋白提取液中沉降下来的粗蛋白质量最高,粗蛋白质得率达到最大值,由此可推断出蛹虫草蛋白质的等电点在4.4.

图1 蛹虫草蛋白质沉淀点测定
2.1.2 料液比对蛋白质提取的影响
由图2可知,随料液比的增大,蛹虫草蛋白质的得率也增加,当料液比为1∶18时,蛋白质的提取率达到最大值9.17%.这是因为当料液比增大时,蛹虫草粉末与溶液接触面积增大,加速了蛋白质溶出,当溶液体积达到一定量时,可溶性杂志增多,降低蛋白质对溶剂的亲和力,降低了提取率.因此,确定最适的料液比为1∶18.
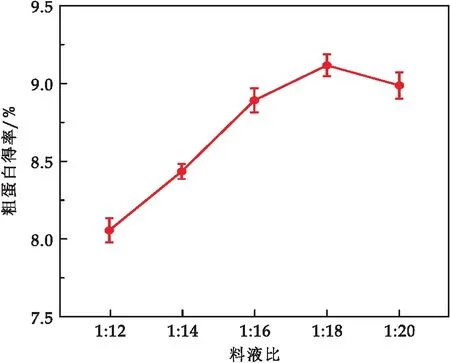
图2 料液比对蛹虫草蛋白提取得率的影响
2.1.3 pH对蛋白质提取率的影响
由图3可知,随着体系pH的提高,蛹虫草蛋白的得率逐渐变大,当pH为12时蛹虫草蛋白的得率达到最大值10.01%±0.2%.这是因为蛹虫草蛋白的溶解性,随着溶液体系pH的增加而增大,当体系pH达到12时,蛋白质得率基本稳定.因此,蛹虫草蛋白提取的最适为pH 12.
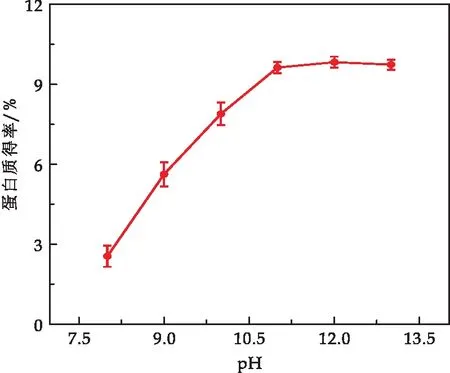
图3 pH对蛹虫草蛋白得率的影响
2.1.4 提取时间对蛋白质得率的影响
由图4可知,蛹虫草粗蛋白得率,随着提取时间增加而增大,150 min时达到最大值.是因为在提取的初期由于提取时间较短,蛹虫草粉末未充分与溶液接触,蛋白质没有完全析出.随着提取时间的增加蛋白提取率逐渐趋于平稳.
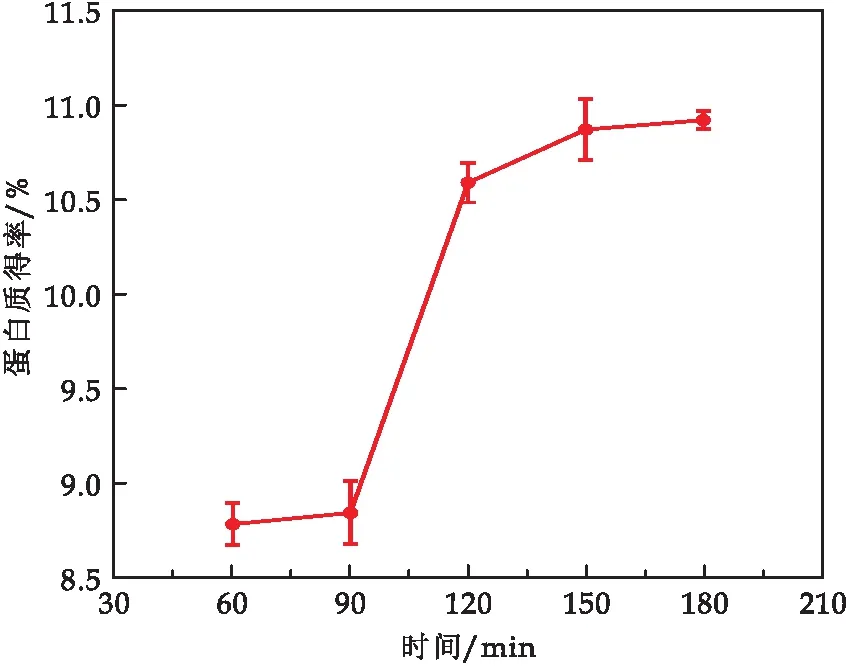
图4 提取时间对蛹虫草蛋白得率的影响
2.2 响应面分析法优化提取工艺
基于单因素实验结果拟确定的最佳条件,选取浸提时间、pH、和料液比三个条件进行Box-Behnken 实验,三个因素分别以A、B、C代替,每个变量的低、中、高,试验水平编码分别为-1、0、1,如表1所示.
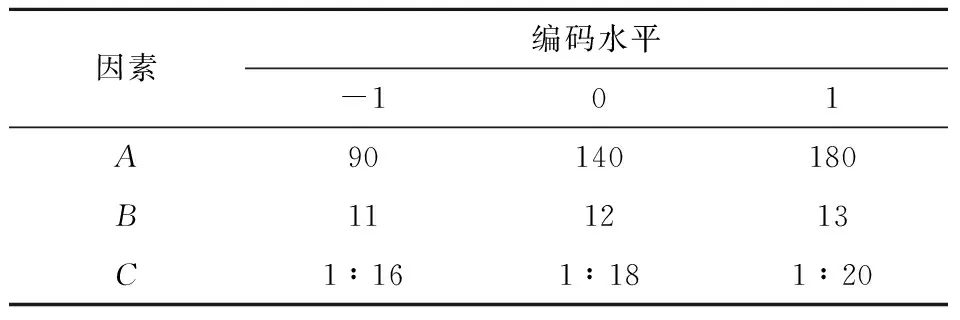
表1 试验因素水平及编码
根据Box-Behnken实验设计原理进行响应面试验,试验设计方案与结果如表2所示.

表2 Box-Behnken 试验设计方案与结果
对表2中的数据分析得到蛋白提取液中蛋白质浓度试验数据进行多元回归拟合,获得提取液中蛋白质浓度对编码自变量的二次元多项回归模型如式(4)所示:
Y=5.32+0.23A+0.11B+0.2C-0.053AB+
0.3AC-0.16BC-0.85A2-0.83B2-0.26C2
(4)
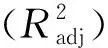
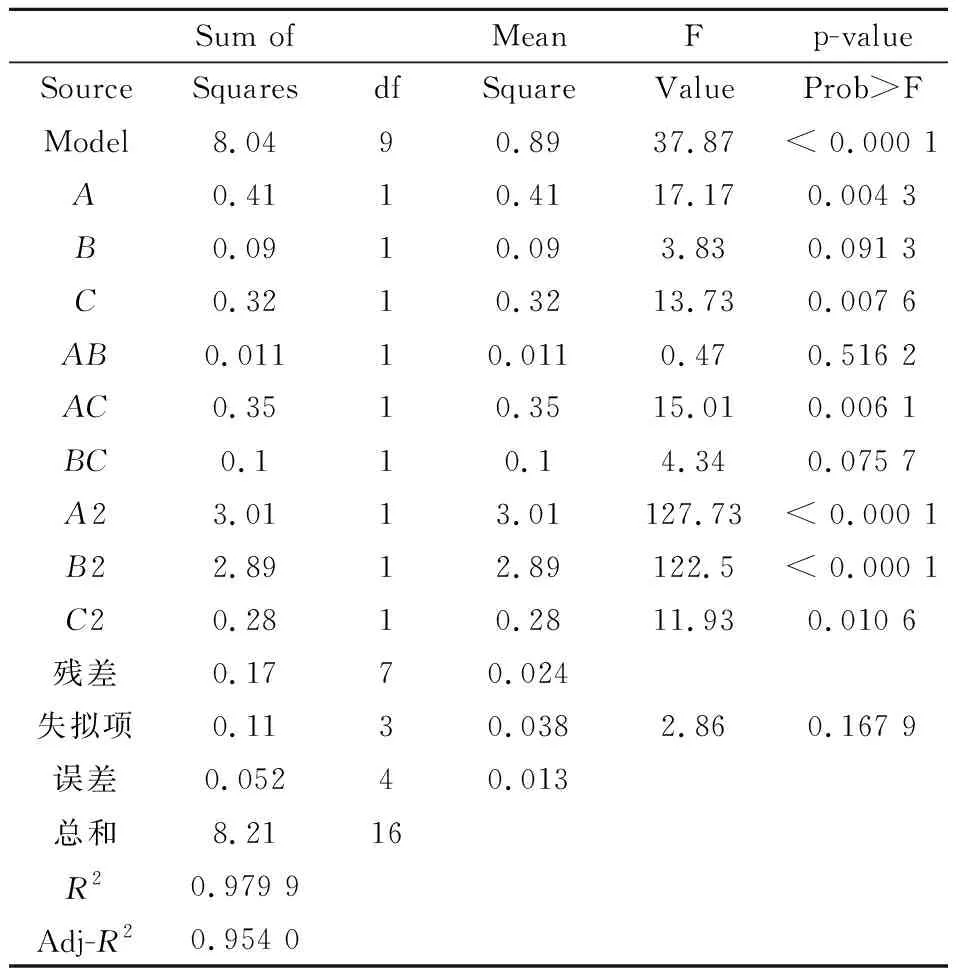
表3 蛋白质浓度回归方程显著性检验
等高线图和曲面图能够直观地反映出不同因素之间的交互作用及其对响应值的影响.由图5可知,提取时间(A)与料液比(C)之间的交互作用对蛋白质提取率影响最大,其次是提取时间(A)与pH(B)的交互作用,而pH(B)与料液比(C)的交互作用最小.

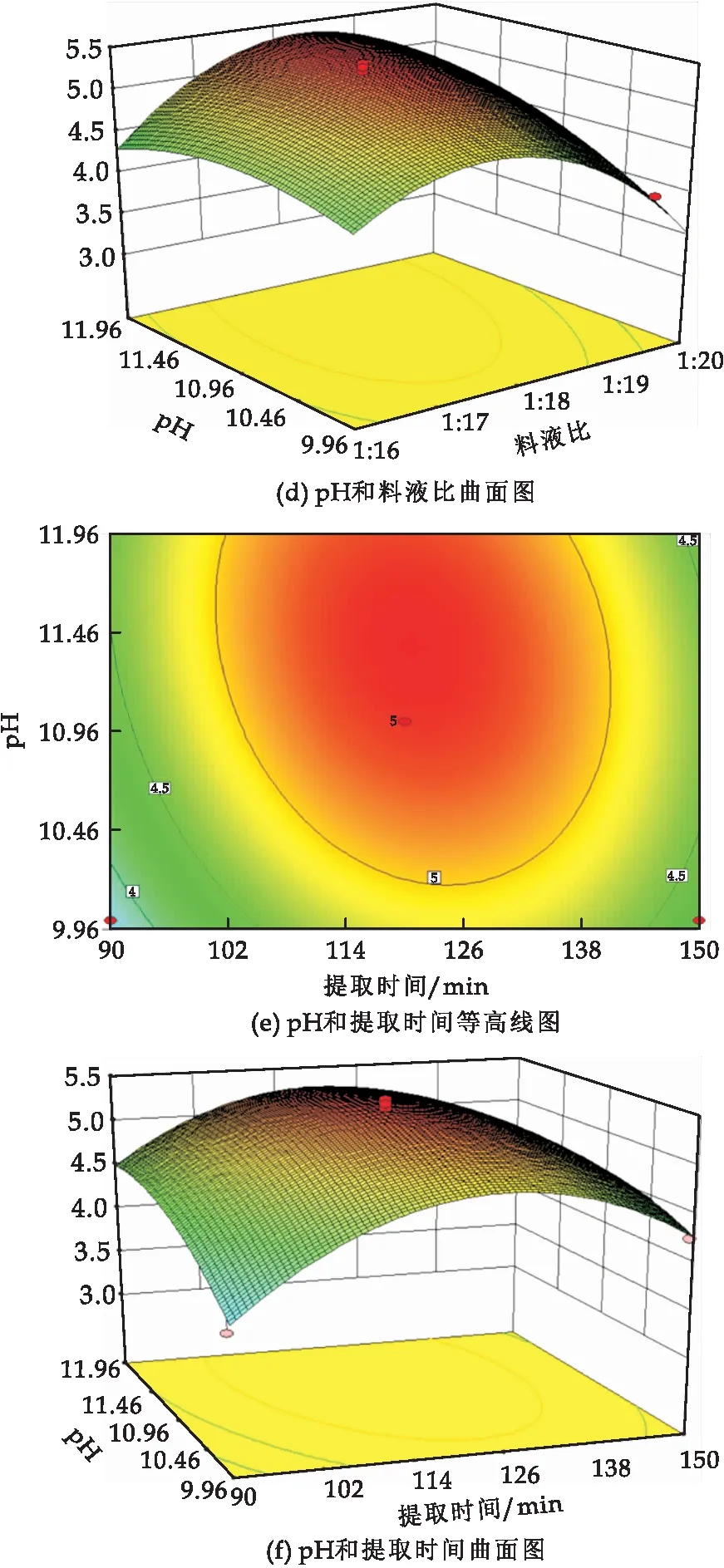
图5 因素交互作用等高线图和曲面图
2.3 酶解实验
分别使胃蛋白酶、木瓜蛋白酶、碱性蛋白酶处于最适的酶解条件下酶解蛹虫草蛋白.通过滴定液的消耗量判断-NH2与甲醛结合释放的H+的量,判断对蛹虫草蛋白水解效果最好的酶,三种蛋白酶消耗的滴定液的量如表4所示.由表可以看出,当三种蛋白酶均处于自身最适酶解条件时,碱性蛋白酶水解得到的蛹虫草多肽溶液中-NH2与甲醛结合后释放的H+的量最多,说明碱性蛋白酶对蛹虫草蛋白水解效果相较于胃蛋白酶和木瓜蛋白酶效果更好,胃蛋白酶和木瓜蛋白酶水解能力相当.因此选用碱性蛋白酶作为水解蛹虫草蛋白的主要水解酶.

表4 甲醛滴定法测水解液中氨基氮含量
2.4 体外抗氧化实验
2.4.1 总还原力变化
由图6可知,酶解法制备的蛹虫草多肽高、中、低浓度均具有一定的还原力,且还原力普遍高于同等浓度下的蛹虫草粗蛋白.蛹虫草多肽的还原力随着浓度的升高而上升,具有明显的浓度依附性.蛹虫草粗蛋白的总还原性随浓度变化不明显.
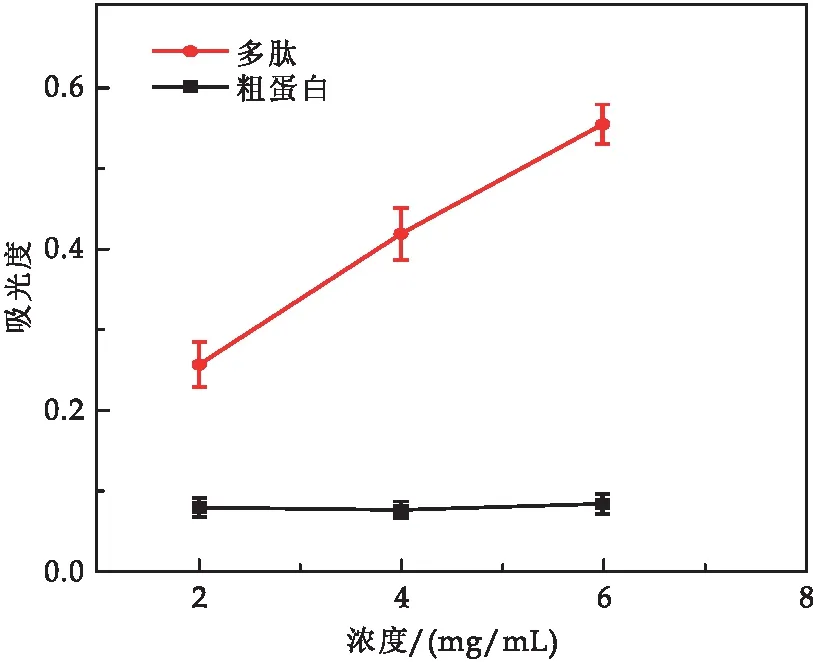
图6 蛹虫草蛋白与蛹虫草多肽还原力比较
2.4.2 DPPH清除率比较
由图7 可知,蛹虫草蛋白与其酶解多肽相比较,同等浓度下蛹虫草多肽的DPPH清除率远远大于蛹虫草蛋白质,是蛹虫草蛋白的3~4倍.蛹虫草多肽的DPPH自由基清除率随着浓度的增加而不断增加.
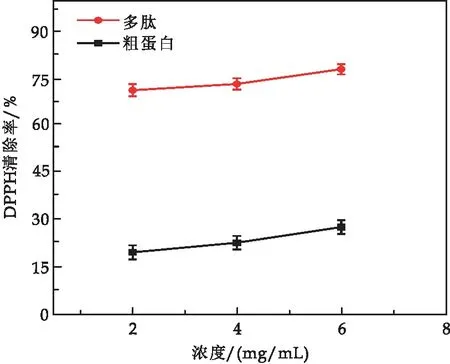
图7 蛹虫草蛋白与蛹虫草多肽DPPH清除率比较
2.4.3 羟自由基清除率
由图8可知,酶解法制备的蛹虫草多肽高、中、低浓度对羟自由基都有明显的清除作用,且对-OH的清除率普遍高于同等浓度下的蛹虫草粗蛋白.蛹虫草-OH清除率随着浓度的升高而上升,具有明显的浓度依附性.
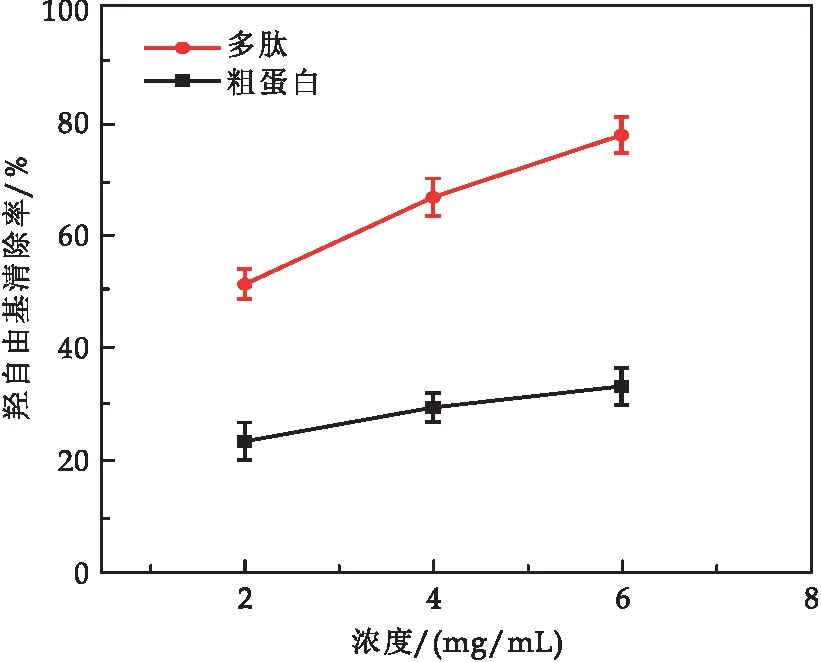
图8 蛹虫草蛋白与多肽羟自由基清除率比较
3 结论
研究结果表明,通过单因素实验与响应面分析得到,碱提酸沉法提取蛹虫草蛋白的最佳工艺为,提取时间144 min,最适酸碱度为pH 12.01,最适料液比为1∶19.通过单一酶水解法制备蛹虫草多肽,使三种酶都处于其最适条件下进行反应,通过甲醛滴定法证明碱性蛋白酶为最适的蛹虫草水解酶.通过体外抗氧化活性的测定,比较蛹虫草蛋白及其酶解产物的活性变化,证明蛹虫草蛋白酶解产物具备更好的体外抗氧化活性,为蛹虫草蛋白的深加工以及生物活性肽的制备提供参考.
