GapN诱导型表达小白链霉菌的构建及其对ε-聚赖氨酸生产的影响
2023-09-27毛佳琪代文娟秦加阳
毛佳琪 张 敏 代文娟 秦加阳
滨州医学院药学院 山东 烟台 264003
ε-聚赖氨酸(ε-polylysine,ε-PL)是25~35个L-赖氨酸的同型单体聚合物,具有热稳定好、水溶性高和pH耐受范围广等优良特性,对革兰氏阳性菌、革兰氏阴性菌、绝大多数真菌和一些病毒等都有良好的抑菌活性,是我国批准使用的四种天然防腐剂之一(GB 2760-2014)[1-2]。近年来,ε-PL在医药、化工、电子材料、生物工程等领域也展现出广阔的应用前景[3-4]。ε-PL的工业生产方法主要为微生物发酵法,生产菌株为小白链霉菌(Streptomycesalbulus)突变株,通常以葡萄糖和甘油为底物,目前存在产量不高、生产速度慢和转化率低等问题,造成ε-PL生产成本较高,严重限制了其在食品和医药等领域的应用[3]。
基因工程是提高菌株生产能力的重要方法。目前,小白链霉菌中ε-PL的合成途径研究较为清楚,其合成前体是L-赖氨酸,L-赖氨酸在ε-PL合成酶(polylysine synthetase,Pls)的作用下聚合生成ε-PL[5]。本课题组在研究前期利用基因工程方法在小白链霉菌中实现了Pls的过量表达,一定程度上提高了ε-PL的产量和生产速度[6]。在此基础上,提高前体L-赖氨酸的供给是下一步基因工程改造的重要方向。烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)是L-赖氨酸合成途径中重要的辅酶,通常合成1分子L-赖氨酸需要多达4分子NADPH[7]。因此,解决NADPH供给问题可能是提高胞内L-赖氨酸浓度的有效方法。
本研究化学合成了来自变异链球菌的一种特殊的依赖于NADP的三磷酸甘油醛脱氢酶(NADP-dependent glyceraldehyde 3-phosphate dehydrogenase,GapN),构建了GapN诱导型表达的小白链霉菌基因工程菌,通过添加不同浓度的纤维二糖调控GapN的表达水平,提高胞内NADPH浓度,研究其对ε-PL产量的影响。
1 材料与方法
1.1 菌株、质粒和引物 本研究所用菌株、质粒和引物见表1。
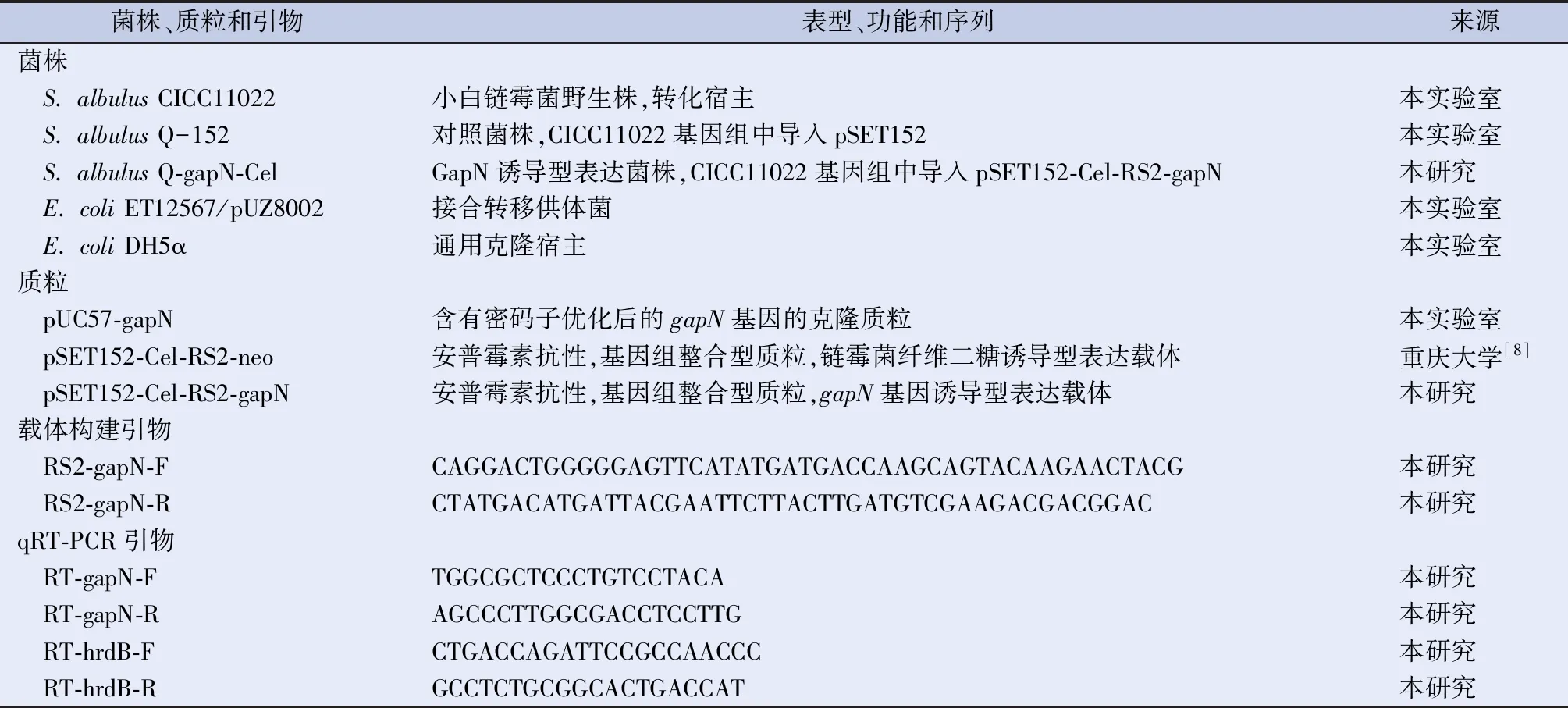
表1 本研究用到的菌株、质粒和引物
1.2 培养基 LB培养基成分为胰蛋白胨10 g/L,酵母粉5 g/L,氯化钠10 g/L。MS固体培养基成分为甘露醇20 g/L,黄豆粉20 g/L,琼脂粉20 g/L。种子培养基成分为甘露醇50 g/L,(NH4)2SO410 g/L,酵母粉5 g/L,MgSO4·7H2O 0.5 g/L,K2HPO40.8 g/L,K2HPO41.36 g/L,FeSO4·7H2O 0.03 g/L,ZnSO4·7H2O 0.04 g/L,pH 6.8。发酵培养基成分为种子培养基添加柠檬酸钠5 g/L,纤维二糖0、0.007 5、0.03或0.6 mM。2×YT培养基成分为胰蛋白胨16 g/L,酵母粉10 g/L和氯化钠5 g/L。抗性菌株培养和筛选时添加抗生素的浓度分别为安普霉素80 μg/mL、卡那霉素50 μg/mL、氯霉素50 μg/mL、萘啶酮酸25 μg/mL。
1.3 GapN诱导型表达菌株的构建 以含有密码子优化的gapN基因的质粒pUC57-gapN为模板,使用引物RS2-gapN-F和RS2-gapN-R(表1)扩增得到gapN基因片段。PCR反应条件为:95℃ 15 s,55℃ 15 s,72℃ 1 min,30个循环。将gapN基因片段与NdeI和EcoR I双酶切的pSET152-Cel-RS2-neo质粒做无缝克隆后转化到大肠杆菌DH5α感受态细胞,筛选正确连接的转化子并测序验证,得到重组表达质粒pSET152-Cel-RS2-gapN(图1)。将构建好的质粒利用接合转移转入S.albulusCICC11022[6],置30℃培养约5~7 d后可看到抗性接合孢子,培养该孢子得到基因工程菌株S.albulusQ-gapN-Cel。
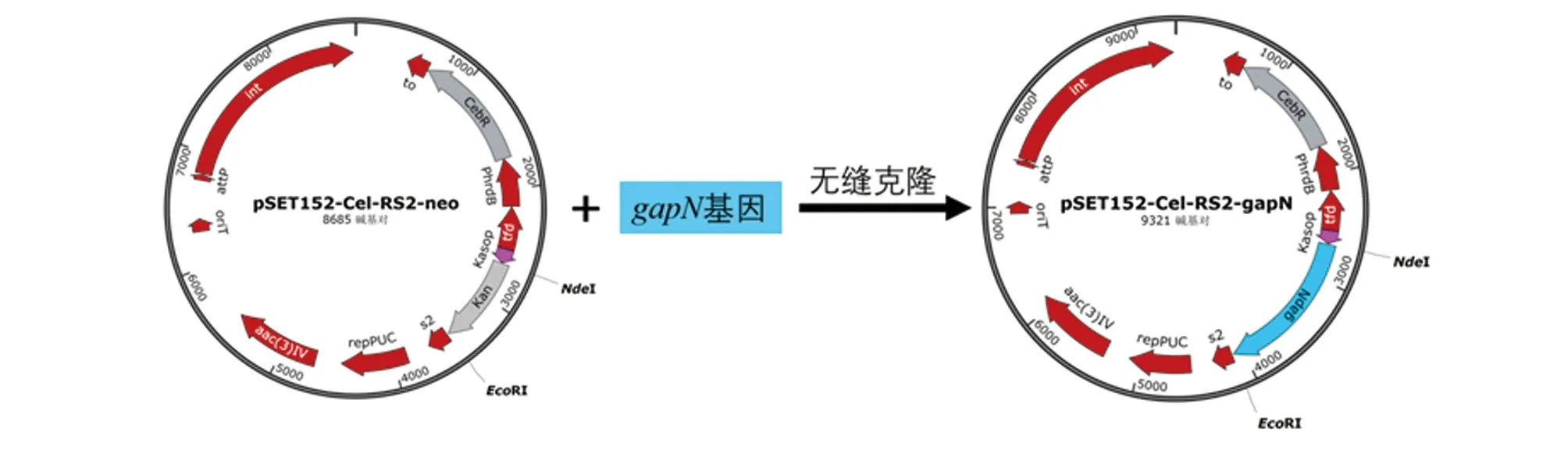
图1 pSET152-Cel-RS2-gapN质粒构建过程
1.4 菌株培养和发酵比较 将S.albulusQ-gapN-Cel和对照菌株S.albulusQ-152分别在MS固体培养基上培养5~7 d,收集孢子接种于50 mL 种子培养基中,在30℃和220 rpm下培养48 h得到种子培养液;然后按10%的接种比例将种子培养液接种于50 mL含有不同浓度纤维二糖的发酵培养基中,在30℃和220 rpm下培养96 h,收集菌体检测gapN基因表达水平和胞内NADPH浓度,并测定菌体生长和ε-PL产量。
1.5gapN基因表达水平检测 采用实时荧光定量PCR(qRT-PCR)方法研究不同纤维二糖添加量对gapN基因表达水平的影响[6]。收集菌体,使用RNAiso Plus(宝生物)提取总RNA;使用EasyScript®One-Step gDNA Removal and cDNA Synthesis SuperMix(全式金)获得cDNA;qRT-PCR反应使用Hieff UNICON®Universal Blue qPCR SYBR Master Mix(翌圣)在LightCycler 96仪器(罗氏)上进行。选择RNA聚合酶sigma因子(hrdB)作为内参基因。gapN和hrdB基因qRT-PCR的引物对分别为RT-gapN-F/RT-gapN-R和RT-hrdB-F/RT-hrdB-R(表1),反应条件为95℃ 10 s,60℃ 30 s,40个循环。相对基因表达数据采用2-ΔΔCt方法进行分析,所有的qRT-PCR检测均采用3个生物学重复和3个技术重复进行。
1.6 检测和分析方法 使用WST-8 NADP+/NADPH检测试剂盒(碧云天)测定胞内NADPH浓度,使用增强型BCA蛋白检测试剂盒(碧云天)测定细胞的蛋白浓度,计算每微克蛋白质的NADPH含量。通过在分光光度计中检测样品在600 nm的光密度来测定菌体生长情况。采用甲基橙比色法检测发酵液中ε-PL的产量[5]。采用SnapGene 5(GSL Biotech, www.snapgene.com)进行引物设计、DNA序列分析和质粒图绘制等工作。采用GraphPad Prism 8绘制发酵柱状图并进行统计学分析。
2 结果
2.1 GapN诱导型表达小白链霉菌基因工程菌株的构建 PCR扩增得到的gapN基因大小约为1.5 kb,利用NdeI/EcoR I双酶切pSET152-Cel-RS2-neo后纯化得到的载体框架约为8 kb(图2A),均符合预期。无缝克隆后大肠杆菌转化子的筛选结果如图2B所示,所挑选的3个转化子均扩增出了目标条带。提取3个转化子质粒后利用NdeI/EcoR I双酶切验证,均出现了约8 kb的质粒条带和1.5 kb的gapN基因。将所得1号质粒送上海生工进行测序验证,结果与目标序列100%一致。这表明:成功构建了重组表达质粒pSET152-Cel-RS2-gapN。接下来,将该质粒成功转入E.coliET12567/pUZ8002,又利用接合转移转入S.albulusCICC11022,所得菌株命名为S.albulusQ-gapN-Cel,即为GapN诱导型表达小白链霉菌基因工程菌,用于后续实验。

A.gapN基因和载体框架的制备。泳道1为gapN基因PCR扩增产物纯化结果;泳道2为Nde I/EcoR I双酶切pSET152-Cel-RS2-neo后纯化得到的载体框架。B.PCR和双酶切方法筛选正确的转化子。泳道1~3为挑选的三个转化子的PCR结果;泳道4为PCR筛选的阳性对照;泳道5为PCR筛选的阴性对照;泳道6~8为挑选的三个转化子的双酶切结果;泳道9为gapN基因双酶切结果;泳道10为pSET152-Cel-RS2-neo质粒双酶切结果。
2.2 纤维二糖添加量对gapN基因表达和NADPH浓度的影响 将GapN诱导型表达菌株Q-gapN-Cel在不添加纤维二糖时gapN基因的表达量定义为1,添加0.007 5、0.03和0.6 mM纤维二糖时gapN基因的表达量分别为1.35、1.85和2.62(图3A)。这表明,该菌株中gapN基因的表达水平与纤维二糖的添加量呈正相关。胞内NADPH浓度检测结果显示:GapN诱导型表达菌株Q-gapN-Cel在添加不同浓度纤维二糖情况下胞内NADPH浓度显著高于对照菌株Q-152;添加0.03 mM纤维二糖时胞内NADPH浓度最高,纤维二糖浓度增加到0.6 mM时胞内NADPH浓度开始下降,但仍高于对照菌株;不添加纤维二糖时Q-gapN-Cel胞内NADPH浓度也高于对照菌株,这表明,该诱导表达系统存在泄漏表达(图3B)。
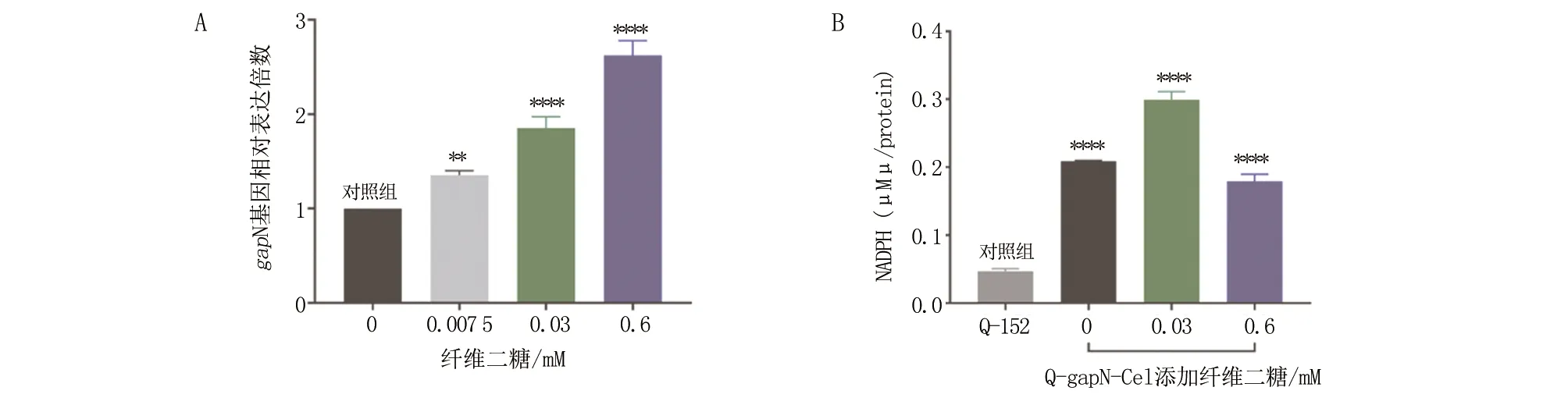
**P<0.01,****P<0.0001。
2.3gapN基因表达水平对菌体生长和ε-PL产量的影响 如图4所示,GapN诱导型表达菌株S.albulusQ-gapN-Cel在添加0、0.007 5、0.03和0.6 mM纤维二糖时的OD值分别为14.62、14.73、15.22和13.98,均显著低于对照菌株S.albulusQ-152的OD值17.95。虽然菌体生长能力不如对照菌株,GapN诱导型表达菌株S.albulusQ-gapN-Cel在添加0、0.007 5和0.03 mM纤维二糖时ε-PL的产量分别为0.54、0.88和0.96 g/L,分别比对照菌株Q-152的产量0.38 g/L高42.1%、131.6%和152.6%,但是当纤维二糖的添加量为0.6 mM时,菌株Q-gapN-Cel的ε-PL产量仅为0.14 g/L,比对照菌株低63.2%。这表明:GapN表达水平对小白链霉菌生产ε-PL有显著影响,通过控制GapN的表达水平能够有效提高小白链霉菌发酵生产ε-PL的能力。

*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
3 讨论
辅酶参与许多胞内反应,并对氧化还原平衡和细胞代谢产生重要影响[9]。辅酶工程是微生物代谢工程的一个有效途径,通常利用基因工程方法改变胞内辅酶供应或者修改酶的辅酶偏好性,实现目标产物的高效生产[10]。在L-赖氨酸的生物合成途径中,NADPH是一种重要的辅酶,通过提高胞内NADPH供给或降低NADPH需求均能提高谷氨酸棒杆菌合成L-赖氨酸的能力[7,11-12]。L-赖氨酸是ε-PL生物合成的前体,在小白链霉菌提高NADPH的供给能否提高ε-PL的产量有待研究。
3-磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GapA)是糖酵解途径的关键酶之一,它催化三磷酸甘油醛到1,3-二磷酸甘油酸的反应,同时将NAD还原为NADH。然而,在自然界一些物种如变异链球菌中存在一种特殊的依赖于NADP的三磷酸甘油醛脱氢酶GapN,其催化三磷酸甘油醛不可逆氧化为三磷酸甘油酸,并将NADP还原为NADPH[12]。本研究构建了异源GapN诱导型表达的小白链霉菌基因工程菌株。本研究发现,GapN表达能够显著提高胞内NADPH浓度,随着GapN表达水平的提高,ε-PL的产量先增加后降低。其可能的机制为,GapN能够与胞内原有的GapA竞争底物3-磷酸甘油醛,从而提高胞内NADPH的含量,同时会造成胞内NADH含量的降低(图5)。虽然NADPH含量的提高可能有利于L-赖氨酸的合成,但NADH可以经过呼吸链产生ATP,NADH含量的降低可能影响ATP的再生,由于L-赖氨酸聚合为ε-PL需要较多ATP[3],因此,胞内NADPH的浓度不宜过高,只有适当提高胞内NADPH浓度,同时不影响ε-PL聚合对ATP的需求时才能提高ε-PL的产量。
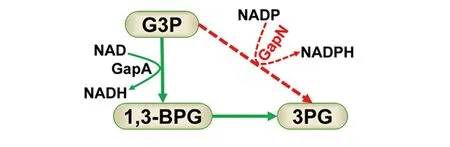
G3P,3-磷酸甘油醛;1,3-PG,1,3-二磷酸甘油酸;3PG,3-磷酸甘油酸;红色虚线,本研究引入的代谢途径;绿色实线,小白链霉菌原有代谢途径
综上所述,GapN表达水平对小白链霉菌生产ε-PL有显著影响,通过控制GapN的表达水平能够有效提高小白链霉菌发酵生产ε-PL的能力。本研究为利用基因工程方法提高ε-PL的产量提供了新的靶点。
