帕博利珠单抗在微卫星高度不稳定/错配修复缺陷的非结肠癌患者中的疗效:KEYNOTE-158 Ⅱ期研究的结果
2023-09-21胡华斌翻译邓艳红审校
胡华斌 翻译 邓艳红② 审校
错配修复缺陷(mismatch repair deficiency,dMMR)肿瘤占所有确诊肿瘤的2%~ 4%。dMMR 肿瘤可见于患有如Lynch 综合征之类遗传性癌症易感综合征的个体中,但更常见于散发病例,且在不同癌症类型中的发生率存在差异:子宫内膜癌中17%~ 33%,胃癌中9%~ 22%,结直肠癌(colorectal cancer,CRC)中6%~ 13%,在其他类型癌症(如膀胱癌、前列腺癌、乳腺癌、肾细胞癌、胰腺癌、小细胞肺癌、甲状腺癌和肉瘤)中发生率较低。dMMR 肿瘤具有独特的遗传特征,突变发生率比错配修复功能完整(proficient mismatch repair,pMMR)的肿瘤高10~ 100 倍[1]。这些肿瘤中被称为微卫星的重复DNA 序列特别容易发生突变,导致微卫星高度不稳定(high-level microsatellite instability,MSI-H)。dMMR 肿瘤细胞可在其膜上表达程序性死亡配体1(programmed death-ligand 1,PD-L1)。此外,这些肿瘤在显微镜下可见大量淋巴细胞浸润,并且这些免疫细胞通常表现为检查点蛋白上调,包括程序性死亡受体1(programmed death-1,PD-1)、细胞毒性T 淋巴细胞相关蛋白-4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)和淋巴细胞活化基因-3(lymphocyte-activation gene-3,LAG-3)。肿瘤基因分型决定其免疫表型,使得这些肿瘤在接受免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)治疗时更易产生有效的应答。
一项初步研究在41 例MSI-H/dMMR 肿瘤(包括CRC 和非CRC)和微卫星稳定型CRC 患者中评估了帕博利珠单抗(每2 周10 mg/kg)的疗效。MSIH/dMMR CRC 和非CRC 的客观缓解率(objective response rates,ORRs)分别为40%(4/10)和71%(5/7),而微卫星稳定型CRC 的ORR 为0(0/18)。这些数据支持MSI-H/dMMR 肿瘤对PD-1 抑制剂帕博利珠单抗有反应的假设,随后对来自五项临床研究的MSIH/dMMR 肿瘤患者进行了联合分析。帕博利珠单抗于2017 年5 月获得美国食品药品监督管理局(FDA)的加速批准,用于治疗在既往标准治疗后进展并且无满意的替代治疗方案的不可切除或转移性MSIH/dMMR 成人和儿童实体瘤患者,或在氟嘧啶、奥沙利铂和伊立替康治疗后进展的MSI-H/dMMR CRC患者。这是FDA 首次批准不限瘤种和组织学类型的癌症治疗方法,其治疗是基于共同的肿瘤生物标志物,而非解剖学起源位置。
1 材料与方法
1.1 研究设计和患者
KEYNOTE-158 是一项非随机、开放标签、多中心的Ⅱ期研究。纳入了以下肿瘤类型的患者:肛门癌(队列A);胆管癌(壶腹癌除外的队列B);分化良好/中度分化的肺、阑尾、小肠、直肠或胰腺的神经内分泌肿瘤(队列C);子宫内膜癌(肉瘤和间充质瘤除外的队列D);宫颈鳞状细胞癌(队列E);会阴部癌(队列F);小细胞肺癌(队列G);间皮瘤(队列H);乳头状或滤泡状甲状腺癌(队列I);唾液腺癌(肉瘤和间充质瘤除外的队列J);任何其他MSI-H/dMMR 的晚期实体瘤(CRC 除外的队列K)。
符合条件的患者要求年龄≥18 岁,组织学/细胞学确诊为晚期(不可切除和/或转移性)无法治愈的非CRC 实体瘤,且既往标准治疗后疾病进展或不耐受。
1.2 研究过程
患者静脉注射帕博利珠单抗200 mg,每3 周1 次,35 个周期(约2 年)或直至疾病进展、不可耐受的毒性、妨碍治疗的合并症或患者/研究者决定退出研究。达到完全缓解的患者在至少8 次帕博利珠单抗治疗后可以停止治疗。确认疾病进展但有临床获益且肿瘤负荷没有额外增加的患者可以继续接受帕博利珠单抗治疗。患者采用CT(首选)或MRI 进行影像学检查,第一年每9 周检查一次,随后每12 周一次。
1.3 终点
主要终点是ORR,定义为由独立中心影像学审查委员会根据RECIST 1.1 版确认为完全/部分缓解的患者比例。次要终点包括缓解持续时间(duration of response,DOR),无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)。
2 结果
2.1 患者
2016 年2 月1 日至2018 年5 月8 日期间,纳入来自18 个国家55 个中心的233 例MSI-H/dMMR非CRC 患者。入组患者中共有27 种肿瘤类型,最常见的是子宫内膜癌、胃癌、胆管癌、胰腺癌、小肠癌和卵巢癌。至本次分析数据截止日期(2018 年12 月6 日),中位随访时间为13.4 个月(范围:0.4~34.2个月)。
2.2 疗效
233 例MSI-H/dMMR 癌症患者被纳入研究且接受了帕博利珠单抗治疗,因此进入疗效分析集。由独立中心根据RECIST 1.1 版评估,23 例(9.9%)确证为完全缓解,57 例(24.5%)为部分缓解,ORR 为34.3%(95%CI:28.3%~40.8%),见表1。在达到客观缓解的患者中,中位缓解时间为2.1 个月(范围:1.3~ 10.6个月)。在本次分析截止日期时,中位DOR 还未达到(not reached,NR)(范围:2.9~31.3+个月;+表示末次评估时无疾病进展)。在入组人数最多的7 种肿瘤类型中,完全缓解最常见于子宫内膜癌(n=8)和胃癌(n=4),见表2。在本次分析截止时,233 例患者中有160 例(68.7%)发生了疾病进展,中位PFS 为4.1 个月(95%CI:2.4~4.9 个月),113 例(48.5%)患者死亡,中位OS 为23.5 个月(95%CI:13.5 个月~NR)。
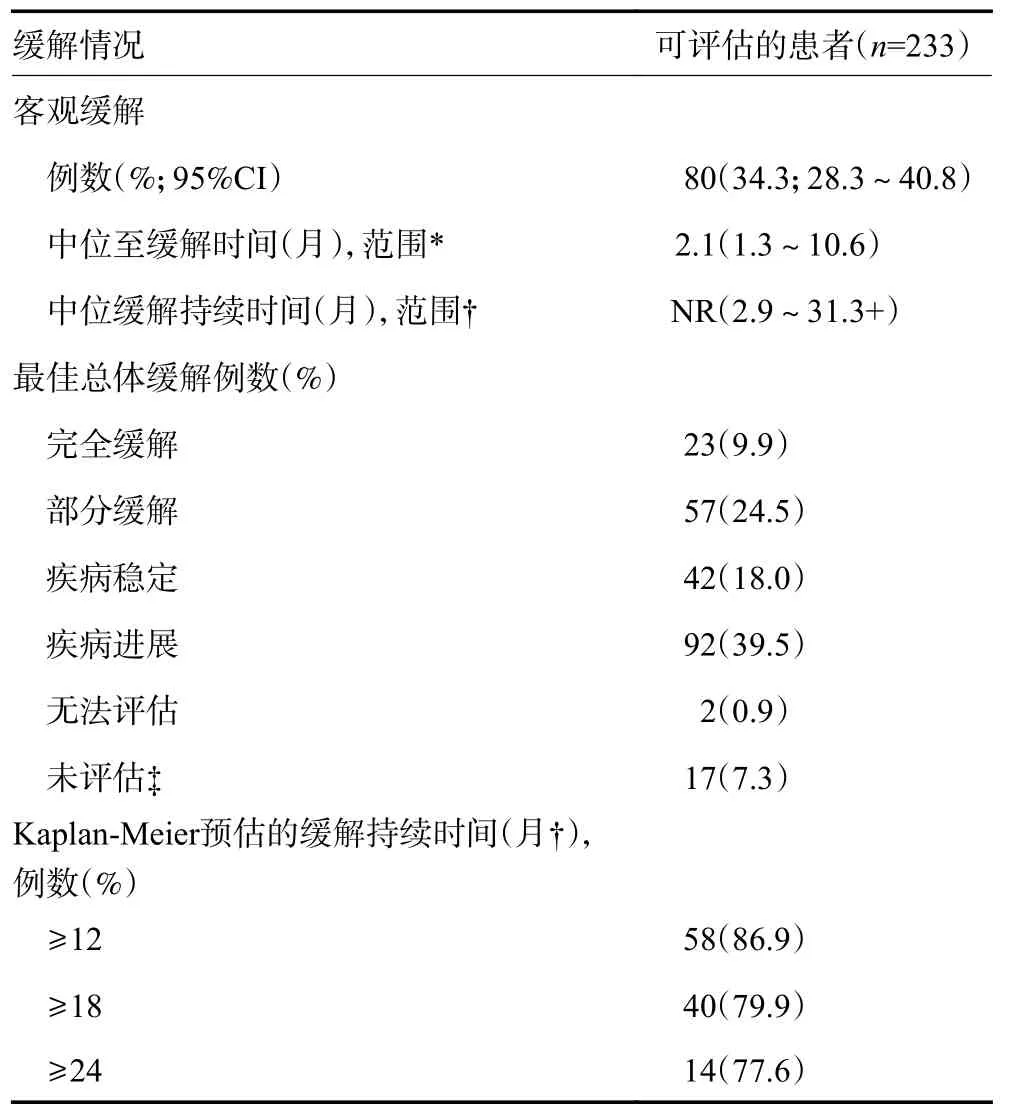
表1 独立中心影像学审查委员会根据RECIST 1.1 版评估的最佳总体缓解情况

表2 入组最多的肿瘤类型的抗肿瘤活性
2.3 安全性
总体上,151 例(64.8%)患者发生了治疗相关不良事件(treatment-related adverse event,TRAE),34 例(14.6%)患者发生3~ 5 级TRAE,其中1 例为5 级(肺炎)。最常见的TRAE 是疲劳(n=34;14.6%),瘙痒(n=30;12.9%),腹泻(n=28;12.0%)和虚弱(n=25;10.7%)。最常见的3 级TRAE 是γ-谷氨酰转移酶升高(n=4;1.7%)和肺炎(n=3;1.3%)。
54 例患者(23.2%)发生了免疫介导的TRAE 和输注反应。未发生致命的免疫介导的TRAE 或输注反应。
3 结论
该研究证明了帕博利珠单抗在既往治疗后进展或不耐受的转移性或不可切除的MSI-H/dMMR 非CRC 患者中具有持久的临床获益。而且,本研究结果支持每3 周1 次静脉注射200 mg 帕博利珠单抗用于晚期MSI-H/dMMR 癌症患者,无论肿瘤的解剖位置如何。
致谢
感谢默沙东(中国)投资有限公司肖楠和雷有颖为本文翻译提供学术支持,感谢上海北翱医药科技有限公司为本文提供辅助编辑工作,感谢默沙东(中国)投资有限公司的支持。
版权声明
本文原文“Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the Phase II KEYNOTE-158 Study”,首次发表在Journal of Clinical Oncology,2020,38(1):1-10;本次二次发表已取得版权所有者©2020 Wolters Kluwer 出版社的同意,对原文进行翻译,不涉及一稿多投及侵犯版权等问题。
专家点评
邓艳红①②
肿瘤是由细胞生长过程中重要基因突变引起的,保持基因组稳定性对防止肿瘤的发生具有重要意义[1]。MSI-H/dMMR 肿瘤由于MMR 功能的缺失,微卫星序列发生的插入、缺失等复制错误不能被正确地识别和纠正,而基因组编码区碱基的插入或缺失可能改变其阅读框,导致转录和翻译序列发生变化的移码肽。这些移码肽作为新抗原,具有高度的免疫原性,并促进肿瘤组织中新抗原特异性细胞毒性T 淋巴细胞的浸润[2]。此外,dMMR 肿瘤微环境中强烈表达PD-L1、CTLA-4 和LAG-3 等配体,可能对ICIs 治疗更为敏感[3]。
2012 年NEJM 发表了纳武利尤单抗治疗癌症的有效性、安全性及免疫相关性研究,在纳入的所有CRC 患者中均未观察到疾病缓解,后续随访中1 例患者在21 个月时出现疾病缓解,而该患者被证实为MSI-H/dMMR CRC[4]。为验证免疫治疗在MSI-H/dMMR 肿瘤中的疗效,约翰霍普金斯大学的研究团队启动了KEYNOTE-016 Ⅱ期临床研究,2015 年首次公布的结果显示,MSI-H/dMMR mCRC 和非CRC 队列的ORR 达40%和71%,而pMMR 的mCRC 患者ORR 为0[3],从而证实MSI/MMR 状态可预测ICIs 的临床获益。
基于KEYNOTE-016 研究结果,随后启动了KEYNOTE-164(MSI-H/dMMR mCRC)和KEYNOTE-158(MSI-H 非CRC 实体瘤)2 项临床试验[5-6]。其中KEYNOTE-164 研究进一步证实了帕博利珠单抗在既往接受过系统治疗的MSI-H/dMMR mCRC 患者的疗效优势(队列A 和队列B 的ORR 分别为32.8%和34.9%,中位OS 分别为31.4 个月和47.0 个月)[7]。KEYNOTE-158 研究纳入MSI-H/dMMR 非CRC 患者共233 例,涵盖27 种肿瘤类型,除了较为常见的子宫内膜癌、胃癌等,也包括肛门癌、间皮瘤、唾液腺癌等相对罕见的晚期癌种。患者接受200 mg 帕博利珠单抗Q3W 治疗至35 个周期,中位随访13.4个月时,结果显示不论解剖位置及组织学类型,MSIH/dMMR 非CRC 肿瘤均可从帕博利珠单抗治疗中获益,且疗效持久,其中子宫内膜癌、胃癌、胆管细胞癌及小肠癌的ORR 均在40.0%以上[6]。子宫内膜癌是全球女性第二大常见妇科恶性肿瘤,一线治疗失败后选择非常有限,晚期患者5 年OS 率仅17.0% 左右。KEYNOTE-158 研究中MSI-H/dMMR 子宫内膜癌患者的ORR 高达57.1%。随访42.6 个月的结果提示,达到缓解的患者中有68.0%的DOR 长达3 年及以上,3/4 年OS 率高达60.0%[7-8]。对素有“癌症之王”称号的胰腺癌,帕博利珠单抗单药在经标准治疗进展后的MSI-H/dMMR 胰腺癌患者中ORR 可达18.2%,中位DOR 达13.4 个月,为这些患者带来新的治疗选择。
MSI-H/dMMR 实体瘤患者通常难以从常规化疗中获益,KEYNOTE-164 和KEYNOTE-158 研究则确立了免疫治疗在该人群的治疗地位,并为晚期MSIH/dMMR 实体瘤的提供了更优效的治疗选择,具有重要的临床价值。
2017 年5 月,FDA 基于KEYNOTE-012、KEYNOTE-016、KEYNOTE-028、KEYNOTE-158、KEYNOTE-164 研究数据,加速批准帕博利珠单抗用于治疗患有不可切除或转移性MSI-H/dMMR 成人和儿童实体瘤患者。
此后,帕博利珠单抗和其他免疫治疗药物陆续开展多项研究,纳武利尤单抗、Dostarlimab 也相继获得FDA 批准。恩沃利单抗、替雷利珠单抗等多个针对MSI-H/dMMR 适应证的国产PD-1/L1 抑制剂获得了NMPA 批准或受理。
既往抗肿瘤药物的上市通常基于肿瘤来源、指明特定瘤种,以获批相应适应证。而以KEYNOTE-158等为代表的研究,不仅正式拉开免疫检查点治疗MSIH/dMMR 肿瘤的序幕,同时也开启了通过采用篮式研究设计,验证针对具有特定生物标志物的多瘤种的药物疗效并获批适应证的先河[9-10]。相似地,基于对KEYNOTE-158 研究中既往接受过治疗的不可切除性或转移性伴高肿瘤组织突变负荷(high tumour mutational burden,tTMB-H)患者队列的回顾性分析数据结果[11]是继MSI-H/dMMR 之后免疫治疗在泛癌种的第二项适应证。
此类篮式研究为评估某种药物或干预措施在由生物标志物定义的特定人群中的疗效和安全性提供了高效的解决方案,同时也为与常见肿瘤具有相同生物标志物的罕见瘤种提供参与研究并接受治疗的机会,而成为评估低发病率肿瘤靶向治疗的理想选择,更为开拓临床研究思路和优化试验设计带来了新的启发。
MSI-H/dMMR 肿瘤因其独特的病理分子特征而对免疫治疗敏感,已有多项研究证实免疫治疗在MSIH/dMMR 晚期一线及后线治疗中具有显著的生存获益,在围手术期的研究也在广泛开展,已有数据提示新辅助免疫治疗在MSI-H/dMMR 肿瘤患者中达到较高的影像学和病理缓解[12-13],为豁免手术、保留器官等策略带来希望和可能。未来,免疫治疗联合其他治疗手段进一步提高疗效,根据生物标志物对患者进行更加精准的分层以选择更适宜的治疗方案,可能是重要的探索和研究方向。
本文无影响其科学性与可信度的经济利益冲突。
