治疗前白蛋白与纤维蛋白原比值对根治性放化疗宫颈癌患者预后的价值*
2023-08-28伍健杜芝霖秦远郎锦义
伍健,杜芝霖,秦远,郎锦义
646000四川 泸州,西南医科大学附属医院 肿瘤科(伍健、杜芝霖、郎锦义);610041成都,四川省肿痛临床医学研究中心,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学附属肿瘤医院放疗中心,放射肿瘤学四川省重点实验室(秦远、郎锦义)
宫颈癌是现代社会中妇女健康的严重威胁之一[1],2020年全球女性恶性肿瘤新增病例860万,死亡病例660万,全球宫颈癌新增病例和死亡病例在其中的占比分别为6.5%和7.7%[2],2022年中国癌症中心发布关于宫颈癌症统计报告,2016年中国约有120 000新增病例和37 200死亡病例,2020年中国大陆地区城乡居民宫颈癌患病人群数量达到了109 741例,因宫颈癌死亡的人群数量达到了59 060例[3]。研究指出[4-5],白蛋白(albumin,ALB)是评价癌症患者营养状况的重要指标。纤维蛋白原(fibrinogen,FIB)由肝细胞合成,是一种血清糖蛋白,主要参与凝血过程和血小板聚集,与肿瘤的进展转移有密切联系[6-7]。血清ALB-FIB比值(albumin-to-fibrinogen ratio,AFR)与多种实体肿瘤的临床病理特征相关,在食管癌[8]、膀胱癌[9]、软组织肉瘤[10]等肿瘤疾病中相继报道。有Meta分析结果[11]显示,低AFR与癌症死亡率和复发风险增加相关,可能是癌症有意义的预后标志物。目前国内关于AFR对接受根治性放化疗的宫颈癌患者预后评估价值的研究较少,本研究通过比较治疗前不同AFR组宫颈鳞癌患者的临床特征及生存差异,分析AFR在宫颈鳞癌预后评估中的潜在应用价值。
1 资料与方法
1.1 临床资料
收集2011年1月至2018年12月首次就诊于四川省肿瘤医院,并完成同步放化疗的367例宫颈鳞癌患者的临床资料,优先纳入有明确进展或者生存结局的患者,根据CT、MRI、PETCT等影像学评估淋巴结及宫旁侵犯状态,根据2018年FIGO分期标准重新分期。纳入标准:(1)经宫颈活检病理诊断宫颈鳞癌;(2)治疗前1周有完整的血液学资料;(3)有完整详细的随访资料;(4)接受以铂类药物为基础的根治性同步放化疗并完成全部治疗。排除标准:(1)非首次入院行放化疗的患者;(2)放化疗后行手术治疗的患者;(3)远处转移或者同时患有其他肿瘤的患者;(4)未完成治疗或放弃治疗的患者;(5)同时合并血液系统、风湿免疫系统疾病、肝肾功能不全患者;(6)临床资料不全的患者;(7)因其他疾病或意外死亡的患者;(8)失访患者(患者入组流程图见图1)。
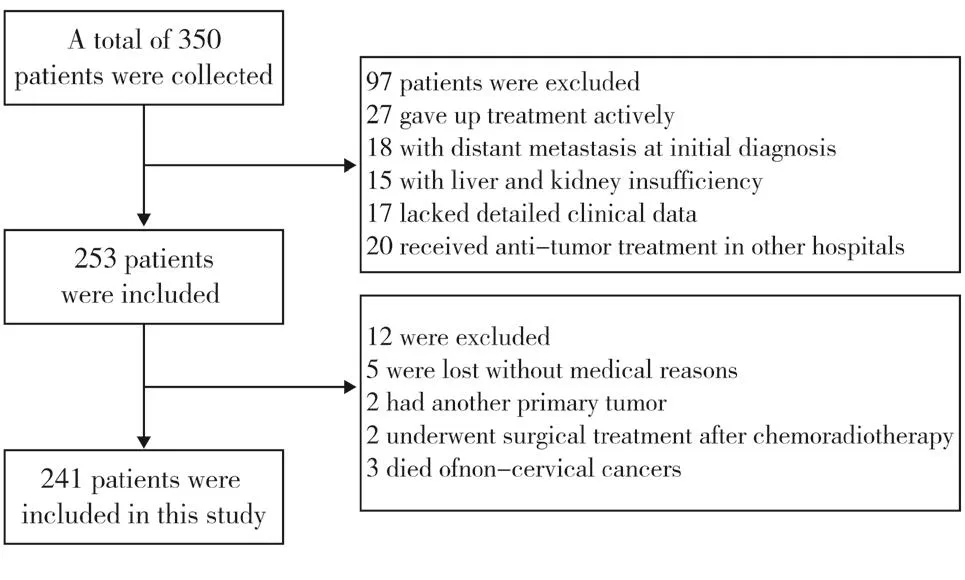
图1 患者入组流程图Figure 1.Flow of Patient Enrollment
1.2 患者基本信息
临床资料包括确诊年龄、病理分化程度、淋巴结转移及宫旁侵犯情况、FIGO分期、肿瘤直径、首次治疗前1周内资料包括血清ALB水平、FIB水平、中性粒细胞计数、淋巴细胞计数、单核细胞计数、血小板计数等,分别计算治疗前AFR、中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)、全身免疫炎症指数(systemic immune-inflammation index,SII)、全身性炎症反应指数(systemic inflammatory response index,SIRI)等间接反映患者外周血炎症水平的指标。
1.3 随访
末次随访时间为2019年12月,随访方式包括门诊复查和电话随访。所有患者在治疗结束后1年内每3个月随访1次,1年后每6个月随访1次。3年后每12个月随访1次。随访内容包括:妇科检查、血液学复查、宫颈液基薄层细胞检测、腹盆腔影像学检查等。无进展生存期(progression-free survival,PFS)定义为患者病理确诊时间至疾病复发或转移的时间。总生存期(overall survival,OS)定义为患者病理确诊时间至死亡时间或末次随访时间。
1.4 统计学方法
采用SPSS 25.0、R 4.2.1软件、仙桃学术(xiantao.love)、SPSSPRO(spsspro.com)在线网站进行数据分析和绘图。计量资料用均数±标准差()表示,计数资料用例数(n)或百分率(%)表示。采用Kruskal-Wallis检验和Wilcoxon检验,评估AFR水平在不同FIGO分期和生存状态组别的差异性。采用受试者工作特征( receiver operating characteristic,ROC)曲线的AUC评估预测效能,以约登指数最大值确定AFR等变量的最佳截断值。采用Kaplan-Meier 法及Log-rank检验进行生存分析、绘制患者OS及PFS的生存曲线、比较分组数据间差异。采用Cox回归模型对影响患者预后的变量进行单因素和多因素分析,同时绘制1、3、5年的OS和PFS预后列线图,通过预后矫正曲线评估列线图的预测水平,P < 0.05代表具有统计学差异。
2 结 果
2.1 患者临床特征
共241位患者符合纳入标准。有6位被诊断为FIGO(2009)IIB期的宫颈癌患者,修正分期为FIGO(2018)IIIA期。共有IIB期患者146例(60.6%),IIIA期40例(16.6%),IIIB期40例(16.6%),IVA期15例(6.2%)。患者平均年龄(51.5±25.5)岁(26~77岁),平均随访时间(55.8±48)个月(7.8~103.8个月)。共有死亡49例(20.3%)。病情进展86例(35.7%)(表1)。

表1 241例宫颈癌患者基本情况Table 1.Characteristics of 241 Patients with Cervical Cancer
2.2 治疗前AFR水平在不同FIGO分期,肿瘤进展状态及患者生存情况中的比较
AFR的水平在不同的FIGO分期差异有统计学意义,其水平随FIGO分期的增加而下降,在IIB期水平最高,在IVA期水平最低。AFR水平在病情进展组与未进展组之间、死亡组与生存组之间差异有统计学意义。病情未进展组水平高于进展组水平(P < 0.001),生存组水平高于死亡组水平(P < 0.001;图2)。
2.3 单个指标及联合指标OS及PFS诊断ROC曲线
以OS及PFS为状态变量,治疗前AFR、NLR、PLR、SII、SIRI等为检验变量,绘制ROC曲线。单个指标OS诊断ROC曲线中,PLR的AUC最大,为0.894。单个指标PFS诊断ROC曲线中,NLR的AUC最大,为0.867, AFR的AUC在上述两组中分别为0.784、0.702,准确度表现一般(P < 0.001)。而在联合指标OS及PFS诊断ROC曲线中,AFRNLR较其他联合指标具有更高的AUC值,分别为0.901、0.876,具有较高的准确度(P < 0.001;图3)。
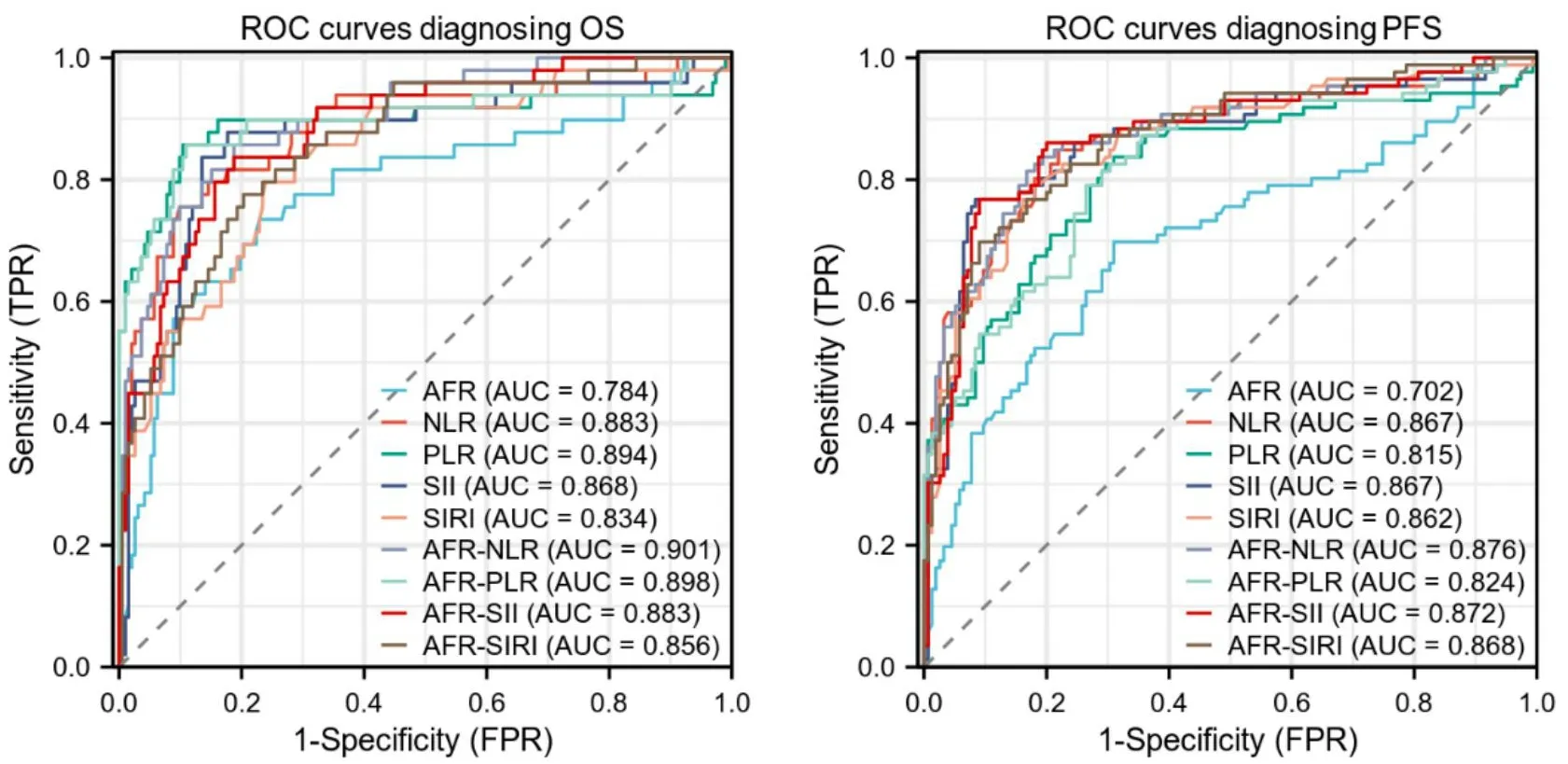
图3 治疗前AFR的OS与PFS诊断ROC曲线Figure 3.ROC Curves Diagnosing OS and PFS
2.4 AFR等指标与OS及PFS相关的最佳截断值结果
以约登指数最大,即使得“灵敏度+特异度-1”达到最大所对应的值为最佳截断值。分别计算AFR等指标与OS及PFS相关的最佳截断值结果。AFR等指标与OS相关的最佳截断值计算结果见表2,AFR等指标与PFS相关的最佳截断值计算结果见表3。
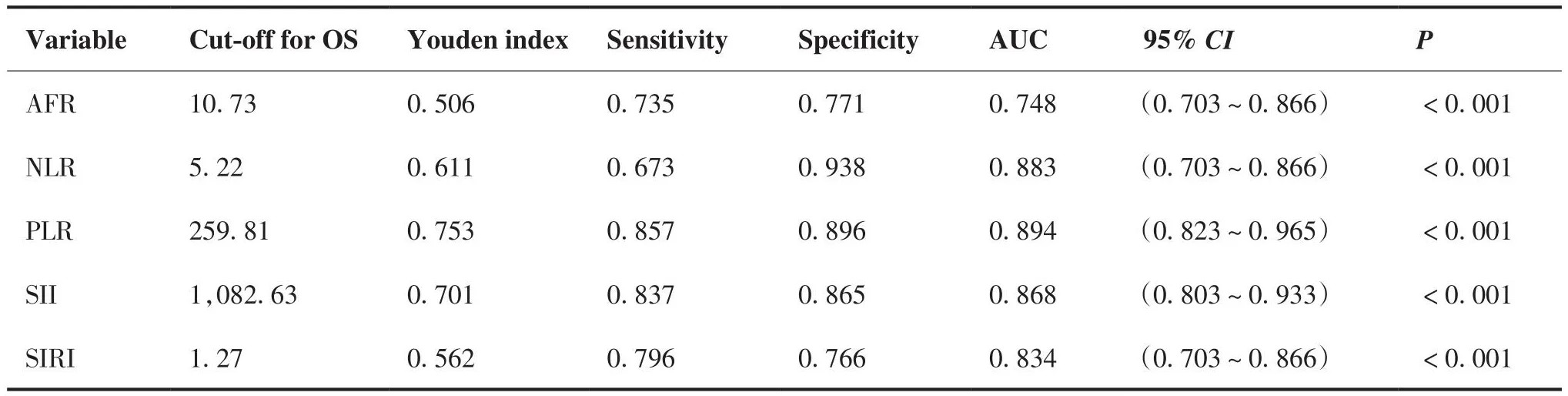
表2 AFR等指标与OS相关的最佳截断值计算结果Table 2.Optimal Cut-off Values for Indicators Such as AFR in Relation to OS
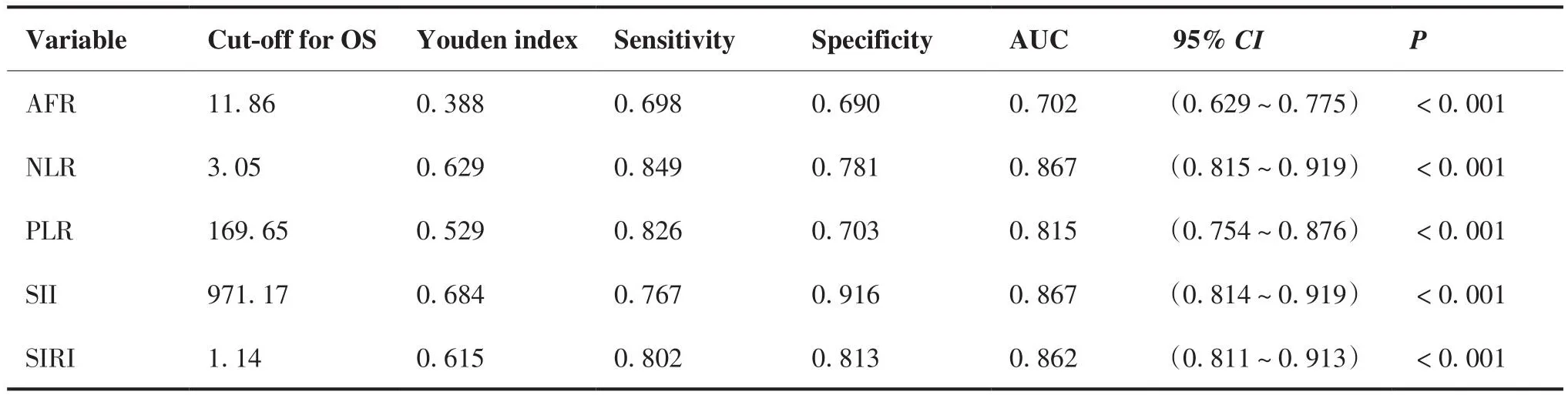
表3 AFR等指标与PFS相关的最佳截断值计算结果Table 3.Optimal Cut-off Values for Indicators Such as AFR in Relation to PFS
2.5 AFR水平与宫颈癌患者临床特征分组相关性分析
根据最佳截断值计算结果将AFR分为高值组和低值组,分别与宫颈癌患者临床特征分组进行相关性分析,OS-AFR高值组(AFR≥10.73)与OSAFR低值组(AFR < 10.73)相比,OS-AFR高值组的肿瘤分期相对较早,治疗前NLR、PLR、SII、SIRI水平多处于各指标最佳截断值水平以下,在是否出现淋巴结转移及患者生存状态等组间的差异也具有统计学意义(P<0.05),但在肿瘤大小及是否出现宫旁侵犯等组间的差异不具有统计学意义。PFS-AFR高值组(AFR≥11.86)与PFS-AFR低值组(AFR < 10.73)相比,PFS-AFR高值组的肿瘤分期相对较早,治疗前NLR、PLR、SII、SIRI水平多处于各指标最佳截断值水平以下,在肿瘤大小及是否出现淋巴结转移、宫旁侵犯和肿瘤进展等组间的差异也具有统计学意义(P < 0.05;表4)。
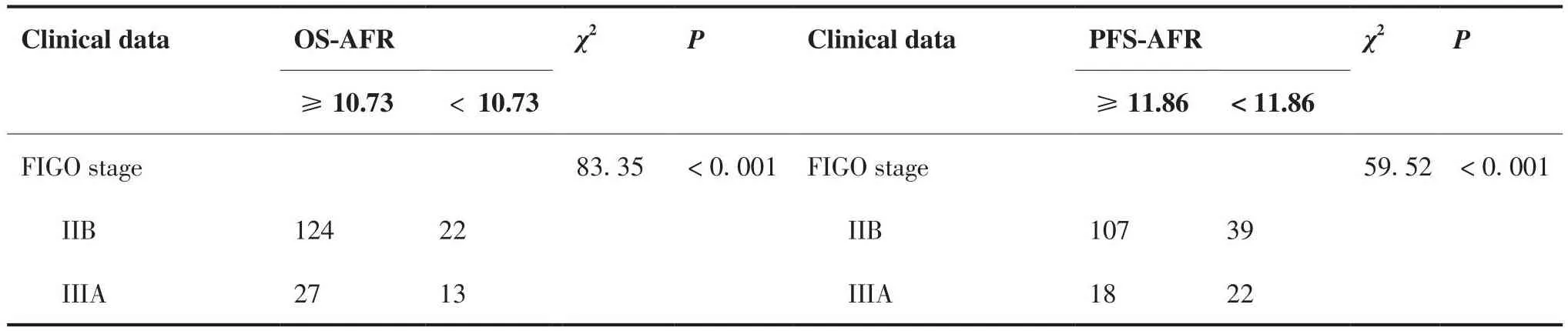
表4 治疗前AFR水平高低组与患者临床资料相关性分析结果Table 4.Correlation between Pre-treatment AFR Levels and Clinical Data of Patients
2.6 生存曲线
截至末次随访时间,全组患者的3年OS及PFS分别为73.03%、67.22%。5年OS及PFS分别为50.21%、48.55%。其中,AFR高值组患者3年OS及PFS分别为81.25%、70.37%,5年OS及PFS分别为85.12%、70.94%。生存曲线结果证实,治疗前AFR水平越高,患者更有可能获得更长的OS和PFS(图4)。
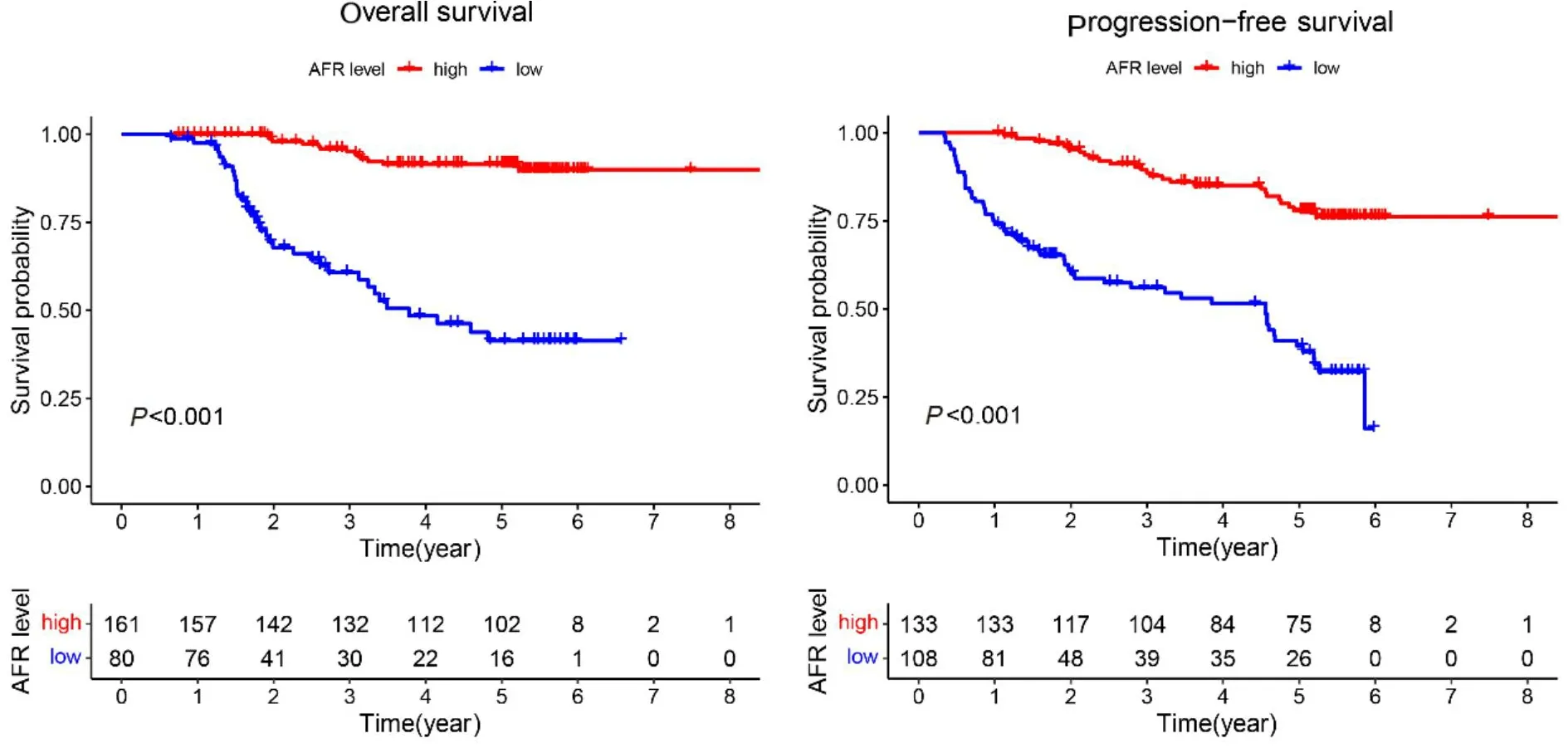
图4 治疗前AFR水平高低组OS及PFS的Kaplan-Meier曲线Figure 4.Kaplan-Meier Curves of OS and PFS in Patients with High and Low Pre-treatment AFR Levels
2.7 影响宫颈癌患者预后因素的COX回归分析
选择治疗前AFR、NLR、PLR、SII、SIRI水平及肿瘤分期等因素分别进行COX回归分析。单因素COX分析结果显示,治疗前AFR、NLR、PLR、SII、SIRI水平及肿瘤分期是影响患者OS及PFS的危险因素。多因素COX分析结果显示,治疗前AFR、NLR、PLR水平及肿瘤分期是影响患者OS的独立预后因素,治疗前AFR、NLR、PLR水平是影响患者PFS的独立预后因素(表5、6)。
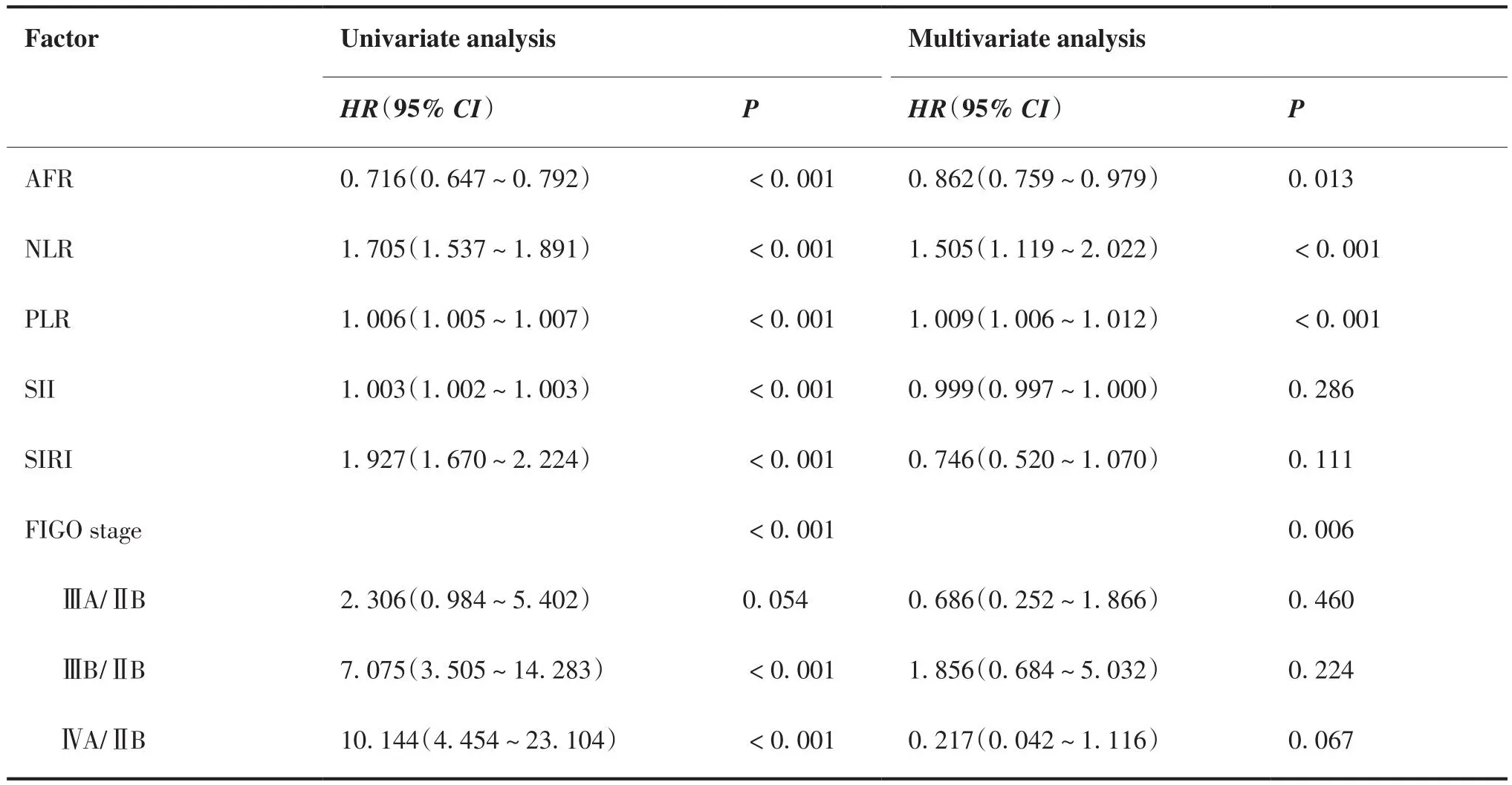
表5 OS相关单因素及多因素COX分析结果Table 5.Results of Univariate and Multivariate COX Analyses of Factors Affecting OS
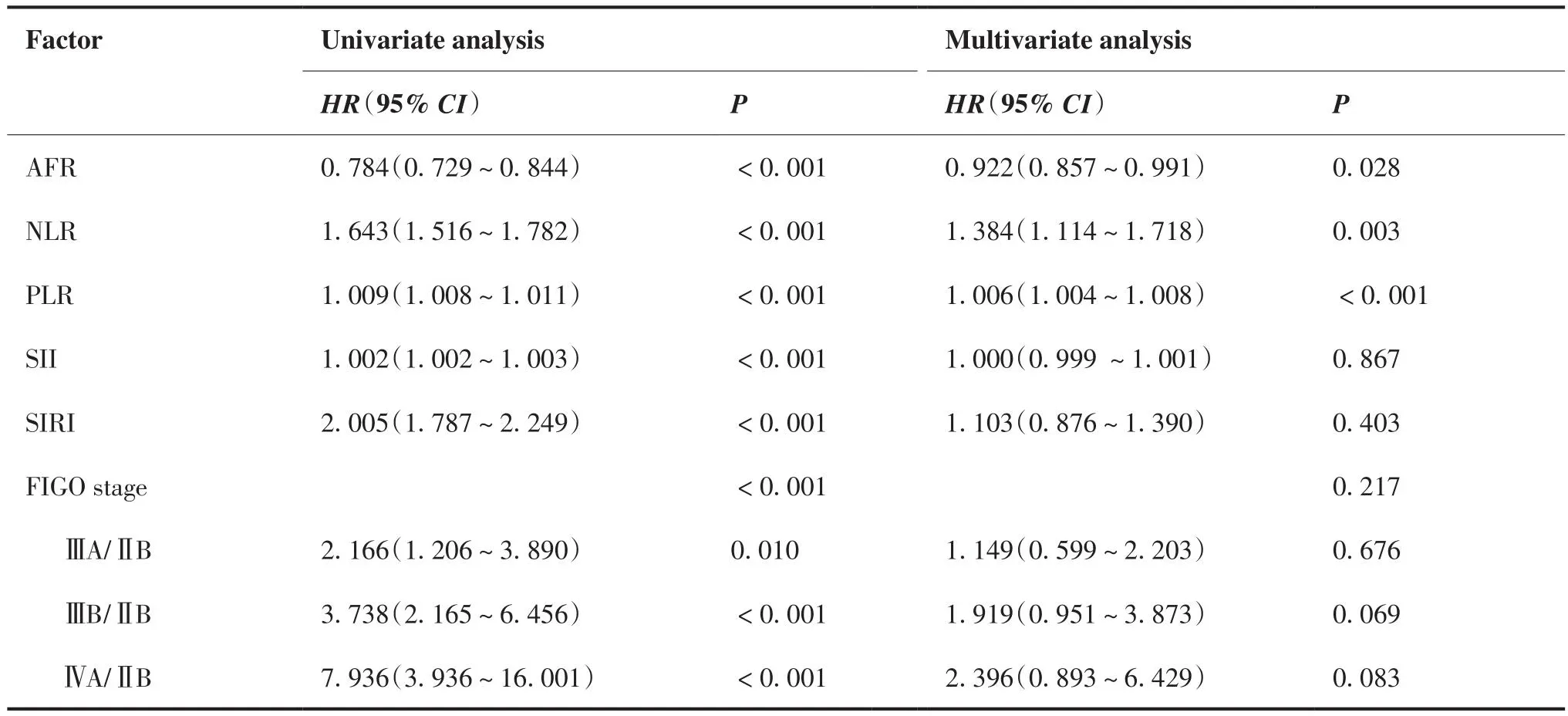
表6 PFS相关单因素及多因素COX分析结果Table 6.Results of Univariate and Multivariate COX Analyses of Factors Affecting PFS
2.8 构建OS的预后列线图与预后校准曲线
根据多因素Cox分析选择出的独立预后因素构建了OS的预后列线图。列线图显示,治疗前PLR水平对预测宫颈癌患者的OS贡献最大,其次是治疗前AFR水平、NLR水平,最后则是SIRI水平。每个变量均被赋予了一个从1~100的加权分数,将这些分数相加之后确定生存概率轴和总分轴的垂直交点的数值,最后得到宫颈鳞癌患者1、3、5年后的OS概率。预后校准曲线显示1、3、5年预测曲线与理想曲线拟合良好(图5)。
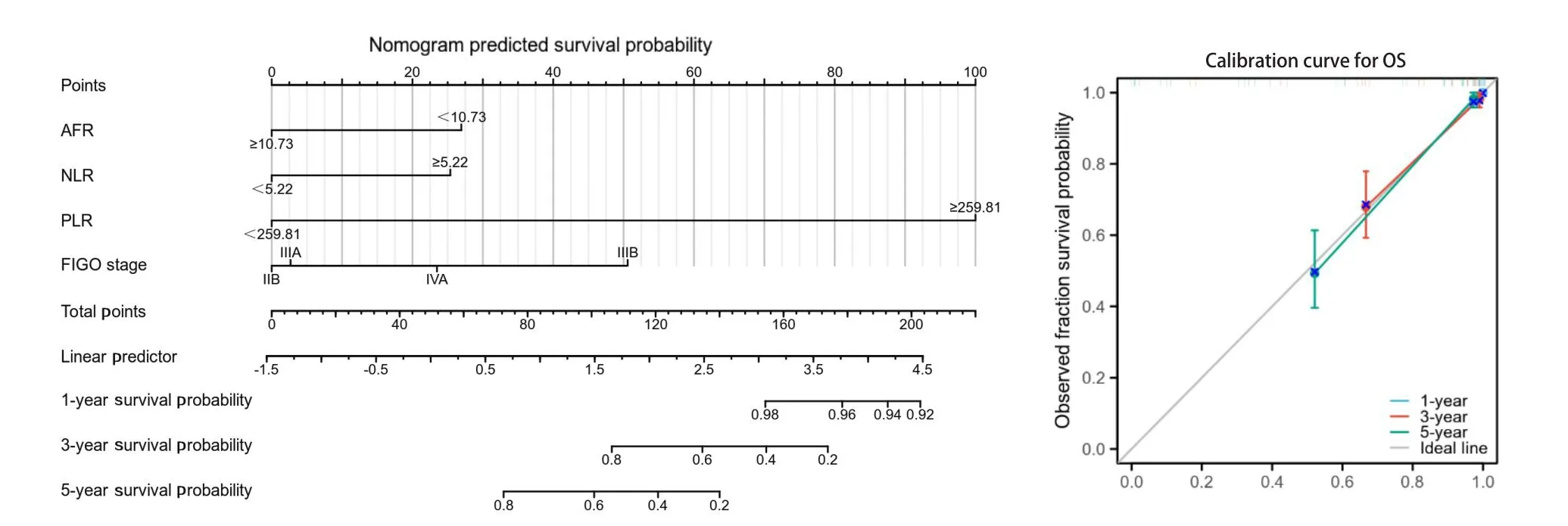
图5 OS的预后列线图及预后及预后校准曲线Figure 5.Nomogram and the Calibration Curve for OS
3 讨 论
宫颈癌具有发生率高、死亡率高、预后差等流行病学特征,通常发病缓慢,病变常见于宫颈管内的腺上皮或宫颈管鳞柱交界的结合处[12],因此起病较为隐匿,多在出现临床症状后才选择就医,此时患者大概率已处于疾病进展的中晚期,从而失去了最佳的手术根治机会。林元[13]及傅华等[14]的研究均表明,宫颈癌放疗预后影响因素包括肿瘤直径>4cm、淋巴结转移、有脉管瘤栓、切缘阳性,原因为血管侵犯与转移扩散危险性随着肿瘤直径的增大而提升,降低患者的远期生存率。陈宝杰等[15]回顾分析了接受根治性同步放化疗的106例局部晚期宫颈癌患者,认为CT、MRI或PET-CT未见髂总和腹主动脉旁淋巴结转移的局部晚期宫颈癌患者接受根治性同步放化疗后,其近期疗效与远期疗效均确切。盆腔延伸野放疗能改善局部晚期宫颈癌患者OS和PFS。白雪[16]回顾了62例接受调强适形放疗联合化疗治疗的宫颈癌患者提出,宫颈癌患者调强适形放疗联合化疗治疗预后不良与患者FIGO分期、放疗疗程、治疗前鳞状细胞癌相关抗原水平等因素有关。中晚期宫颈癌患者常常因阴道反复出血使机体出现贫血、低ALB血症、外周血高凝状态等。ALB在肝脏中合成,在全身炎症反应中发挥重要作用,ALB水平可反映机体的营养状况及免疫状态[17]。低ALB水平抑制机体免疫系统,增强肿瘤相关炎症反应,增加细胞因子释放,促使肿瘤出现进展。一项关于卵巢癌与ALB水平关系的研究表明,当ALB水平< 35g/L时,患者术后出现并发症及死亡率明显升高,表明低ALB水平与卵巢癌患者的不良预后相关[18]。一项关于子宫内膜癌与ALB关系的研究显示,治疗前血清ALB水平可作为评估子宫内膜癌患者无瘤生存期及PFS的独立预测因子[19]。FIB属于一种糖蛋白,由肝脏细胞合成和分泌,是凝血级联反应的重要组成部位,可用作评估血栓前状态、肺组织损伤、机体凝血及止血等血液流变学指标。FIB作为肝脏合成的急性期反应蛋白质,与恶性肿瘤发生间具有密切联系。首先,FIB可以促进肿瘤基质的形成和稳定, 固化肿瘤细胞外基质的框架结构,癌细胞可引起FIB的周围性聚集,通过炎症反应影响肿瘤微环境进而促进癌细胞增殖[20]。其次,FIB作为桥接肿瘤细胞和靶器官血管的分子桥,增强肿瘤细胞在靶器官血管系统中的内皮粘附功能,该机制可促进癌细胞的转移及侵袭能力[21]。然后,FIB可与生长因子结合,促使肿瘤组织血管生成,增加瘤体营养,促使肿瘤生长转移。最后,FIB沉积可促进血栓块的形成作为保护屏障来保护肿瘤细胞,导致肿瘤细胞远处转移的机会增加[22]。实验表明,FIB能够通过激活局部黏着斑激酶促进直肠癌增殖[23],FIB可作为结直肠癌的辅助诊断指标[24]。多项研究表明,血清ALB和FIB在肿瘤的发生发展过程中发挥着的重要功能[25-28]。一项关于胆囊癌的研究结果显示,相较于ALB,AFR更能准确地评估胆囊癌患者的预后[29]。作为FIB与ALB的组合,AFR克服了单一指标局限性,能够综合FIB与ALB在病理生理方面的作用,作为一种营养状况及凝血系统结合指标,具有易获得、方便及廉价等优势。在反映全身性炎症反应的同时又与肿瘤细胞存活、黏附及转移密切联系。作为新型炎性标志物及潜在预测因子,AFR已被用于多种实体肿瘤预后的评估,如结肠癌[30]、卵巢癌[31]、前列腺癌[32]、胃肠道间质瘤[33]等。Wang等[34]发现,在88例食管小细胞肿瘤人群中,低AFR水平组的患者预后更差。Li等[35]通过回顾性分析412例肺癌患者提出,患者的AFR水平与其生存率呈正相关。此外,Wang等[36]回溯了包括452例结直肠癌肝转移的患者的临床资料,认为相较于传统标志物如癌胚抗原等,术前AFR水平拥有更高的预测效能。刘晓丽等[37]提出FIB与ALB比值(fibrinogen-to-albumin ratio ,FAR)、临床分期、淋巴结转移均是影响IB~IIA期宫颈癌患者预后的独立危险因素,赵秀梅等[38]通过回顾分析124例行手术治疗的宫颈癌患者,提出FAR预测宫颈癌患者不良预后的AUC为0.858。淋巴结转移、组织病理分化、临床分期、FAR是影响宫颈癌患者预后不良的独立危险因素。
本研究结果显示,治疗前AFR水平随FIGO分期的升高而降低,单个指标OS诊断ROC曲线中,PLR的AUC最大,为0.894。单个指标PFS诊断ROC曲线中,NLR的AUC最大,为0.867, AFR的AUC在上述两组中分别为0.784、0.702,准确度表现一般(P < 0.001)。在联合指标OS及PFS诊断ROC曲线中,AFR-NLR的 AUC最大,分别为0.901、0.876。生存曲线结果证实,治疗前AFR水平越高,患者更有可能获得更长的OS和PFS(P < 0.001)。根据最佳截断值计算结果将AFR分为高值组和低值组,分别与宫颈癌患者临床特征分组进行相关性分析,OS-AFR高值组与低值组相比,高值组的肿瘤分期相对较早,治疗前NLR、PLR、SII、SIRI水平多处于各指标最佳截断值水平以下,在是否出现淋巴结转移及患者生存状态等组间的差异也具有统计学意义(P < 0.05),但在肿瘤大小及是否出现宫旁侵犯等组间的差异不具有统计学意义。PFS-AFR高值组与低值组相比,高值组的肿瘤分期相对较早,治疗前NLR、PLR、SII、SIRI水平多处于各指标最佳截断值水平以下,在肿瘤大小及是否出现淋巴结转移、宫旁侵犯和肿瘤进展等组间的差异也具有统计学意义(P < 0.05)。单因素和多因素COX分析结果证实,治疗前AFR水平是影响患者OS及PFS的独立预后因素。最后根据多因素Cox分析选择出的独立预后因素构建了OS的列线图,预后校准曲线提示1、3、5年的预测曲线拟合良好,模型可靠性高。综上所述,治疗前AFR水平是影响根治性放化疗宫颈鳞癌患者独立的预后因素,治疗前高水平的AFR对患者的预后存在预测价值。但本研究主要对以往临床工作积累的病例资料进行回溯,样本量较少,部分病例资料因当时的时代条件及检测水平所限,无法收集到更多的临床病例资料,故未来仍需不断丰富临床资料、增加病例数进行研究,以获得更多的研究结果,更好地指导临床诊治。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
