子宫内膜浆液性癌与高级别癌的预后生存比较(附70例临床分析)
2023-08-28吕东阳吴曦张国楠
吕东阳,吴曦,张国楠
646000四川 泸州,西南医科大学附属医院 肿瘤科; 610041成都,四川省肿瘤临床医学研究中心,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学附属肿瘤医院 妇科肿瘤中心
子宫内膜癌(endometrial cancer,EC)是女性生殖系统最常见的恶性肿瘤之一,其发病率位于中国女性生殖系统肿瘤第2位[1],传统的EC分型包括bokhman分型[2]和2014年WHO女性生殖器官肿瘤分类(以下简称WHO分型),目前仍广泛应用于临床。I型EC是雌激素敏感型,预后良好,这种类型出现在肥胖、高血脂和有高雌激素症状的女性中[2]。II型EC约占EC的20%,包括高级别子宫内膜样癌[grade 3 endometrioid carcinoma,G3EC(据WHO分级又称低分化子宫内膜样癌)]及一些非子宫内膜样组织肿瘤,如子宫内膜浆液性癌(uterine serous carcinoma,USC)和透明细胞癌。II型EC通常是高级别肿瘤,整体预后差,与雌激素刺激的相关性不明显[2-3],其中G3EC同时具有I型和II型EC的特征,关于G3EC应该被归类为I型还是II型EC目前学界尚有争论[4]。USC是一种具有侵袭行为的EC,倾向于早期扩散到子宫外,仅占新发EC病例的10%,但却占该病死亡病例的40%[5]。关于USC和G3EC患者的生存结局,先前对这些组织类型之间的比较研究存在争议。既往有相关研究显示两种类型EC的预后没有显著差异[6],而另有研究则表明,与G3EC相比,USC与不良预后相关[7-8]。本研究的主要目的是比较两种组织学亚型高级别EC患者术后的总生存率(overall survival,OS)和无进展生存率(progression-free survival,PFS)。次要目的是评估两种EC的预后因素,以预测其生存结局。
1 资料与方法
1.1 资料来源
回顾分析2012年7月至2018年1月于四川省肿瘤医院初次接受治疗的70例I~IV期USC和G3EC患者的临床病理资料,纳入及排除标准: (1)经组织病理学诊断为USC或G3EC,且初次接受治疗的患者;(2)由 2位及以上高年资妇科肿瘤医师行双合诊及三合诊检查,并结合包括CT、PET-CT及MRI在内的影像学及组织病理学,按FIGO标准分期为 I~IVb期;(3)年龄 18~75岁;(4)所有入组患者均根据修订的2018年FIGO外科分期标准进行再分期。术后辅助放疗或辅助化疗用于具有中高风险因素的病例[9-10],由临床医师判断及患者共同决定;(5)排除随访资料不完善的患者;(6)无其他恶性肿瘤病史;(7)无血液系统疾病、自身免疫系统疾病、器官功能障碍、急慢性感染。
1.2 术后辅助治疗方法
EC术后放射治疗方式包括腔内放疗及体外照射,体外照射使用直线加速器,放疗技术采用三维适形调强放疗,处方剂量 45~50 Gy,分割剂量1.8~2.0 Gy/F,疗程 5~6 周;腔内放疗主要用于阴道残端和部分阴道上段的照射,使用阴道卵圆形或阴道柱形施源器完成,单独应用时,处方剂量为6~7 Gy/3~5次,若腔内近距离治疗联合体外照射应用时处方剂量为4~6 Gy/2~3次。化疗包括3到6个周期的以铂类为基础的单药或联合方案。所有患者均未在手术前接受化疗或放疗。
1.3 随访
随访以门诊随访和电话随访为主,部分患者至当地医院接受检查则以电话随访。随访内容包括妇科检查、胸片或胸部 CT、盆腔彩超或盆腔MRI检查,随访终点为5年。OS定义为从手术日期开始,直到最后一次随访或死亡的时间。PFS定义为从手术日期开始到影像学或组织病理学诊断复发或最后一次随访的时间。区域复发定义为阴道或阴道旁组织及盆腔或主动脉旁淋巴结肿瘤复发,远处转移定义为在这些区域以外的任何其他位置出现肿瘤复发。对于通过组织学检查诊断的复发,进行妇科检查或组织学活检操作日期用作治疗失败日期。通过影像学资料诊断的复发,复发日期设定为相应影像学检查出具诊断报告的日期。
1.4 统计学方法
采用 SPSS 27.0软件进行统计分析,计量资料采用t检验比较分组变量均值,计数资料用卡方检验比较各组分类变量之间的频率分布,如果最小期望频率小于5,则使用Yates检验,如果最小期望频率小于1则使用Fisher精确检验。使用Kaplan-Meier法对分类变量进行生存分析,组间生存率比较采用 Log-rank检验。采用Cox回归模型进行单因素和多因素分析,P < 0.05为差异有统计学意义。
2 结 果
2.1 临床资料
共纳入70例患者,G3EC 39例,USC 31例。结合病史、发病经过及病理学免疫组化分型排除高分化癌、中分化癌、肉瘤、混合型癌、肠癌转移、卵巢癌局部扩散的患者。
病例资料的统计学特征和组织学亚型分布见表1,所有患者均进行了全子宫切除术为基础的外科分期手术。患者的中位年龄54岁(39~75岁)。截止随访时间,G3EC组有33例存活,6例死亡,USC组有17例存活,14例死亡,无失访。中位随访时间60.00个月,最短随访时间5.03个月,最长随访时间60.00个月。
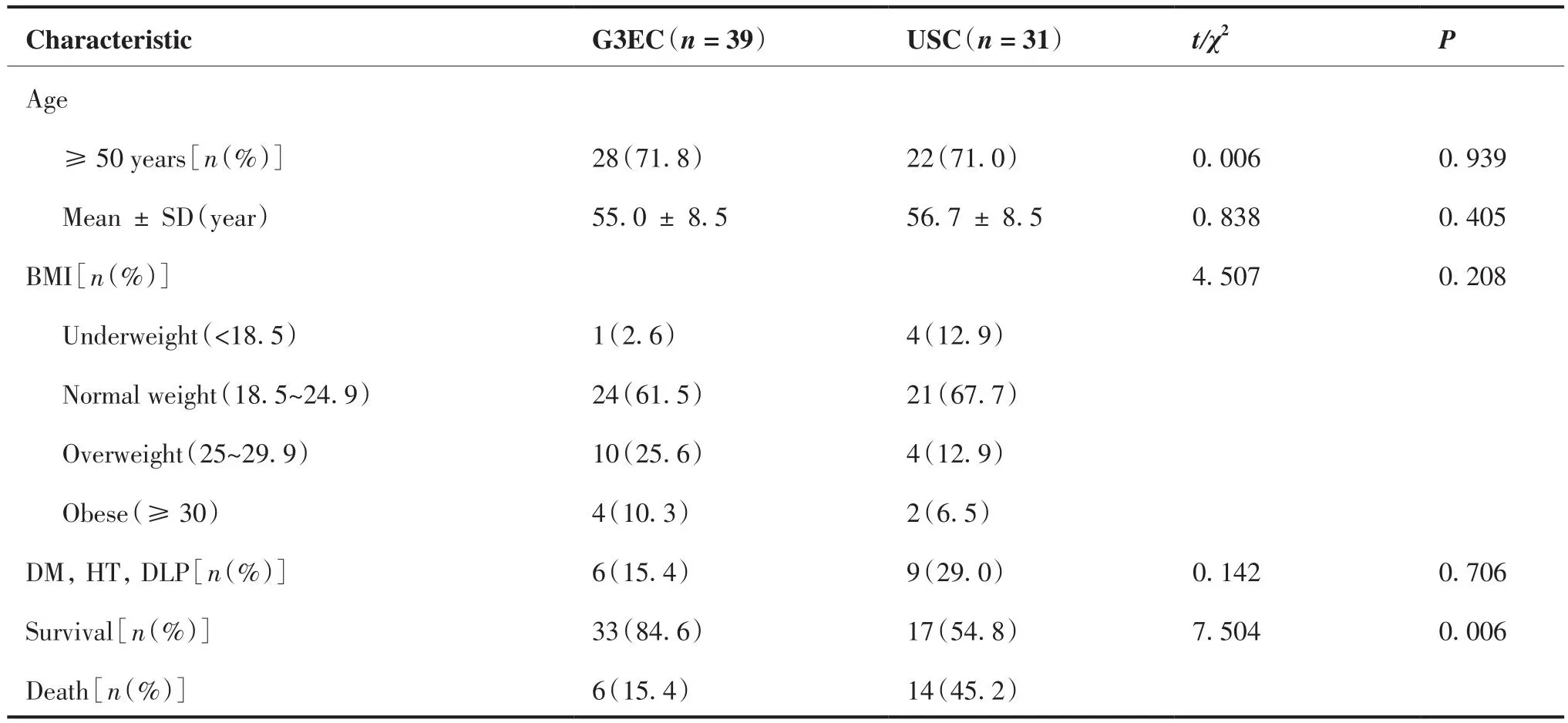
表1 按组织学类型分类的入组患者临床特征Table 1.Clinical Features of Enrolled Patients Classified by Histological Type
按组织学类型分类的治疗方式和术后病理学特征如表2所示。两组患者初始治疗选择方式存在差异,两组患者获得满意肿瘤减瘤术的构成比例差异无统计学意义(100% vs 87.1%,P = 0.073)。与G3EC患者相比,USC患者肿瘤原发灶更容易出现宫颈间质浸润(41.9% vs 17.9%,P = 0.027)和局部扩散(54.8% vs 30.8%,P = 0.042),两组患者在淋巴脉管浸润率、盆腔淋巴结转移率及腹腔冲洗液细胞学阳性率方面差异无统计学意义。两组患者均未查见腹主动脉旁淋巴结转移。根据2018 FIGO子宫体癌分期,本研究纳入I期USC患者13例(41.9%),I期G3EC患者23例(59%),III~IV期USC患者共15例(48.4%),III~IV期G3EC患者共13例(33.3%)。

表2 治疗方式和术后病理特征Table 2.Treatment Methods and Postoperative Pathological Features
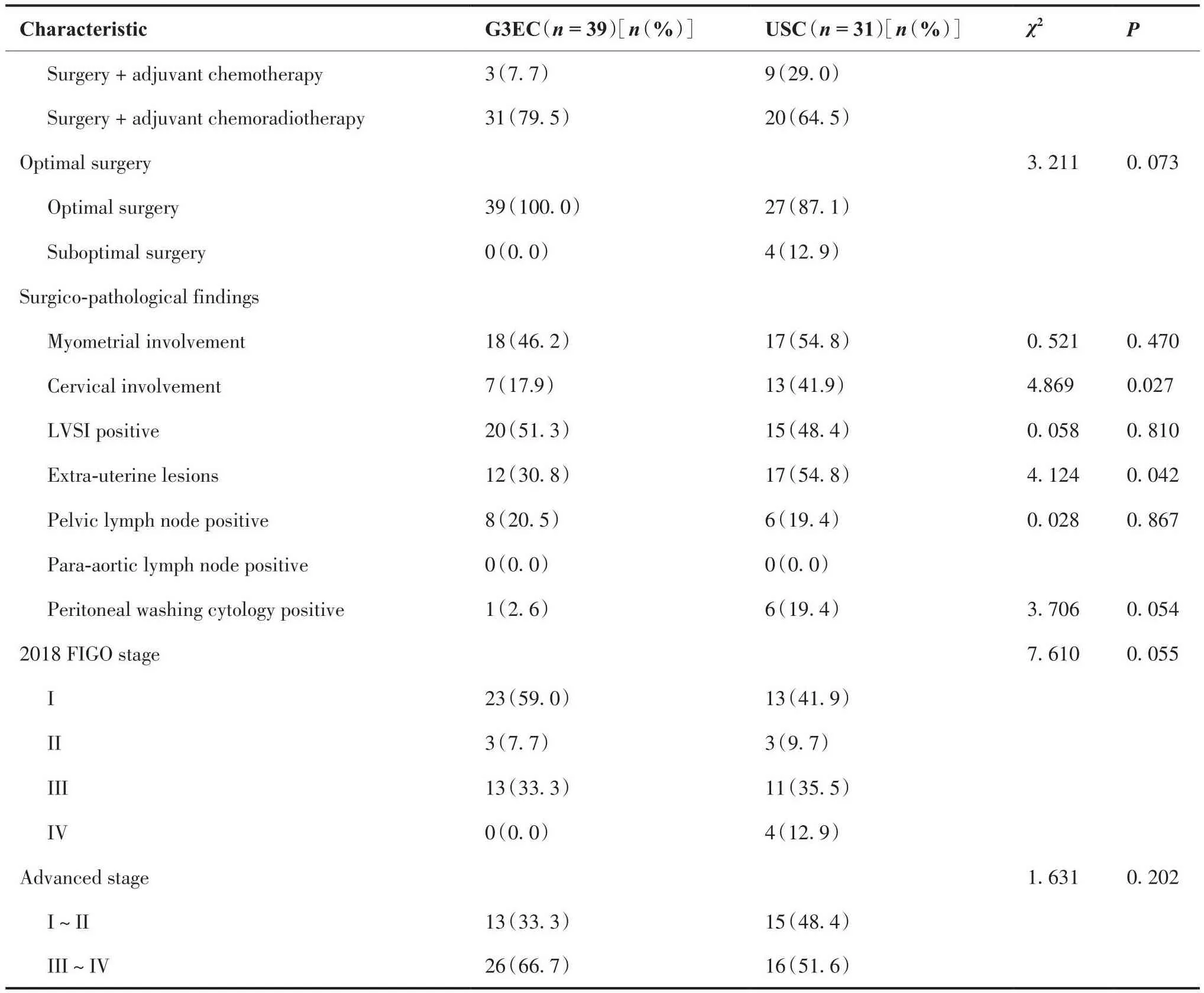
(Continued from previous page)
2.2 预后及影响因素分析
由表3可见,本研究中G3EC患者的5年生存率与USC患者相比差异有统计学意义(84.6% vs 54.8%,P = 0.006);两组患者的复发与转移率差异有统计学意义(10.3% vs 35.5%,P = 0.011),且USC患者的肿瘤远处转移率与G3EC患者相比差异有统计学意义(25.8% vs 5.1%,P = 0.035)。
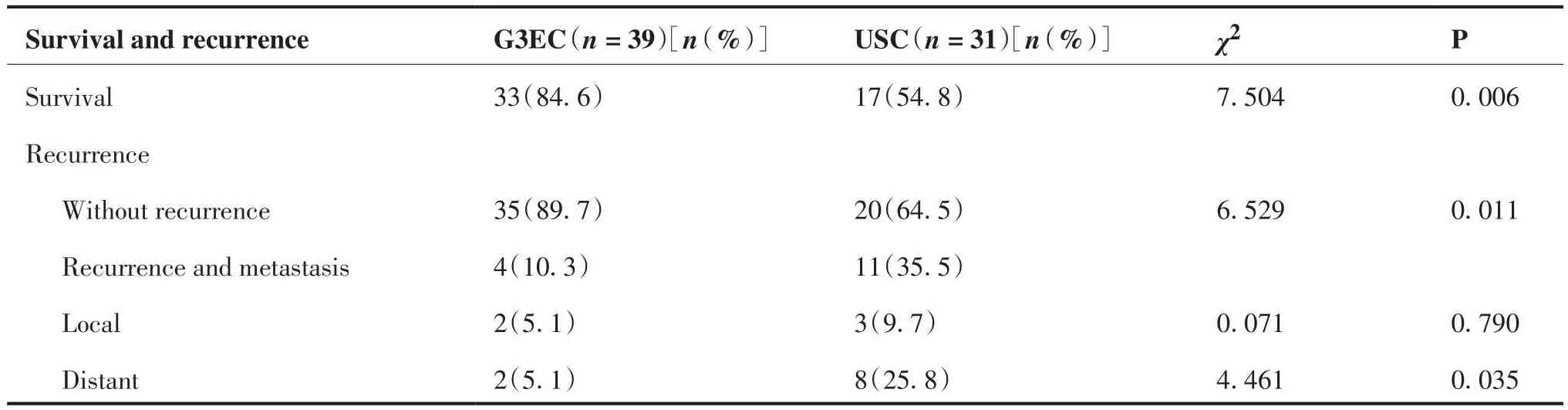
表3 生存率和复发模式Table 3.Survival and Recurrence
根据组织学类型分组,PFS和OS结局的Kaplan-Meier生存曲线分别如图1、2所示。PFS和OS的单变量和多变量Cox回归模型分别总结于表4、5。单因素分析显示,病理类型为USC、腹腔冲洗液细胞学阳性、原发灶超出子宫体、未实施满意减瘤手术、中晚期肿瘤是患者PFS和OS的不良预后因素,获得满意减瘤手术是患者PFS和OS的保护性预后因素。多因素分析显示,原发灶超出子宫体是患者PFS的不良预后因素,腹水细胞学阳性、原发灶超出子宫体是患者OS的不良预后因素。综合OS和PFS的单因素和多因素分析,原发灶超出子宫体这一因素是两组患者生存的独立不良预后因素。
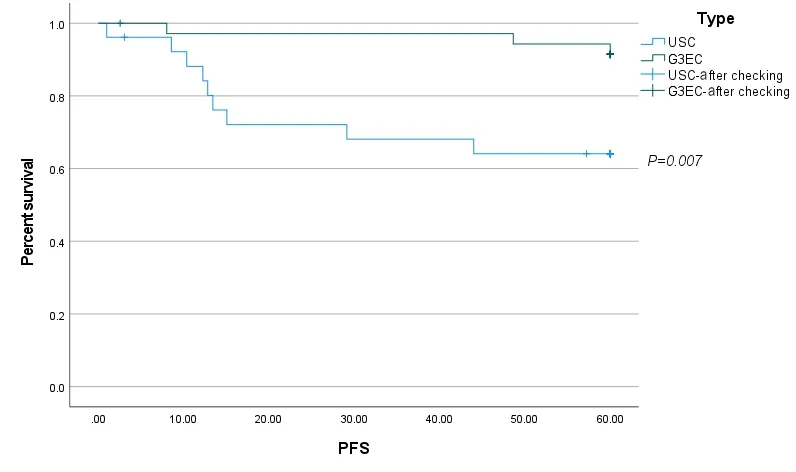
图1 PFS的Kaplan-Meier生存曲线Figure 1.Kaplan-Meier Survival Curves of Progression-Free Survival
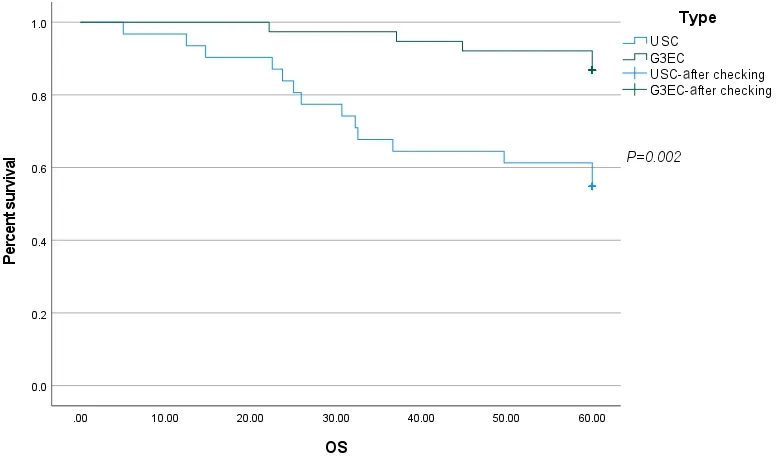
图2 OS的Kaplan-Meier生存曲线Figure 2.Kaplan-Meier Survival Curves of Overall Survival
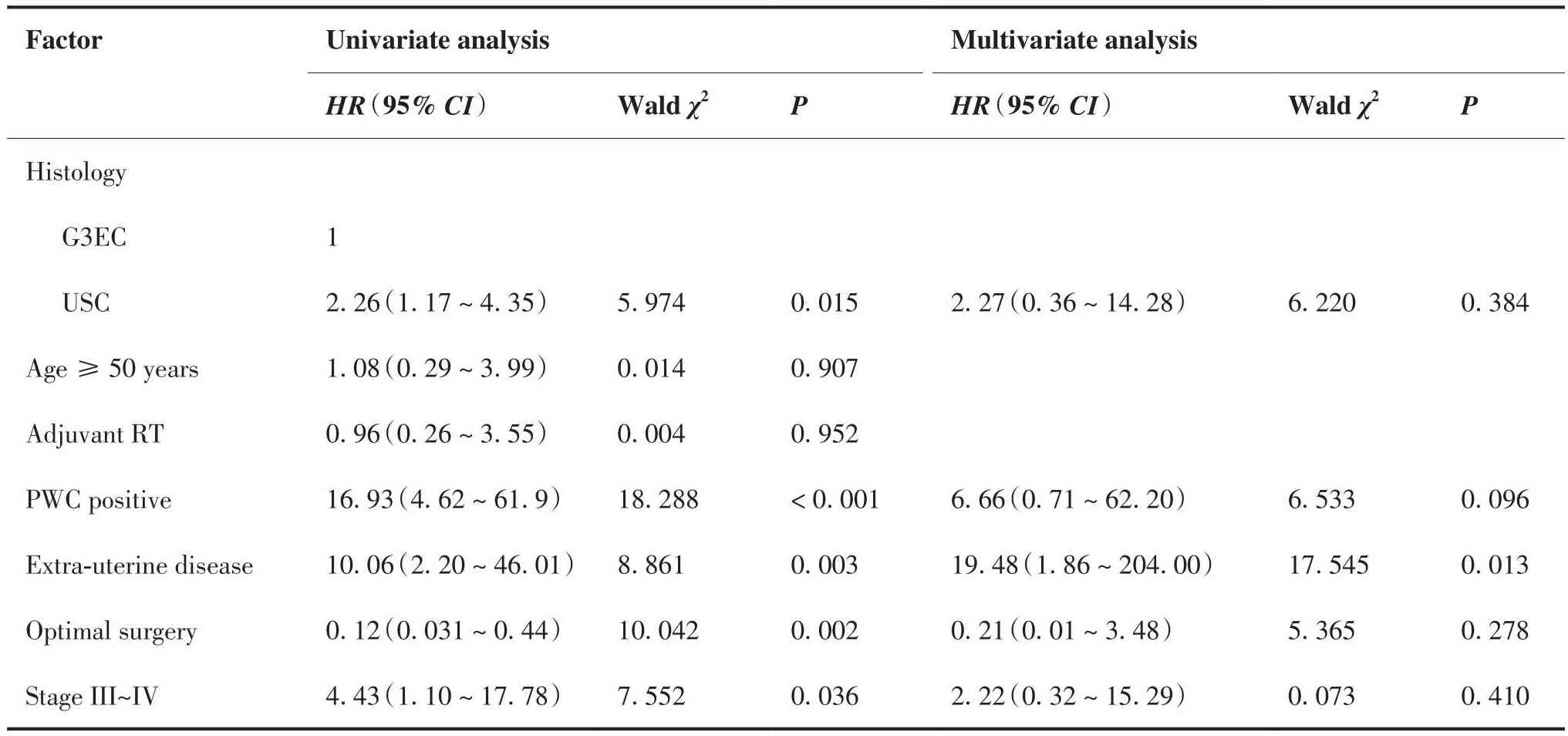
表4 PFS的单因素及多因素COX回归分析Table 4.Univariate and Multivariate COX Regression Analysis of Factors Affecting PFS
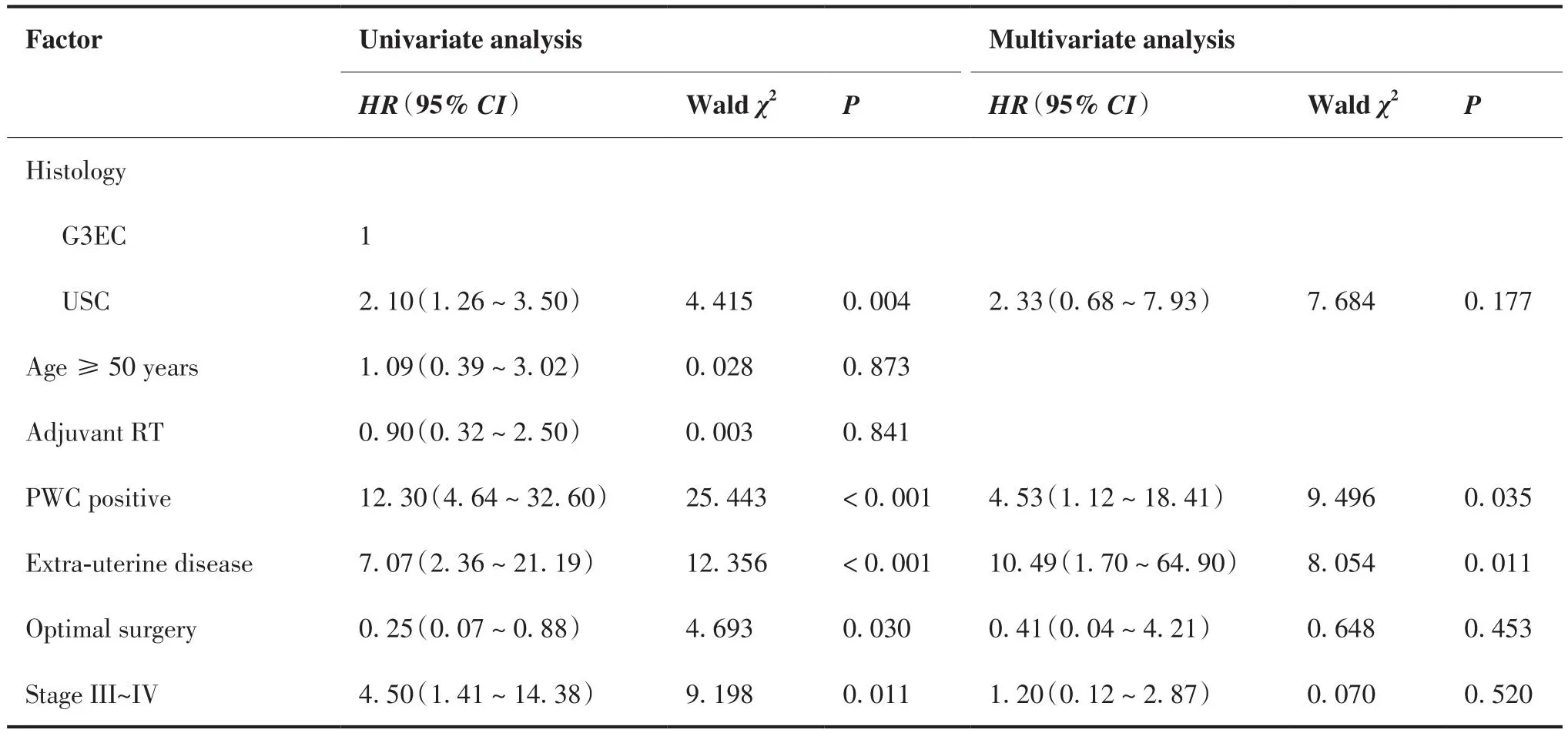
表5 OS的单因素及多因素COX回归分析Table 5.Univariate and Multivariate COX Regression Analysis of Factors Affecting OS
3 讨 论
目前USC和G3EC仍被归类为II类EC,II类EC通常是高级别EC,其恶性程度高,预后较差,与雌激素刺激没有明确的关联。尽管高级别EC较少见,约占新发EC病例的25%,但此类疾病每年导致近75%的EC患者死亡[7-8]。虽然USC只占EC病例不到10%,但它占肿瘤复发和死亡病例的约50%[11]。国外对USC和G3EC的比较研究开展较早,而国内在这方面的研究尚不多,且主要集中在病理特征、免疫组化方面。本研究通过对31例USC患者和39例G3EC患者的临床病理特征及预后相关因素进行分析,希望为今后USC和G3EC的临床治疗提供思路。
本研究结果显示,USC组患者的PFS与OS较G3EC组患者均显著降低,与Hamilton等[7]、Boruta等[12]、McGunigal等[13]和Cirisano等[14]的发现相似,但与Prueksaritanond等[6]、Soslow等[15]和Alektiar等[16]研究结果不同。其原因可能是Prueksaritanond等和Soslow等先前研究采用旧版分期且随访截止时间多为2年,而Alektiar等则是将早期的USC患者与早期的G3EC患者进行比较,未能发现两组患者PFS或OS的差异。本研究随访截止时间设置为5年供判断远期疗效,且本研究中不同分期的USC和G3EC患者均观察到更多的复发与转移病例。目前USC和G3EC仍一同归类于高级别EC,本研究结果支持USC患者较G3EC患者更易发生远处转移,总体预后更差。
国内学者报道II型EC患者发病年龄平均约为53岁[17-18],本研究中USC组患者的平均发病年龄为(56.7±8.5)岁,G3EC组患者平均发病年龄为(55.0±8.5)岁,与文献报道相似。而肥胖、糖尿病、高血压均可引起内源性雌激素水平持续增高进而导致EC的发生及发展,因此并称为EC三联征。本研究中两组患者BMI指数分布相差不大,且高血压、糖尿病等基础疾病发病率相似,提示在此三项EC发病高危因素的病因相关性方面G3EC和USC差异不大,更支持G3EC归类为II型EC。
单因素分析显示,病理类型为USC、腹腔冲洗液细胞学阳性、原发灶超出子宫体、中晚期肿瘤是影响患者 PFS 及 OS 的不良预后因素,实施满意减瘤手术是影响患者 PFS 及 OS的保护性预后因素,与Carin等[19]与Zhong等[20]的研究结果相似。本研究中多因素分析显示,腹腔冲洗液细胞学阳性与死亡风险增加显著相关;虽然腹水细胞学结果并不参与病理分期,但研究表明它是患者预后不良的因素之一[21-22],USC细胞相比子宫内膜样癌细胞更倾向于以簇状形式脱落[23],且USC与子宫内膜样癌具有不同的分子特征:子宫内膜样癌与肿瘤抑制基因PTEN失活、β-连环蛋白和KRAS基因突变、DNA错配修复缺陷有关,而USC与P53突变、EGFR及HER2NEU过表达有关[24-26],提示在基因层面USC与子宫内膜样癌相比即存在异质性,这可能是USC患者更倾向于发生肿瘤的复发与转移的原因之一,本研究中入组病例地域分散广、时间跨度大,暂未纳入患者基因检测结果,在以后的研究中有待进一步补充研究。
多因素分析显示组织学类型与PFS、OS无显著相关性,提示排除混杂因素后尚有其余因素影响USC、G3EC患者预后。据报道,G3EC患者的OS受到分期、淋巴管腔侵犯和肌层侵犯深度的负面影响,而USC患者中这些变量未被发现是OS的显著预测因子,仅种族因素被发现具有统计学意义[12]。
综合PFS和OS的COX回归多因素分析,原发灶超出子宫体是两组患者PFS和OS的独立不良预后因素,解释可能是肿瘤超出子宫体这一不良预后独立预测因素在临床上代表着肿瘤进展、开始向周围组织浸润或远处转移,进行初始分期手术更难达到R0根治性切除,推测难以达到满意减瘤手术可能是USC患者预后差于G3EC患者的原因之一,结果与Prueksaritanond等[6]的结论一致。但本研究中所有患者初始均行分期手术治疗,两组患者获得满意减瘤手术构成比有差异但不显著,推测原因可能是本研究样本量不足且未纳入实施二次减瘤手术患者, 有待进一步多中心、大样本的研究证明。
本研究存在一定局限性: 本研究为单中心研究,纳入生存分析的群体规模有限,存在选择偏倚;其次,本研究为回顾性研究,可能存在一些回忆偏倚;第三,术后病理分期等基础数据之间的差异可能会影响生存结果。
综上所述,相较于G3EC患者而言,USC患者更易发生远处转移、总体预后更差,其中初始分期手术治疗减瘤不满意与USC患者较差的预后有关,而腹腔冲洗液细胞学阳性及原发灶超出子宫体是USC患者与G3EC患者预后不良的相关因素,临床上对存在相应特征的患者更应引起重视,应当制定合适的初次治疗及辅助治疗方案以期改善预后。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
