山奈酚与肽聚糖联合对HepG2细胞增殖和凋亡的影响*
2023-08-28柯飞燕伍志伟何玉林顾超豪陈根
柯飞燕,伍志伟,何玉林,顾超豪,陈根
835000 新疆 伊犁,伊犁师范大学 生物与地理科学学院(柯飞燕、伍志伟);541199 广西 桂林,桂林医学院 基础医学院(柯飞燕、何玉林、顾超豪、陈根)
肝癌是全球范围内最常见的恶性肿瘤之一,其发病率呈现出明显的上升趋势。据估计,到2025年,我国肝癌的年发病率将超过100万。其中,肝细胞癌(hepatocellular carcinoma,HCC)在中国是最常见的恶性肿瘤,其发病率高达75%以上[1]。目前,肝癌治疗主要采用手术疗法、化疗、放疗、生物治疗等措施。然而,由于肝癌发展迅速,早期症状不明显,HCC通常在晚期被诊断出来,使得这些治疗措施很难开展[2]。因此,探索治疗HCC的新药物已成为目前研究的热点。
枯草芽胞杆菌(Bacillus subtilis)是一种好氧、抗逆性极强的优质益生菌,对维持肠道的微生态平衡具有重要作用[3];肽聚糖(peptidoglycan,PG)是枯草芽胞杆菌细胞壁的主要成分,在体内具有抗肿瘤及免疫赋活等多种功能[4]。罗汉果(Siraitia grosvenorii)是葫芦科多年生藤类植物,是我国首批公布的药食两用材料之一,具有极高的药用价值和营养价值,素有“神仙果”之称[5]。本课题组前期通过网络药理学的方法,探讨罗汉果抑制HCC的有效成分、作用靶点及相关信号通路,发现罗汉果山奈酚(kaempferol,KF)可能通过凋亡途径抑制HCC的增殖。在此基础上,本研究旨在通过罗汉果KF联合枯草芽胞杆菌PG作用于人肝癌HepG2细胞,观察细胞形态、迁移、凋亡以及相关蛋白、mRNA表达情况,探讨二者联合对人肝癌细胞HepG2增殖的抑制效果及分子作用机制。
1 材料与方法
1.1 试验药物
KF(纯度≥97%,批号:520-18-3)、PG(批号:69554)均购自Sigma公司。
1.2 细胞株
人肝癌HepG2细胞株和人正常肝细胞LO2细胞株均为广西肿瘤免疫与微环境调控重点实验室自存。
1.3 试剂
DMEM培养基(批号:812248)购自Gibco公司;0.25%胰酶(批号:T1300)、青链霉素双抗(批号:P1400)均购自北京索莱宝科技有限公司;Annexin V-FITC细胞凋亡检测试剂盒(批号 :556547)购自BD Pharmingen 公司;BCA蛋白浓度测定试剂盒(批号:P0010S)购自上海碧云天生物技术有限公司;AKT1(批号:A17909)、p-Akt(批号:AP1259)Bax(批号:A19684)、Bcl-2(批号:A19693)和β-actin(批号:AC006)兔单克隆抗体及Goat Anti-Rabbit IgG(HRP)二抗(批号:AS014)均购自ABclonal公司;Trizol试剂购自美国Life technologies公司。
1.4 仪器
细胞培养箱(新加坡ESCO有限公司);涡旋震荡仪(海门市其林贝尔仪器制造有限公司);酶标仪(美国BIO-Tek公司);JY系列电子天平(上海方瑞仪器有限公司);PCR基因扩增仪、实时荧光定量PCR仪(美国BIO-RAD公司);超声破碎仪(美国SONICS公司)。
1.5 方法
1.5.1 细胞培养 HepG2在添加10%胎牛血清、1%青霉素和链霉素的DMEM完全培养基里培养,37℃、5% CO2、饱和湿度条件下静置培养。在指数生长期收集细胞,研究其抗肿瘤作用。
1.5.2 MTT实验 将HepG2细胞或LO2细胞以5×103个/mL初始密度接种到96孔板中,每孔0.2 mL;分别加入不同终浓度(0、10、20、40、60、80 μmol/L)KF、(0、10、20、40、60、80 μg/mL)PG及相应的PG + KF组合培养24 h、48 h和72 h。培养至相应时间点后,加入MTT 20 μL,孵育4 h后去除上清液,然后每孔中加200 μL DMSO ,震荡溶解沉淀,酶标仪在490 nm处检测其OD值。
1.5.3 细胞分组及处理 将细胞随机分为对照组(不作处理)、PG组(40 μg/mL)、KF组(40 μmol/L)、联合组(40 μg/mL PG + 40 μmol/L KF)
1.5.4 细胞形态学观察 HepG2按1×105个/mL 初始密度接种于六孔板中,按“1.5.3”处理48 h后,显微镜下观察HepG2细胞形态并拍照。
1.5.5 划痕实验检测HepG2细胞迁移能力 HepG2按4×105个/mL密度接种于六孔板中,过夜贴壁后,用10 μL无菌枪头垂直划线以模拟伤口。然后,用预热的PBS清洗划痕,以去除细胞碎片。洗涤后在含有1%胎牛血清的DMEM中培养细胞。分别于0 h、48 h在光学显微镜下拍摄图像,计算细胞伤口愈合面积。
1.5.6 流式细胞仪检测HepG2细胞凋亡情况 HepG2按1×105个/孔接种于六孔板中,按“1.5.3”处理48 h后,收集细胞,用300 μL Binding Buffer悬浮,5 μL FITC Annexin V和5 μL PI充分混匀;室温避光孵育15 min后,1 h内上机检测细胞,计算细胞凋亡率。
1.5.7 Western blot检测细胞蛋白表达的变化 收集用药物处理48 h后的细胞,经细胞裂解、离心、收集上清液获得总蛋白。用BCA蛋白试剂盒测定其浓度。取相同质量蛋白样品进行电泳,转膜,在5% BCA中室温封闭2 h,4℃下过夜孵育一抗(1∶1 000)。次日室温孵育1 h与其相对应的种属二抗(1∶10 000),按说明书配制发光液进行发光。
1.5.8 qRT-PCR检测相关基因mRNA水平 HepG2细胞按1×105个/孔接种于六孔板中,按“1.5.3”处理48 h后,用Trizol提取细胞总RNA。根据逆转录试剂盒操作将其反转录为cDNA,随后根据说明书上机检测。引物序列见表1。

表1 引物序列Table 1.Primer Sequence
1.6 统计学方法
2 结 果
2.1 PG和KF对HepG2细胞增殖的抑制作用及对LO2细胞毒性的影响
MTT结果显示,不同浓度的KF和PG干预HepG2细胞不同时间的抑制率不同,且具有时间浓度依赖性(图1A、B)。为了检验KF和PG对正常肝细胞LO2是否具有毒害作用,分别进行给药处理24 h、48 h、72 h。实验结果表明二者对正常肝细胞LO2在48 h和72 h存在轻微抑制作用(图1C、D)。用不同浓度PG和KF联合处理HepG2细胞24 h、48 h、72 h检测细胞增殖能力。结果表明(图2),相比对照组,48 h和72 h的细胞增殖能力明显受到抑制,其中40 μg/mL PG、40 μmol/L KF最为显著(P < 0.01)。将40 μg/mL PG、40 μmol/L KF及联合用药组(40 μg/mL PG + 40 μmol/L KF)进行综合分析发现(图1E),联合用药组的抑制效果明显强于单独用药组。因此选取40 μmol/L KF、40 μg/mL PG,联合用药组为40 μg/mL PG + 40 μmol/L KF,时间为48 h进行后续实验。
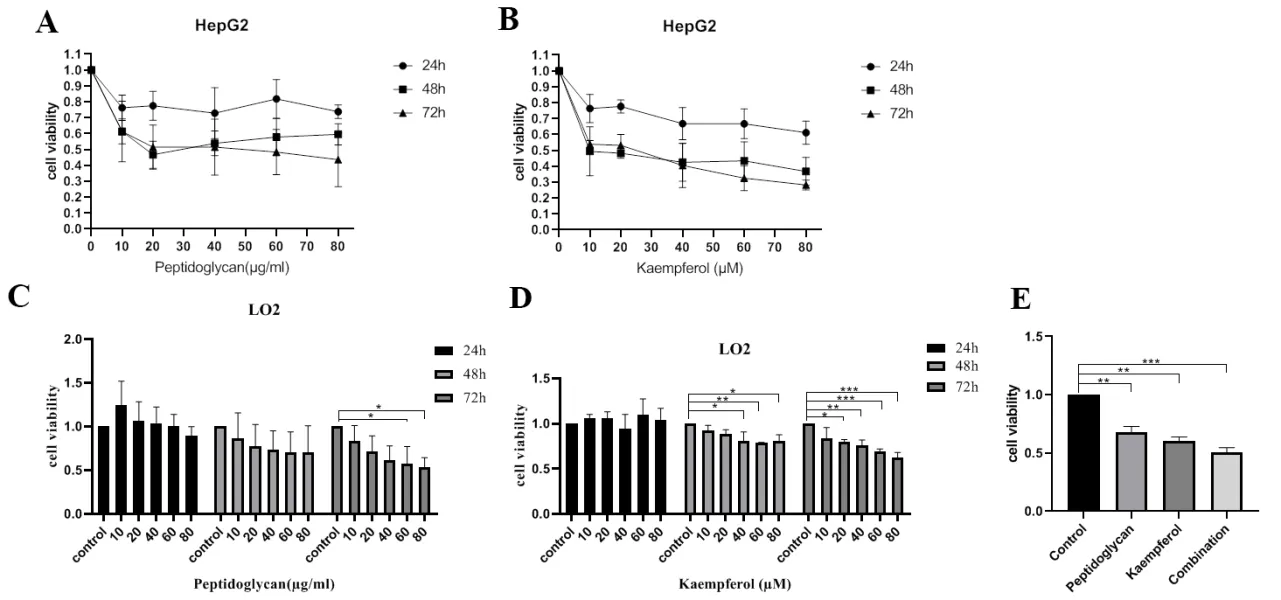
图1 MTT检测PG和KF对HepG2和LO2细胞增殖的影响Figure 1.Effects of Peptidoglycan and Kaempferol on the Proliferation of HepG2 and LO2 Cells
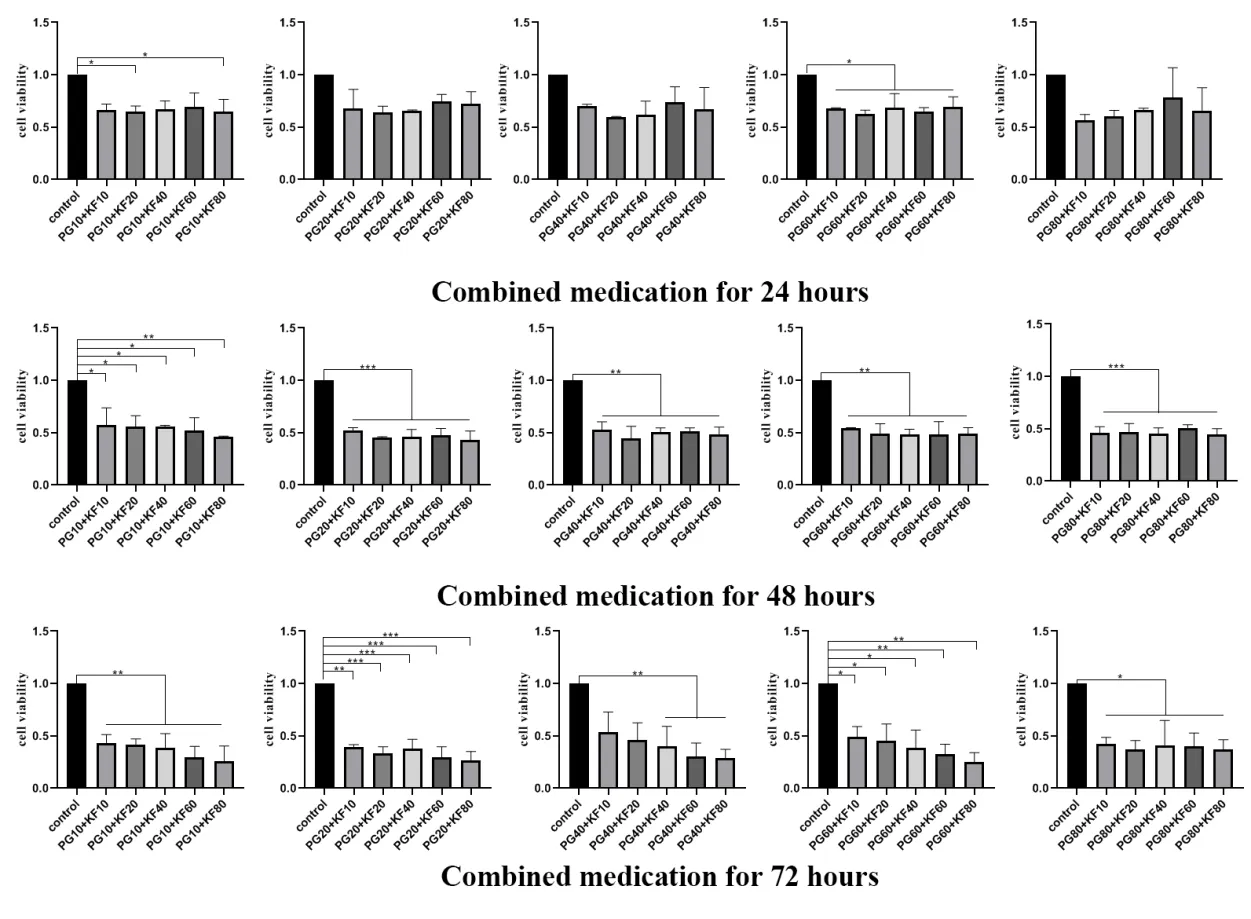
图2 PG和KF联合用药抑制HepG2细胞增殖Figure 2.Inhibition of HepG2 Proliferation by the Combination of Peptidoglycan and Kaempferol
2.2 PG和KF对HepG2细胞形态的影响
镜下观察显示(图3),对照组细胞贴壁良好,形态规则,轮廓清晰,细胞之间的连接较为紧密;PG组虽然部分细胞变圆脱落但总体数量与对照组相比并不显著;KF组细胞密度降低,细胞间联系减少;联合用药组细胞数量明显减少,并伴有较多漂浮死细胞,表明联合用药组对细胞增殖的抑制作用较单独用药显著。
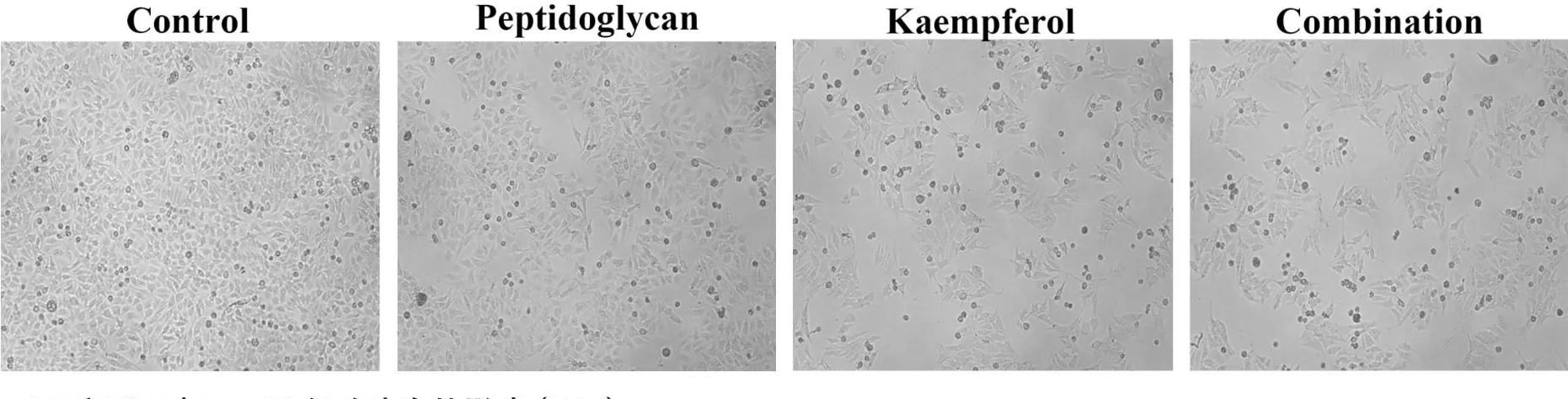
图3 PG和KF对HepG2细胞生存的影响(×10)Figure 3.Effects of Peptidoglycan and Kaempferol on the Survival of HepG2 Cells (×10)
2.3 PG和KF对HepG2细胞迁移能力的影响
与对照组相比(图4),单独应用PG与KF均对HepG2细胞迁移有明显抑制作用;与单独用药组相比,联合用药后,细胞迁移能力显著降低(P<0.05),说明联合用药有效提高药物对HepG2细胞迁移的抑制作用。

图4 PG和KF对HepG2细胞迁移能力的影响(×4)Figure 4.Effects of Peptidoglycan and Kaempferol on the Migration of HepG2 Cells (×4)
2.4 PG和KF对HepG2细胞凋亡的影响
对照组凋亡率为4.64%,PG组凋亡率为15.56%,KF组凋亡率为12.26%,明显高于对照组;联合用药组凋亡率为38.5%,较单独用药组显著增高(P <0.05;图5)。
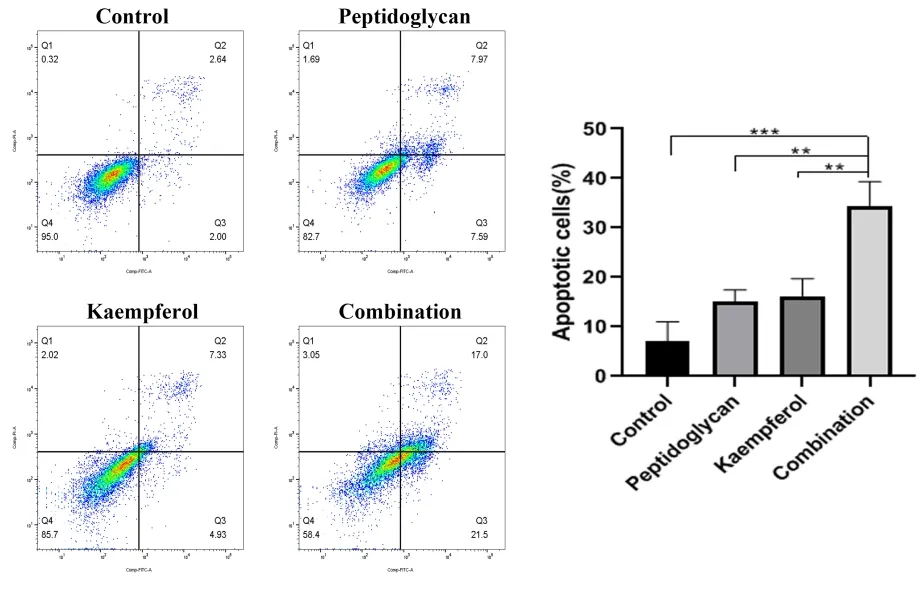
图5 PG和KF对HepG2细胞凋亡率的影响Figure 5.Effects of Peptidoglycan and Kaempferol on the Apoptosis Rate of HepG2 Cells
2.5 PG和KF对HepG2细胞相关蛋白表达的影响
与对照组相比(图6),单独用药组细胞中Bax蛋白相对表达量增加,Bcl-2蛋白相对表达量减少;与单独用药组相比,药物联合处理后,Bax蛋白相对表达量显著提高(P < 0.05),Bcl-2蛋白相对表达量显著降低(P < 0.05),而Akt蛋白在药物处理48 h后基本保持不变,p-Akt蛋白相对表达量下降,说明在HCC中,与单独用药相比,联合用药组可进一步加速细胞的凋亡过程。
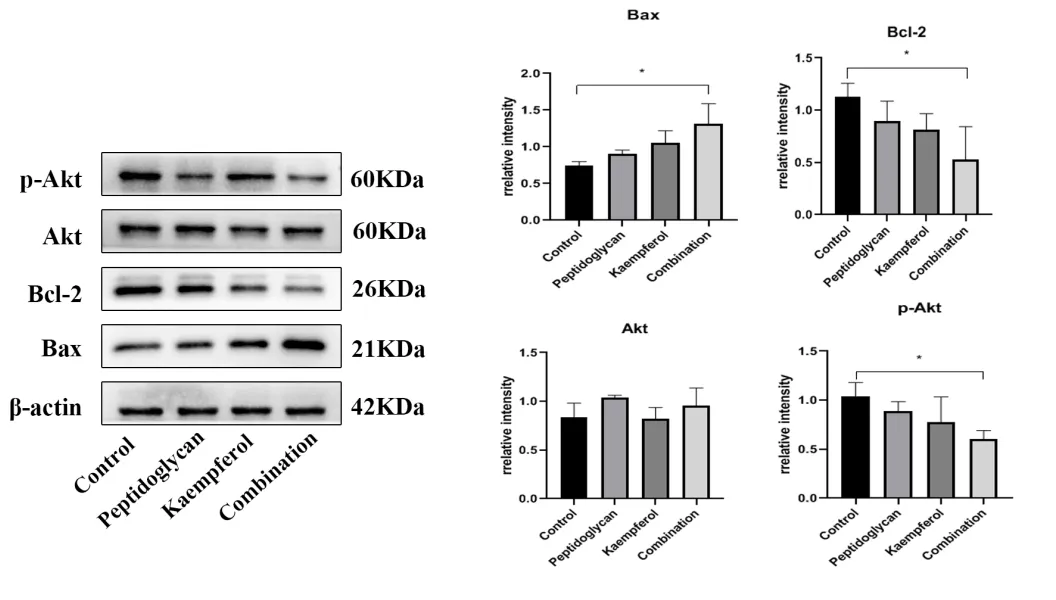
图6 PG和KF作用于HepG2细胞后对相关蛋白表达情况Figure 6.Expression of Related Proteins in HepG2 Cells Treated with Peptidoglycan and Kaempferol
2.6 KF和PG对HepG2细胞中Bax和Bcl-2 mRNA的影响
与对照组相比(图7),单独用药组均可使促凋亡相关分子Bax mRNA水平升高,而使抑凋亡相关分子Bcl-2 mRNA水平降低;与单独用药组相比,联合用药进一步提高了Bax mRNA在HepG2细胞中的水平、降低了Bcl-2 mRNA在细胞中的水平(P < 0.05)。
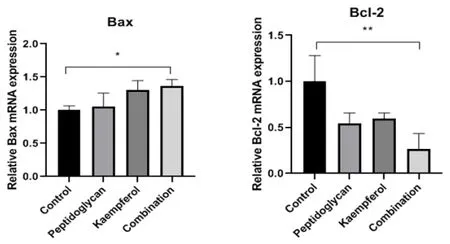
图7 PG和KF对凋亡分子的表达情况Figure 7.Effects of Peptidoglycan and Kaempferol on the Expression of Apoptotic Molecules
3 讨 论
近年来,肿瘤已成为世界上最主要的疾病致死原因之一,也是影响人类平均生活质量的主要因素之一[6]。“一种药物,一个目标,一种疾病”的传统治疗方法已逐渐转变为“多成分、多靶点”的复合疗法,在控制病情发展、改善症状等方面的优势日益凸出[7]。有大量研究表明,中药已逐渐应用于肝癌治疗,在改善肝功能、免疫功能等方面效果显著[8]。
根据《中药志》的记载,罗汉果味甘、性凉,具有清热解毒、润肠通便、润肺止咳等作用,在临床上广泛应用于各种疾病[9]。课题组前期通过网络药理学检索发现KF为罗汉果有效成分之一。KF是一种常见的黄酮类化合物,目前应用于癌症化疗,对肺癌、肝癌、结肠癌、口腔癌、膀胱癌、卵巢癌等有抑制作用[10]。研究表明,KF可通过内质网应激CHOP信号通路来诱导HepG2细胞凋亡[11]。由N-乙酰葡萄糖胺和N-乙酰胞壁酸通过β-1,4糖苷键连接聚合而成的PG是细菌细胞壁的主要成分[12]。大量研究表明,PG可以抑制多种癌细胞的转移、增殖和侵袭。例如,双歧杆菌PG通过抑制上皮间质转化进程[13]、调节VEGF、Ki67等[14]的表达从而诱导结肠癌细胞SW480增殖及迁移,进而发挥抗肿瘤活性。此外,体内研究表明,PG对小鼠免疫功能具有调节作用,其肿瘤体积明显缩小[15-16]。本研究结果显示,较PG、KF单独使用,二者联用能明显抑制HepG2细胞增殖和迁移能力,并提高细胞凋亡率。
细胞凋亡在维持细胞死亡和分裂之间的平衡方面起着至关重要的作用,逃避凋亡会使细胞不受控制地增殖,从而导致不同的疾病,如癌症。凋亡受多个基因调控,Bcl-2家族参与其中。Bcl-2是一个具有抑制凋亡作用的原癌基因,而Bcl-2同系蛋白Bax则具有促凋亡作用。Bcl-2家族成员之间的平衡及相互作用是决定细胞是否生存或凋亡的关键[17-18]。本研究的实验结果表明,与单独使用PG或KF比较,联合用药组的Bax表达水平增加,Bcl-2和p-Akt表达水平降低,提示二者联合能促进HepG2细胞凋亡。
综上所述,细胞实验发现PG与KF两者联合具有抑制HepG2细胞增殖、迁移能力和促进凋亡的作用,其机制可能与调控细胞内Bax、Bcl-2和Akt表达有关。然而,本实验仅仅在体外细胞层面进行了研究,缺乏在动物实验等方面的研究,且肝癌的发病机制较为复杂,二者联合是否可以直接应用于肝癌的临床治疗,还有待进一步研究证实。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
