基于微状态的轻度认知障碍脑电信号特征研究
2023-08-21刘泽达李小俚尹世敏
刘泽达,崔 冬,∗,李小俚,王 磊,尹世敏
(1.燕山大学 信息科学与工程学院,河北 秦皇岛 066004;2.燕山大学 河北省信息传输与信号处理重点实验室,河北 秦皇岛 066004;3.北京师范大学 认知神经科学与学习国家重点实验室, 北京 100875;4.中国人民解放军火箭军特色医学中心 神经内科,北京 100088)
0 引言
轻度认知障碍(Mild Cognitive Impairment,MCI)是指正常衰老和早期痴呆认知变化之间的过渡状态[1-2]。MCI 患者的显著特征为认知以及执行功能存在一定程度下降,例如不符合年龄规律的记忆力衰退,但依旧拥有进行日常基本生活的能力,65 岁及以上老人约有20%患有MCI,与同年龄和性别相匹配的老年人群相比,MCI 患者发展成阿尔茨海默症(Alzheimer Disease, AD)的转换率要高几十倍,确诊后一年内约10%~30%转化为痴呆,其中绝大多数转化为AD[3-4]。因此,研究MCI的发病机制,为MCI 的临床诊断提供有效的客观指标,具有重要科学价值和临床意义。
Lehmann 等人最早提出了多通道静息态EEG信号的α 频段(8~13 Hz)可以解析为有限数量的不同准稳态,称为“微状态”[5]。通过聚类方法,微状态分析将脑电地形图解析为几类最主要的微状态原型,进一步表达脑电时间序列的时空特征[6]。近几年,微状态分析已经开始应用于分析MCI[7]、AD[8]、精神分裂症[9]以及自闭症[10]等多种脑功能疾病,在这些患者中EEG 微状态均有显著性的变化。由于空间地形可以定义于任意时间点,独立于之前或后续的地形,具有毫秒级分辨率,因此微状态更适合检测大规模神经认知网络中的快速动态活动,在一定程度上弥补了EEG 在空间分辨率和分析大规模脑网络异常方面的不足[11]。
本文利用脑电微状态分析,研究与对照组相比,轻度认知障碍患者中是否存在特定的微状态变化。将EEG 数据每个时刻处的脑电地形图根据空间相似度指标,聚类得到4 个最具代表性的微状态原型地图,通过此微状态原型重新表达脑电时间序列特征,统计分析了MCI 组和健康对照组在平均持续时间、平均发生频率、覆盖率以及转移概率4 个时间参数上的差异,利用皮尔森相关分析探究了这些时间参数与神经心理学量表得分之间的关联,利用样本熵算法计算了两组微状态序列的复杂性,最后对两组微状态序列做了随机化测试及马氏性检验,探究微状态间的转换特点。
1 方法
1.1 受试者和诊断标准
本文被试来自于中国人民解放军火箭军特色医疗中心神经内科。所有的受试人员具有一定视觉和听觉分辨力,可以独立完成神经心理学检测内容,包括简易智力状态检查量表(Mini-Mental State Examination, MMSE)、蒙特利尔认知评估(Montreal Cognitive Assessment, MoCA)、听觉言语学习测验(Auditory Verbal Learning Test, AVLT)的即刻回忆AVLT1、30 min 延迟回忆AVLT2、长时延迟再认AVLT3、Boston 命名测试、语言流畅性测试、轨迹测试A 和B 以及数字广度测验和日常生活量表(Frequently Asked Questions, FAQ)。并排除了:1)具有额叶痴呆,锥体外系病变,脑外伤,脑肿瘤,癫痫,神经性衰退性疾病等;2)严重酗酒和抑郁症患者;3)存在临床大血管并发症(如心绞痛、心肌梗死病史、有临床症状的脑梗死及外周血管栓塞);4)入组前1 个月内使用过具有镇静、催眠效果的药物及影响中枢神经系统的药物。将所有受试者按照划分标准进行分类[12],分为MCI 组15 人(男性6 名,女性9 名)和认知功能正常的对照组10 人(男性6 名,女性4 名)。
使用SPSS 26.0 软件对MCI 组和对照组神经心理学量表测试得分与人口特征数据进行独立样本T检验分析,以均值±标准差的方式呈现结果,如表1 所示,∗表示p<0.05,∗∗表示p<0.01,∗∗∗表示p<0.001,p<0.05 认为存在统计学意义的显著差异。

表1 神经心理学量表得分Tab.1 Table of neuropsychological scale score
结果显示人口统计学数据在两组之间没有显著差异。所有受试者在年龄、性别和教育水平方面均匹配。神经心理学测试显示MCI 组和对照组的MoCA 分数和AVLT2 分数具有显著差异性(p<0.05),表明MCI 组在认知功能尤其是记忆功能方面有显著的损伤。而在MMSE 分数、AVLT1、AVLT3、Boston 命名测试、语言流畅性测试、轨迹测试、数字广度测验、FAQ 等方面两组之间没有出现明显的差别。
1.2 数据采集和预处理
脑电信号采用EGI 的GES300 型128 通道脑电记录仪记录,试者处于闭眼静息状态进行静息EEG 数据采集,以双侧乳突为参考电极,阻抗小于10 kΩ,采样频率1 000 Hz,时长 5 min。使用EEGLAB 对数据做预处理,包括通过凹陷滤波去除50 Hz 工频干扰;进行1~30 Hz 的带通滤波消除低频漂移和高频噪声;平均重参考电极。
1.3 微状态分析
首先计算全局场功率(Global Field Power,GFP)来表示大脑电场的瞬时强度[5],公式如下:
其中,Vi(t)为第i路电极信号强度,K为电极数目,Vmean为多路信号强度的平均值。
脑电地形图在GFP 峰值附近信噪比最高且最稳定[13],因此选取GFP 峰值即局部极大值处所对应的脑电数据作为时间样本点。设置最小峰距为10 ms,以便更好地区分相邻峰值;每个受试者进入分割的GFP 峰值数量为1 000,保证聚类结果能够收敛的前提下,使用较少的样本减少计算量;剔除超过GFP 标准差1 倍的峰值,防止极端GFP 处的高振幅非神经源伪影带来的不利影响。通过k均值聚类算法,预设4 种微观状态,随机初始化的次数为50,最大迭代次数为1 000,收敛阈值设为10-6。以空间相似性为指标,全部样本地图分成4个类群,对群内所有样本地图取平均,得到4 种典型的微状态地图,即A、B、C、D 四个状态。把每个被试的所有脑电地形图,依旧根据空间相似性指标替换成与其最相似的微状态原型地图,得到A、B、C、D 四个原型交替出现的微状态时间序列。为了避免噪声短段以及极性变化所带来的虚假影响,去除长度小于30 ms 的微状态片段。
1.4 微状态时间参数统计分析
提取MCI 组和对照组微状态的四类时间参数: 1)平均持续时间:各微状态出现并保持短暂稳定的平均时间长度;2)平均发生频率:各微状态在记录期间内每秒发生的平均次数;3)覆盖率:各个微状态存在于总的时间中所占的比例;4)转移率:各个微状态之间的转换概率。
利用独立样本T检验统计分析MCI 组和对照组的微状态在平均持续时间、平均发生频率、覆盖率和转移率之间是否具有显著性差异。利用皮尔森相关分析探究神经心理学量表得分与微状态时间参数之间的相关性差异。
1.5 微状态序列复杂性分析
利用样本熵算法对两组被试微状态时间序列的复杂性进行分析。研究两组微状态序列的熵值大小随嵌入维数m的变化趋势,其中,嵌入维数m设为1 到11,阈值r设为0.2 倍的标准差。
1.6 微状态转换结构与依赖性分析
为了探究微状态序列中是否存在某特定转移结构以及各状态间是否具有依赖性,分别对两组微状态的转移概率进行了随机化测试和马氏性检验。
随机化测试先假设从一个微状态到下一个微状态的转换是随机发生的,观测转移概率将与微状态的相对发生率成比例,可从微状态序列提取了观测转移概率,又基于各微状态的相对发生率计算出预期转移概率,并使用二者的卡方距离D0来评估差异,将观测转移概率和预期转移概率随机进行5 000 次重新分配,得到5 000 个卡方距离的经验分布,若大于D0的有q个,则估计的h值为q/5 000,当h<0.05 时拒绝原假设。
马氏性指给定一个过程的当前状态和历史的所有状态,其未来状态仅与当前状态有关,而与历史状态无关。检验过程中的卡方统计量为,其中s是状态类别数,fij表示状态i经过一步转移到达状态j的频数,Pij表示i到j的转移概率,P·j为边缘概率,自由度为(s-1)2,现给定显著性水平为α=0.05,经查表可得的值,若,可认为微状态序列具备马氏性,反之,则不具备马氏性。
2 结果
MCI 组和对照组的A、B、C、D 四个微状态原型地图如图1 所示。不同颜色及颜色深浅代表采集电极所记录的电压正负及其大小。在地形结构上,A 类微状态地形图的特点为右前-左后;B 类微状态地形图为左前-右后;C 类微状态地形图为前-后;D 类微状态地形图为前-中末。四种微状态原型图彼此之间有很大区别,在以往的研究中具有高度的可重复性。
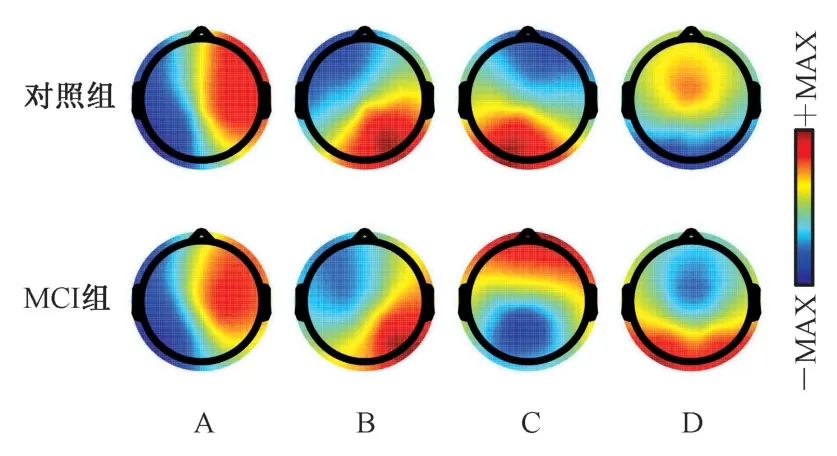
图1 MCI 组和对照组微状态原型地图Fig.1 Map of microstate prototype of MCI group and control group
2.1 时间参数分析结果
微状态时间参数的统计分析结果如表2 所示,表中包含了MCI 组与对照组两组微状态的平均持续时间、发生频率和覆盖率,并以均值±标准差的方式呈现,可以看出,MCI 组微状态A、B 和C的平均持续时间小于对照组,其中微状态A 具有显著差异;而MCI 组微状态D 的平均持续时间高于对照组,但没有显著差异。MCI 组微状态A 和D 的发生频率增高,B 和C 的发生频率降低,均未有显著差异。MCI 组微状态A、B 和C 的覆盖率降低,微状态D 的覆盖率增高,也均未有显著差异。

表2 持续时间、发生频率以及覆盖率统计分析Tab.2 Table of statistical analysis of duration,occurrence and coverage
表3 为MCI 组与对照组的微状态转移概率统计分析结果,可以看出,MCI 组微状态A、B 和C 转移到D 的概率、C 和D 转移到A 的概率以及D 到B 的转移概率增高,其中A→D 和B→D 的转移概率具有显著差异。MCI 组微状态A、B 和D 转移到C 的概率、A 和C 转移到B 的概率以及B 到A的转移概率降低,但尚未具有显著性。

表3 转移概率统计分析Tab.3 Table of statistical analysis of transfer probability
2.2 相关性分析结果
图2 是微状态时间参数与神经心理学量表得分之间的显著性相关图。结果显示,微状态A 的持续时间与AVLT2 得分成显著性正相关。该结果表明微状态的持续时间与神经心理学存在着一定关联,认知障碍程度越大,微状态A 的持续时间则越短。

图2 神经心理学量表得分与微状态时间参数相关性Fig.2 Correlation between neuropsychological scale score and microstate time parameters
2.3 复杂性分析结果
图3 是两组微状态序列的样本熵值随嵌入维数m的变化趋势图,实线表示MCI 组样本熵的均值,虚线表示对照组样本熵的均值,图中的阴影部分表示标准差。MCI 组在不同嵌入维数下的熵值都高于对照组,说明MCI 组微状态序列的复杂度要高于对照组,MCI 患者在处理认知相关的任务时可能需要调用更多的认知资源。对照组中,样本熵值随着嵌入维数m的增加而降低,表明微状态的转换序列在多个转换中是自相似的;而在MCI 组中,样本熵值没有随着嵌入维数的增加而降低,微状态序列缺乏自相似性。样本熵的计算使我们能够量化微状态转变的可预测性。随着嵌入维数m的增加,微状态序列的样本熵在对照组中减少,但在MCI 患者中没有,这表明来自对照组被试的EEG 数据比来自患者的数据更加可预测。

图3 样本熵随嵌入维数变化图Fig.3 Change of sample entropy with the increase of embedding dimension
2.4 转换结构与依赖性分析结果
随机化测试得出对照组的h值为0.998 6,MCI 组的h值为0.985 0。即接受原假设,微状态序列中不同状态的转换是较为随机的,尚未发现某种特定转移结构存在。
3 讨论
本文对MCI 患者与对照组相比,是否存在特定的微状态变化进行了分析,证实了MCI 患者和对照组在微状态A 的平均持续时间以及A→D、B→D 的转移概率上具有显著性差异;并报告了神经心理学量表得分与微状态时间参数之间的相关性,得知微状态A 的持续时间与AVLT2 得分成显著性正相关;探究了两组微状态序列的复杂度差异,发现MCI 患者的微状态序列复杂度更高,序列缺乏自相似性;最后检验出在状态转换过程中不存在特定转移结构。
大多数先前的研究发现,AD 患者的所有微状态持续时间较短[14-15],然而,这些早期的研究使用了自适应分割算法,并没有将微观状态分组到特定的类别,这可能解释了与后来的研究结果之间的一些差异。在后来的研究中,Musaeus 发现与对照组相比,AD 和MCI 患者中微观状态A 的影响最大,A 的发生率和覆盖率显著高于对照组,随后Musaeus 又扩大了被试数量,发现持续时间、发生率和覆盖率在微状态A 和B 上有所增加,在C 和D 上减少,但只有在微状态A 上具有显著性差异,并发现更易从其他状态转移到A 状态[7,16]。本研究中,MCI 组在微状态A 的持续时间显著缩短,A→D 和B→D 的转移概率显著增加。然而,在Nishida 的研究中,没有发现AD 患者和对照组之间有任何显著差异[17],同样,在Lian 的研究中,没有发现MCI 患者与对照组之间有显著差异,但Lian 发现AD 患者微状态B 的持续时间和覆盖率显著增加,C 的覆盖率显著降低,且A→B 的转换增加[18]。Lin 则是发现AD 患者B 的持续时间增加,C 的发生率降低[19]。有关MCI 与AD 患者的脑电微状态分析,不同文献的研究结果有出入,可能是由于样本量的大小不同,样本数据采集和预处理的过程有差别,或者患者接受药物治疗的比例不一样等原因,但以上研究都表明了MCI 和AD患者大规模皮层网络的时间动力学是存在异常的。
然而,关于MCI 和AD 患者的微状态序列复杂性尚未被研究,本研究基于样本熵算法分析微状态序列的复杂度,发现了MCI 患者的微状态序列复杂度更高,而对照组则与Murphy 的结果一致,即序列的复杂度低于患者组,并具有自相似性[20]。随后,在微状态序列转换特点研究中,使用Lehmann 等人提出的一种非参数随机化测试方法,Lehmann 发现了精神分裂症患者的微状态转换过程中存在着A→D→C→A 特殊结构[21],基于此方法,Nishida 等人指出AD 患者表现出随机性的转换模式[17];Musaeus 也在2019 和2020 年两次研究中证明,MCI 和AD 患者的微状态转换过程中不存在特殊结构[7,16];相反,Schumacher 等人发现了AD 的非随机转变,并作出了胆碱酯酶抑制剂改变患者静息状态脑电图特征的解释[22]。然而,对于MCI 和AD 患者的微观状态转变是否是随机的,目前的研究并没有得出一致的结论,在本研究中,MCI 患者的微状态转变是较为随机的,转换过程中并未出现特殊结构。由于目前尚未有关于MCI 或AD 患者微状态间的依赖性分析,本文以离散序列的马氏性检验为数学背景,验证了未来的状态与过去的状态互相独立,不具有依赖性。
本文具有一定的局限性:此次进行脑电信号微状态分析的只有25 人,分析人数尚少;目前四类脑电微状态所代表的功能意义还不够明确,也需要进一步的探究。希望在未来的工作中,能实现大规模的数据采集实验增加样本量,让结论更加具有普遍性。此外,不一定只局限于由脑电地形分布特征进行微状态的划分,例如研究脑功能连接网络在时域上的动态变化,按照相似性将时域窗口进行聚类,根据时域上脑网络微状态去探究MCI 患者的特征。
4 结论
本文对MCI 患者和对照组进行了脑电信号的微状态分析,利用聚类算法得到了4 种典型微状态,利用独立样本T检验对微状态时间参数进行了统计分析,并分析了神经心理学量表与这些参数之间的相关性以及两组微状态序列的复杂性,随后对两组序列进行了随机化测试及马氏性检验以此来判断微状态的转换间是否存在特殊结构。研究结果表明,脑电信号微状态分析可以用来探究轻度认知障碍疾病,MCI 患者和对照组在微状态A 的平均持续时间以及A→D、B→D 的转移概率上具有显著性差异,微状态A 的持续时间与AVLT2 得分成显著性正相关,MCI 组的微状态序列复杂性要高于对照组。而随机化测试及马氏性检验结果说明,微状态序列的状态转换过程中尚未发现某种特殊结构,且未来时刻的状态与过去无关。
