闭锁连接蛋白-1 核酸适配体的筛选与初步应用
2023-08-21李玉娟张瀚文刘珊王佳平李勇枝
李玉娟,张瀚文,刘珊,王佳平,李勇枝
(1.北京理工大学 生命学院,北京 100081;2.中国航天员科研训练中心航天员健康中心重点实验室,北京 100094)
肠上皮屏障对维持机体内环境稳态、防护人体健康具有重要作用.肠上皮细胞间的连接是肠上皮屏障的重要构成[1],主要包括紧密连接、黏附连接、桥粒、缝隙连接等[2].其中,紧密连接主要是由闭锁连接蛋白-1(Zonula Occludens-1,ZO-1)、闭合蛋白(Claudins)、咬合蛋白(Occludin,OCN)等一系列跨膜蛋白构成的蛋白复合体.ZO-1 作为紧密连接蛋白复合体中的一种重要蛋白,可以与OCN、Claudins、α-连环蛋白等进行相互作用,调节肠上皮细胞旁路的渗透性直接保护肠屏障[3−4].ZO-1 可将紧密连接与构成肠上皮细胞骨架的肌动蛋白相连,参与调节肠上皮细胞内肌动蛋白丝的收缩,进而维持肠上皮屏障的低渗透性[5−6].ZO-1 蛋白还可以招募并高度富集紧密连接相关蛋白(如,带蛋白Cingulin)到其相应位点,从而维持紧密连接有助于保护肠屏障的完整性[7−8].ZO-1 能够直接与细胞转录因子(如ZO-1 相关核酸结合蛋白、转录共激活因子相关蛋白等)进行相互作用[9],调控肠上皮细胞的生长、增殖[10],以及胞内信号传导(如:Wnt/β-catenin 信号通路)而有助于肠黏膜修复[10−11],以保护肠黏膜屏障的正常功能.综上所述,ZO-1 蛋白在维持肠上皮屏障的完整性中具有关键作用.
目前,检测ZO-1 的常用方法为免疫荧光法(immunofluorescence,IF)、蛋白质印迹法(western blot,WB),这两种方法均使用了ZO-1 抗体.但抗体的成本相对较高、稳定性较差、且不易运输与保存,因此也需要开发一种成本较低、稳定性较高、特异性强的新型工具分子,实现生物样本中ZO-1 的检测.核酸适配体(aptamer,APT)是近年来新兴热点识别分子,是一种序列较短的、与配体具有高特异性与高亲和力的单链核苷酸(DNA 或RNA),其易于化学合成且成本较低、化学性质稳定[12],已被广泛运用于生物成像、目标物分析检测[13]、药物递送[14−15]等领域.目前,尚未见ZO-1 核酸适配体(APTZO-1)的筛选及其应用.文中以ZO-1 为筛选靶标,采用配体指数富集系统进化(systematic evolution of ligands by exponential enrichment,SELEX)技术,筛选APTZO-1并获得其序列,进一步考察APTZO-1对ZO-1 的亲和力与特异性.将与ZO-1 的亲和力最强的APTZO-1进行荧光标记,在人结直肠腺癌细胞(Caco-2)、人脑微管内皮细胞(hCMEC/D3)两种细胞系上的ZO-1 进行初步定位与半定量分析应用研究,并与传统抗体法进行了比较.本研究有望为生物样本中ZO-1 的定性、定量检测提供一种新型的、亲和力高及特异性强的工具分子.
1 材料与方法
1.1 实验仪器与材料
1.1.1 实验材料
甲苯磺酰基磁珠(TMB)、链霉亲和素磁珠(SMB)(Dynal,Norway);寡核苷酸(ssDNA)随机文库、上游与下游引物及生物素修饰的上下游引物(上海生工生物工程有限公司);pEASY-T1 细胞克隆试剂盒(北京全式金生物技术有限公司);柱式纯化试剂盒(TaKaRa 公司);ZO-1(Cloud-Clone Corp 公司);氯化钾、氯化钠、氢氧化钠(北京化学试剂公司);辣根过氧化物酶标记链霉亲和素(streptavidin-HRP)、TMB显色液与终止液(碧云天生物技术研究所)等.
用于SELEX 筛选的ssDNA 文库大小为81 nt,两端各有18 nt 的固定序列,中间为45 nt 的随机序列(5′-3′序列为ATCCAGAGTGACGCAGCA-N45-TGGACACGGTGGCTTAGT),由上海生工生物工程技术服务有限公司合成.PCR 引物使用Primer Design 软件设计,由上海生工生物工程技术服务有限公司合成,具体设计见表1.

表1 PCR 引物设计Tab.1 The design of PCR primers
1.1.2 实验仪器
磁力器(Dynal,Norway);Maltiskon Mk3 酶标仪(美国 Thermo 公司);紫外凝胶成像系统(北京赛智创业科技有限公司);紫外可见分光光度计(Shimadzu,Japan);PCR 仪(R232,MJ Research 公司);超分辨显微成像系统(N-SIM E,NiKon)等.
1.2 核酸适配体的筛选
1.2.1 初级文库的制备与筛选
为进一步筛选初级文库,需制备TMB-ZO-1 复合体.取TMB 并用Buffer B(2.96 g NaH2PO4·H2O、29.01 g Na2HPO4·12H2O、1 L ddH2O,pH=7.4)清洗两次,用磁力器收集后加入Buffer B 重悬.加入目标蛋白溶液与Buffer C(39.64 g 硫酸铵、1 L Buffer B),于室温旋转过夜孵育.收集磁珠,加入 Buffer D(100 mL 0.01 M PBS、0.88 g NaCl),于室温旋转孵育2 h.收集磁珠并用Buffer E(10 mL 0.01 M PBS、0.88 g NaCl、0.05%Tween 20)清洗两次,最终用Buffer E 重悬.各实验材料用量如表2.

表2 TMB-蛋白复合体的制备Tab.2 Preparation of TMB-protein complex
将1 OD ssDNA 文库溶于240 μL Buffer E,与75 μL重悬后的磁珠-蛋白复合体混合,于常温孵育2 h,进行第1 轮筛选.孵育后,使用Buffer D 清洗磁珠3 次,用50 μL TE 缓 冲 液(10 mmol/L Tris-HCl、1 mmol/L EDTA,pH=8.0)重悬磁珠,于95 °C 加热15 min,磁分离2 min,收集上清.
1.2.2 初级文库的扩增与鉴定
对筛选得到的ssDNA 进行扩增,需使用P1 与P4引物.同时,设置阴性对照扩增.PCR 反应体系为:1.5 μL 模板、2 μL P1、2 μL P4、19.5 μL ddH2O、25 μL GoTaq® Master Mix.扩增后进行鉴定,Marker 与PCR产物的上样量均为4 μL,110 V 恒压电泳45 min.
1.2.3 次级文库的制备与筛选
上一轮筛选到的ssDNA 经扩增、纯化后,需制备成单链以用于下一轮筛选.根据SMB 推荐固载量,取适量体积的SMB 磁珠,用1×B&W buffer(10 mmol/L Tris-HCl、1 mmol/L EDTA、2 mol/L NaCl)清洗3 遍后,加 入200 μL PBS 重 悬,与 纯 化 后 的dsDNA 混 合,于室温旋转孵育30 min.孵育后,磁分离以弃去上清,用Buffer E 清洗3 遍,加入200 μL 100 mmol/L NaOH溶液进行碱变性15 min.加入40 μL 1 mol/L NaH2PO4(pH=3.9)终止反应,于磁力器上静置,上清液即为次级库.次级库与TMB-蛋白复合体孵育进行下一轮筛选,第1~10 轮的筛选操作同2.2.1.其中,第1~6 轮的孵育时间为2 h,第7~10 轮孵育1 h.
1.2.4 文库的反筛
每经过3 轮正筛选,需进行一次反筛选.反筛的目的是去除文库中与磁珠本身结合的ssDNA.在第4轮与第7 轮筛选结束后,将ssDNA 文库与75 μL 重悬后的空磁珠混合,于室温旋转孵育2 h,经磁分离后收集上清液,再分别进入第5、第8 轮筛选.
1.2.5 相对亲和力测定
通过酶联免疫吸附(ELISA)方法直接测定每轮文库与ZO-1 的相对亲和力,以监测筛选进程.使用P2、P3 引物对筛选中得到的DNA 文库进行扩增,经纯化后用微量酶标板定量与浓度均一化(>25 nmol/L),并于95 °C 加热20 min,立即置于冰上20 min,以打开双链.
进行ELISA 时设置空白组、靶蛋白(ZO-1)组以及对照蛋白(卵清蛋白)组,蛋白浓度均为5 μg/mL.每孔加入100 μL 蛋白溶液包被,于4 °C 过 夜孵 育.倒空液体,每孔用300 μL PBST 清洗2 次后,每孔加入300 μL 的BSA 封闭液,于4 °C 封闭1 h.清洗2 次后,每孔依次加入各轮生物素标记的ssDNA 文库溶液进行孵育,于37 °C 孵育1 h.清洗3次后,每孔加入100 μL 的Streptavidin-HRP,于37 °C 孵 育1 h.清洗3 次,第3 次清洗时浸泡5 min,再清洗2 次后,每孔加入100 μL TMB 显色液,避光反应15-30 min,待颜色稳定后,加入50 μL 终止液,于酶标仪450 nm 测定吸光值.对“筛选轮数-吸光度”进行数据分析,通过观察每轮筛选的吸光值变化趋势,决定是否终止筛选.
1.2.6 克隆与测序
将第10 轮筛选到的ssDNA,使用P1、P2 引物进行扩增,产物经电泳表征并纯化,将1.6 ng 产物与1 μL pEASY-T1 Simple Cloning Vector(片段与载体的最佳摩尔比为1∶7),总体积补至5 μL,于室温反应10 min.取5 μL 连接产物加入50 μL DH5α 感受态细胞,混匀后冰浴30 min,42 °C 水浴热激30 s 后立即置于冰上2 min,加入500 μL 液体LB 培养基,于37 °C、200 r/min 孵育1 h.涂布平板后,于37 °C 过夜培养.使用菌落PCR 法鉴定阳性克隆,随机挑取白色克隆至10 μL 无菌水中,混匀后取1 μL 至PCR 体系中,M13上游与下游引物均为 1 μL、22 μL ddH2O、25 μL GoTaq®定量PCR 预混液.
过夜培养后观察菌落情况,随机挑取单菌落置于5 mL LB 培养基继续培养,送至生工生物工程有限公司进行测序.取第10 轮次级文库扩增后样品,经PCR 柱式纯化试剂盒纯化回收,由生工生物工程有限公司进行高通量测序,并使用UNAFold 网站(http://www.unafold.org/)在线预测APTZO-1的二级结构.
1.3 APTZO-1 与ZO-1 的亲和力测定
筛选到的APTZO-1由上海生工生物工程技术服务有限公司合成,采用生物素修饰.ELISA 测定步骤同2.2.5,设置空白组与ZO-1 组,均设置3 组平行.其中,将APTZO-1配制成2.500、1.250、0.625、0.400、0.200、0.100、0.050、0.025 μmol/L 的溶液进行孵育.测定吸光值后,使用SigmaPlot 14.0(SYSTAT 公司)处理数据,按Y=BmaxX/(Kd+X)公式,以APTZO-1浓度为X、吸光值为Y,进行非线性拟合,可得到APTZO-1结合ZO-1 的解离常数Kd.此外,选择Kd值最小的APTZO-1(625 nmol/L)再次进行ELISA 测定,以检验APTZO-1对ZO-1 的特异性,设置牛血清白蛋白(BSA)、卵清蛋白作为非靶标蛋白(5 μg/mL),其他步骤同2.2.5.
1.4 基于荧光标记APTZO-1 对细胞上ZO-1 进行定位观察
使用Cy5 荧光基团标记与ZO-1 亲和力最强的APTZO-1(Cy5-APTZO-1),对Caco-2 细 胞 与hCMEC/D3细胞中的ZO-1 进行荧光定位分析.同时,采用81 np的随机序列核酸作为非特异性APT 进行染色,设置为阴性对照组.将两种细胞系分别接种在激光共聚焦培养皿上培养,使用4% 多聚甲醛溶液固定,用PBS 清洗5 min,重复3 次.使用0.5% Triton X-100 通透后,清洗3 次,用3% BSA 溶液封闭1 h.按1:400 稀释Cy5-APTZO-1与非特异性APT 原液,孵育2 h 后清洗,各孔加入适量DAPI 染液,染色15 min 后清洗3 次,加入适量防淬灭剂.同时使用传统IF 法进行细胞ZO-1 的定位观察,使用ZO-1 抗体于4 °C 过夜孵育,清洗3 次后加入二抗孵育2 h,其余步骤同前.于超分辨显微成像系统下观察,选取视野并保存,最终对比两种方法的结果.
1.5 基于Cy5-APTZO-1 对细胞上ZO-1 进行半定量分析
为考察Cy5-APTZO-1对Caco-2 与hCMEC/D3 两种细胞上ZO-1 的半定量能力,设置对照(CON)组、模拟微重力48 h(SMG)组[16],并与传统IF 法的结果进行对比,测定步骤同2.4.使用Image J(NIH 公司)对ZO-1 的平均荧光强度进行统计,并进行数据分析.此外,采用WB 法对两种细胞系的ZO-1 进行半定量分析,同设置CON 组与SMG 组.步骤如下:制备两种细胞样本后进行SDS-PAGE 凝胶电泳,冰浴转膜90 min,封闭2 h 后使用ZO-1 抗体过夜孵育,洗膜15 min、4 次后加入二抗稀释液于常温孵育2 h,清洗4次后显影,以全蛋白作为内参进行ZO-1 半定量分析.使用Image J 处理数据,分析3 种方法的半定量结果.
2 结果与讨论
2.1 APTZO-1 的筛选结果
通过ELISA 法测定每轮文库与ZO-1 的相对亲和力,以监测筛选进程.测定吸光度,并对“筛选轮数-吸光度”进行数据分析,结果见图1.图1 表明,ssDNA与ZO-1 的亲和力随筛选轮数的增加呈上升趋势,筛选至第10 轮时,吸光度基本进入平台期,故结束筛选.

图1 十轮文库与ZO-1 的相对亲和力Fig.1 Relative affinity of ten rounds library to ZO-1
取第10 轮文库的样品进行高通量测序,共筛选到15 条APTZO-1.通过UNAFold 网站预测APTZO-1的二级结构图,结合分析其序列与二级结构,排除了线性结构与相似结构,最终合成9 条APTZO-1,其序列见表3.
2.2 APTZO-1 与ZO-1 的亲和力测定结果
使用ELISA 法测定APTZO-1与ZO-1 结合的解离常数,以表征APTZO-1与ZO-1 的亲和力强弱.以APTZO-1浓度为X、吸光值为Y,按Y=BmaxX/(Kd+X)进行非线性拟合,测定结果见表3.表3 中的9 条APTZO-1的Kd值均为nmol/L 量级,说明经过10 轮SELEX 筛选成功获得了与ZO-1 高度亲和的APTZO-1.Kd值的大小能够反映APTZO-1对ZO-1 亲和力的强弱,Kd值越小,表明APTZO-1与ZO-1 的亲和力越强.因此,9 条APTZO-1与ZO-1 亲和力的排序为
APTZO-18与ZO-1的亲和力最高,Kd值为2.23 nmol/L,故选择APTZO-18 进行后续的实验.此外,利用ELISA测定了APTZO-18 与2 种非靶标蛋白(BSA、卵清蛋白)结合的吸光值,每组吸光值均与空白组吸光值为同一数量级且数值相近,远低于同浓度下APTZO-18 结合ZO-1 的 吸 光 值.因 此, APTZO-18 与ZO-1 的 结 合 力 远高于非靶标蛋白, 表明APTZO-18 与ZO-1 的结合具有特异性.
表3 显示,APTZO-18 的GC 碱基含量(58.02%)最高,Kd值最小,与ZO-1 的亲和力最强;APTZO-14 的GC 含量(55.56%)最低,与ZO-1 的亲和力最低.因此,GC 含量可能是影响核酸适配体亲和ZO-1 能力的因素之一[17].9 条APTZO-1的Kd值均置于10−9~10−8mol/L,但其序列及GC 碱基含量的差别并不大,因此,可能是核酸适配体在二级结构上的差别影响了与ZO-1的亲和力大小,应结合核酸适配体的序列及二级结构进行进一步的分析.
核酸适配体形成茎、茎环、口袋等结构,可以在空间结构上与靶标互补契合.其中,小茎环结构可增强核酸适配体的热稳定性,茎段结构部分的GC 碱基配对可以提高茎段的稳定性,从而增强与靶标的亲和力[18].通过分析与比较所有APTZO-1的二级结构发现,均含有单一的口袋结构,均易于在第10~20 位、第45~55 位、第50~65 位碱基处形成3~4 个茎环结构,且多数为小茎环,可能核酸适配体的小茎环结构更有利于结合靶标.图2 显示APTZO-18 作为与ZO-1 亲和力最高的核酸适配体,第13~19 位与第57~63 位碱基均为小茎环结构,第45-54 位碱基含一个中茎环,并且多个茎环结构并不位于同一直线, 可能有利于APTZO-18 在空间上与ZO-1 的结构互补.通过对比9 条APTZO-1的序列与二级结构图发现,虽然其GC 碱基含量接近,但茎段部分的GC 碱基配对数差距较大.如APTZO-14 的茎段结构部分仅有11 对GC碱基配对, APTZO-18 的茎段部分共有15 个GC 碱基对,为9 条APTZO-1中配对数最高,说明APTZO-1茎段的GC 碱基配对会影响其茎段区域的稳定性,从而导致其结合ZO-1 的能力不同.

图2 APTZO-1 8 的二级结构预测图Fig.2 Predicted secondary structure of APTZO-1 8
2.3 基于Cy5-APTZO-1 8 对细胞上ZO-1 的定位观察
使 用Cy5 荧 光 标 记 的APTZO-18(Cy5-APTZO-18)对Caco-2 与hCMEC/D3 细胞的ZO-1 进行荧光定位观察,同时采用传统IF 法作为对比,于超分辨显微成像系统下使用60 倍镜观察,结果见图3 和图4.

图3 基于传统IF 与Cy5-APTZO-1 8 对Caco-2 细胞上ZO-1 的染色Fig.3 Staining of ZO-1 based on traditional IF and Cy5-APTZO-1 8 on Caco-2 cell
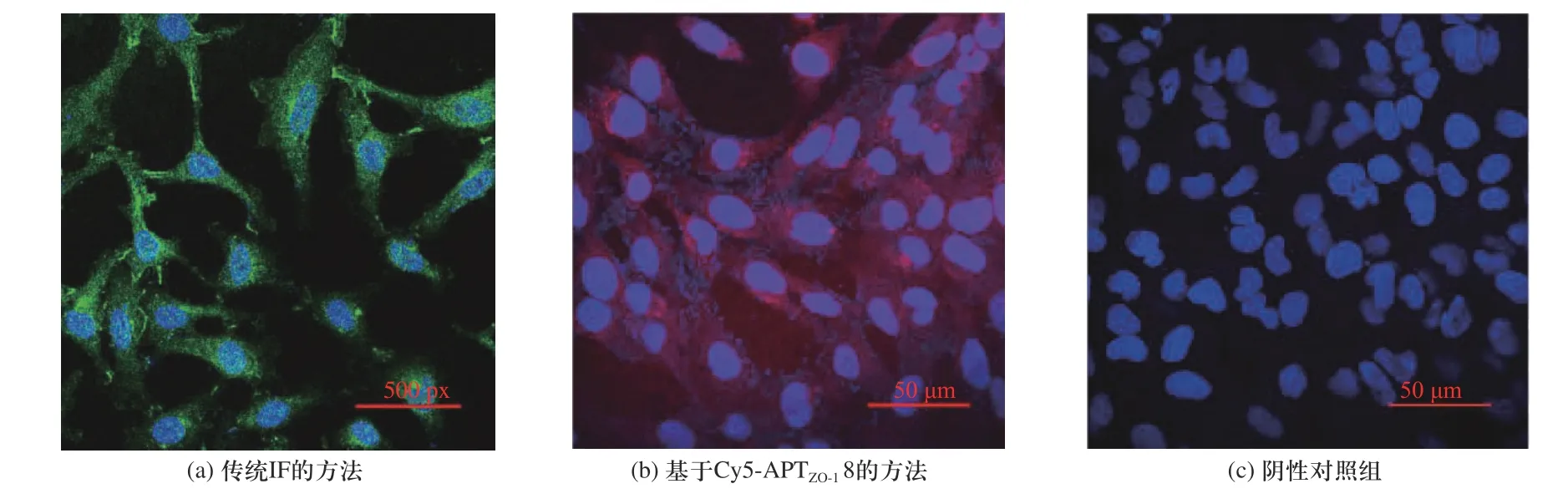
图4 基于传统IF 与Cy5-APTZO-1 8 对hCMEC/D3 细胞上ZO-1 的染色Fig.4 Staining of ZO-1 based on traditional IF and Cy5-APTZO-1 8 on hCMEC/D3 cell
图3 与图4 中的传统IF 组显示,两种细胞的ZO-1主要分布于细胞质中与细胞膜上,表现为连续性荧光,可呈现出清晰的细胞形态.Cy5-APTZO-18 组的结果显示,Cy5-APTZO-18 能够准确定位胞质中与细胞膜上的ZO-1,可以呈现出Caco-2 细胞的蜂窝状及hCMEC/D3 细胞的梭状.与传统IF 组相比,Cy5-APTZO-18 组图片中的杂点更少,成像图片更加清晰、明亮.并且使用Cy5-APTZO-18 进行实验不需进行二抗孵育及洗膜的操作,有效地简化实验步骤、缩短了实验时长.同时,在相同荧光强度下,阴性对照组中无胞质与胞膜的ZO-1 标记,无法呈现出正常细胞形态,可证明APTZO-18 具有特异性.
2.4 基于Cy5-APTZO-1 8 对细胞上ZO-1 的半定量分析
为考察Cy5-APTZO-18 的相对定量能力,采用细胞旋转模型模拟微重力,分析模拟微重力下两种细胞上ZO-1 的含量变化.使用Cy5-APTZO-18 进行Caco-2 与hCMEC/D3 细胞上ZO-1 的半定量分析,并与传统IF 法、WB 法的结果进行对比.于超分辨显微成像系统的20 倍镜下观察,使用Image J 分析ZO-1 的平均荧光强度,测定结果见图5 和图6.

图5 基于3 种方法对 Caco-2 细胞ZO-1 的半定量结果Fig.5 Semi-quantitative results of ZO-1 on Caco-2 cell based on 3 methods

图6 基于3 种方法对hCMEC/D3 细胞ZO-1 的半定量结果Fig.6 Semi-quantitative results of ZO-1 on hCMEC/D3 cell based on 3 methods
图5~6 中的传统IF 结果显示:与CON 组相比,SMG 组的ZO-1 含量下降,Caco-2 与hCMEC/D3 细胞的ZO-1 分别降低了9.57%、8.53%.WB 结果也显示了模拟微重力可导致两种细胞上ZO-1 的表达降低,Caco-2 与hCMEC/D3 分别降低15.4%、24.32%(**P<0.01).以上两种方法的结论与文献[18 − 19]报道一致.基于Cy5-APTZO-18 的半定量结果表明:模拟微重力下,Caco-2 细胞与hCMEC/D3 细胞的ZO-1 表达分别下降了15.1%、24.75%,这与传统IF 与WB 的测定结果相似,Cy5-APTZO-18 能够实现细胞样本上ZO-1的半定量分析.
3 结 论
文中以ZO-1 为研究对象,基于SELEX 技术首次筛选ZO-1 的APT,最终筛选到9 条APTZO-1,并采用ELISA 法分析并确定了APTZO-18 与ZO-1 的亲和力最强.通过分析9 条APTZO-1的解离常数、序列及二级结构,发现GC 含量、小茎环结构的数量及位置、茎段部分的GC 碱基配对数可能影响APTZO-1与ZO-1的亲和力.证实了荧光标记的APTZO-18 可对细胞质内与细胞膜上的ZO-1 进行定位与半定量分析,具有潜在的良好应用能力.但本研究后续亦可采用其他方法(如表面等离子体共振法等[20])以表征APT 与ZO-1 的亲和力,从而提高亲和力测定的科学性.后期可进行深入分析APTZO-18 与ZO-1 的关系空间结构,如探究二者的潜在结合位点等,为扩大ZO-1 的适配体的应用奠定基础.
核酸适配体作为一种小分子生物工具,在未来还有许多潜在的其他应用价值.核酸适配体具有无免疫原性、生物相容性高、穿透力强等优点[21],且易于进行化学修饰与标记,或可借助成像技术以实现机体内活细胞的ZO-1 检测.核酸适配体具有特异性高、化学稳定性较强等特点,可作为一种识别元件应用于各种光学、电化学等传感检测[22],以提高检测的灵敏度.但核酸适配体存在诸如易受核酸酶的影响、构象不稳定、体内半衰期较短等问题,或需要进一步优化其性能,才能提高核酸适配体在实际应用中的效率.
