长链非编码RNA生长停滞特异性转录本5在糖尿病肾病进展中作用机制研究
2023-08-03潘妙霞陈剑妹王玉川蔡兴莉
李 杨, 徐 曼, 潘妙霞, 陈剑妹, 王玉川, 蔡兴莉
中南大学湘雅医学院附属海口医院 肾病风湿科,海南 海口 570208
糖尿病肾病(diabetic nephropathy,DN)为糖尿病的并发症之一,严重影响患者预后[1]。DN病理改变的重要特征为系膜细胞增殖,肾小球系膜的细胞外基质堆积、基底膜增厚、系膜区扩张,从而发展为肾小球硬化[2-4]。长链非编码RNA(long non-coding RNAs,lncRNAs)为长度>200 bp的转录本,且不具有任何明显的蛋白质编码能力[5]。LncRNAs可以影响不同的细胞功能,参与多种生理和病理过程[6-11]。长链非编码RNA生长停滞特异性转录本5(long non-coding RNAs growth arrest-specific transcript 5,LncRNA GAS5)可通过与Yes关联蛋白结合,促进其磷酸化和降解,从而抑制结直肠癌的进展[12]。LncRNA GAS5在DN患者的血清中表达下调,并参与DN进展[13]。本研究旨在探讨LncRNA GAS5在DN进展中的作用机制。现报道如下。
1 材料与方法
1.1 实验材料及分组 5周龄大鼠购自上海西普尔-必凯实验动物有限公司;人肾小球系膜细胞(human mesangial cell,HMC)购自武汉普诺赛生命科技有限公司;TRIzol RNA试剂购自Invitrogen公司;SYBR Premix Ex Taq GC试剂盒购自TAKARA公司;Lipofectamine 2000转染试剂购自Invitrogen公司;双萤光素酶报告基因检测试剂盒购自Promega公司;沉默信息调节因子2相关酶1(silent information regulator factor 2 related enzyme 1,SIRT1)、GAPDH抗体购自Abcam公司;细胞计数试剂(cell counting kit-8,CCK-8)试剂购自TargetMol公司。
1.2 研究方法
1.2.1 体外DN模型构建 肾小球系膜细胞于高糖(25 mmol/L)Dulbecco改良Eagle培养基(dulbecco′s modified eagle medium,DMEM)中培养,模拟建立DN细胞模型,分为LncRNA GAS5干扰组、LncRNA GAS5过表达组与阴性对照组。
1.2.2 外泌体的分离鉴定、摄取实验 收集细胞上层清液,去除杂质与细胞碎片后于滤器中(0.22 μmol/L)过滤,在电镜铜网上涂20 μl外泌体悬液,于室温条件下放置10 min,采用30 μl磷钨酸(20 mg/ml)复染1 min,于透射电镜下观察、拍照记录。
1.2.3 RNA提取及实时荧光定量聚合酶链式反应检测 利用TRIzol提取总RNA,采用分光光度计检测RNA浓度。利用逆转录试剂盒以及SYBR Premix Ex Taq GC试剂盒进行逆转录反应以及实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qRT-PCR)检测。基因的Ct值通过FAST7500系统检测,标准化后,计算每个基因的相对表达量。
1.2.4 蛋白质印迹法 通过裂解液充分裂解细胞,所得样品于4℃条件下离心15 min并收集上层清液。加入上样缓冲液后,将蛋白样品放置于100℃蜂窝炉中进行变性。经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后转印至聚偏二氟乙烯膜,采用5%脱脂奶粉封闭,并于4℃条件下孵育一抗过夜。采用Tris缓冲液-聚山梨醇酯20(tris buffered saline with tween 20,TBST)洗涤聚偏二氟乙烯膜后,加入相应种属二抗,于室温下孵育2 h,在凝胶成像仪中检测蛋白表达。
1.2.5 双荧光素酶报告实验 根据LncRNA GAS5、miRNA以及靶基因mRNA结合位点,利用软件设计相应引物,构建LncRNA GAS5野生型和突变型双荧光素酶载体。各组细胞转染后48 h,参照双荧光素酶报告基因检测试剂盒操作说明检测荧光素酶活性。
1.2.6 DN模型 选取10只健康的5周龄大鼠为研究对象。将大鼠分为模型组与对照组,每组各5只。模型组采用高脂高糖喂养1个月,一次性腹腔注射40 mg/kg链脲佐菌素,72 h后检测血糖>16.7 mmol/L为模型诱导成功。对照组饮食正常,腹腔注射同等剂量的生理盐水。获取模型组与对照组大鼠肾组织,检测LncRNA GAS5的表达情况。
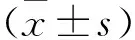
2 结果
2.1 DN中LncRNA GAS5表达情况 模型组肾组织样本LncRNA GAS5表达水平低于对照组,差异有统计学意义(P<0.05,图1a)。模型组血清外泌体中LncRNA GAS5表达水平低于对照组,差异有统计学意义(P<0.05,图1b)。模型组HMC细胞中LncRNA GAS5表达水平低于对照组,差异有统计学意义(P<0.05,图1c)。模型组HMC细胞上清外泌体中LncRNA GAS5表达水平低于对照组,差异有统计学意义(P<0.05,图1d)。
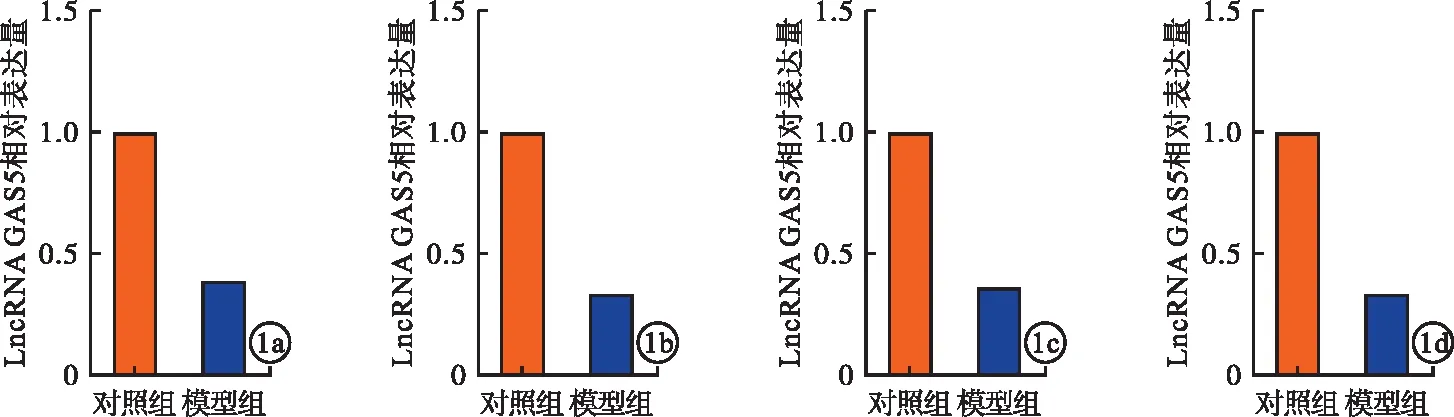
图1 DN中LncRNA GAS5表达情况(a.肾组织样本;b.血清外泌体样本;c.HMC细胞样本;d.HMC细胞上清外泌体样本)
2.2 LncRNA GAS5过表达抑制DN纤维化进程 LncRNA GAS5过表达组HMC细胞增殖水平低于阴性对照组,差异有统计学意义(P<0.05,图2a~c)。LncRNA GAS5过表达组HMC细胞迁移能力低于阴性对照组,差异有统计学意义(P<0.05,图2d)。LncRNA GAS5过表达组HMC细胞中α-平滑肌肌动蛋白、纤连蛋白、α(I)胶原表达均低于阴性对照组,差异均有统计学意义(P<0.05,图2e)。
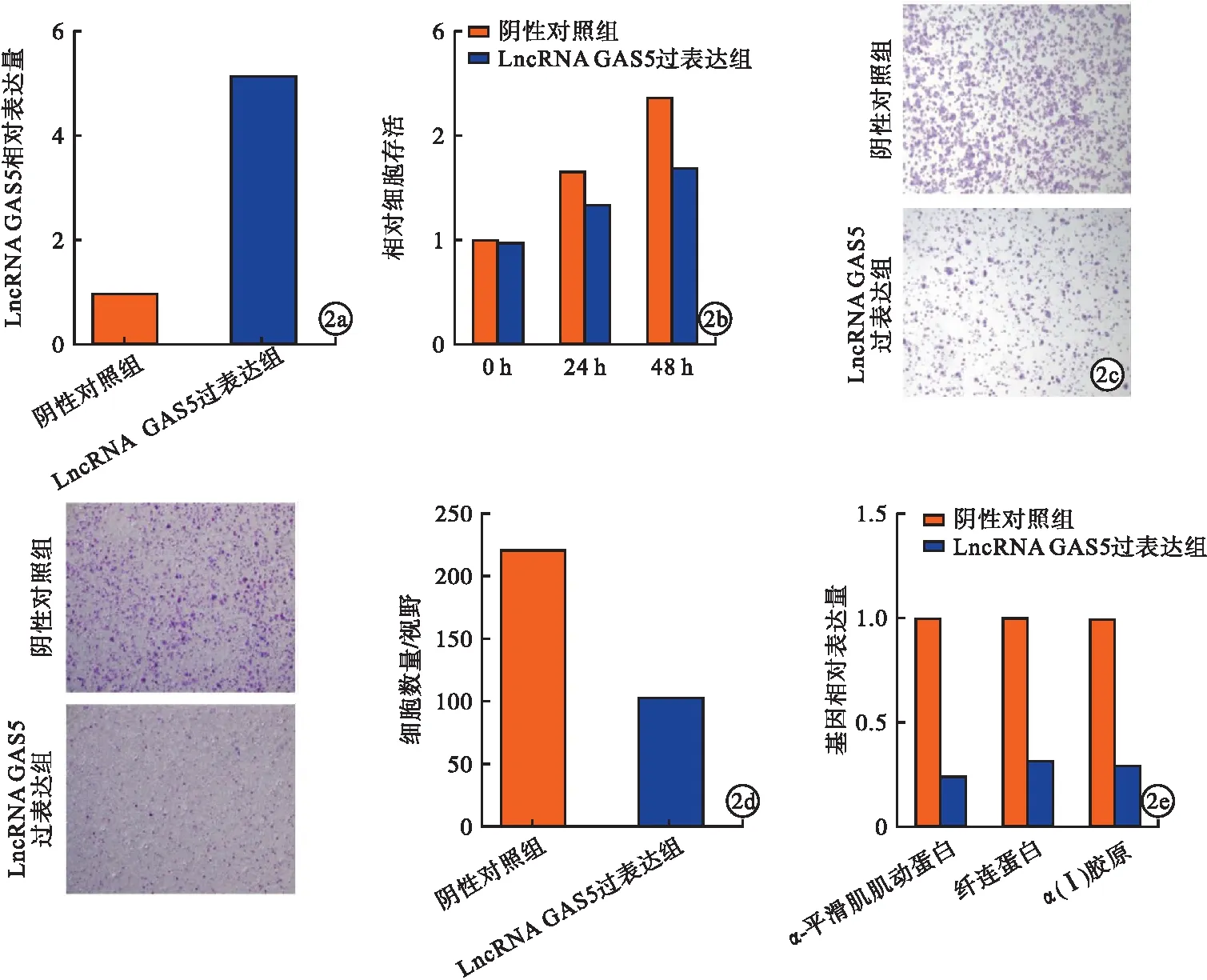
图2 LncRNA GAS5过表达抑制DN纤维化进程[a.在HMC细胞中过表达LncRNA GAS5;b.CCK-8检测HMC细胞增殖情况;c.平板克隆检测HMC细胞生长情况;d.Transwell检测HMC细胞迁移情况;e.qRT-PCR检测HMC细胞中α-平滑肌肌动蛋白、纤连蛋白、α(I)胶原表达情况]
2.3 LncRNA GAS5负向调控miR-135a-5p表达 StartBase v2.0预测发现,miR-135a-5p与LncRNA GAS5具有靶向关系(图3a)。在HMC细胞中共转染GAS5-WT、miR-135a-5p后,LncRNA GAS5过表达组荧光素酶活性低于阴性对照组,差异有统计学意义(P<0.05),共转染GAS5-MUT和miR-135a-5p后,荧光素酶活性无明显改变(图3b)。与Ago2抗体结合后,LncRNA GAS5过表达组富集水平高于阴性对照组,差异有统计学意义(P<0.05,图3c)。LncRNA GAS5过表达组生物素化的miR-135a-5p吸附物中LncRNA GAS5富集水平高于阴性对照组,差异有统计学意义(P<0.05,图3d)。敲减或过表达LncRNA GAS5后,LncRNA GAS5过表达组HMC细胞中miR-135a-5p表达水平相应高于或低于阴性对照组,差异有统计学意义(P<0.05,图3e、f)。
图3 LncRNA GAS5负向调控miR-135a-5p表达(a.StartBase v2.0预测miR-135a-5p与LncRNA GAS5结合;b.荧光素酶报告基因实验验证miR-135a-5p与LncRNA GAS5结合;c.Ago2抗体检测LncRNA GAS5富集情况;d.生物素检测LncRNA GAS5富集情况;e.LncRNA GAS5敲低HMC细胞中miR-135a-5p表达;f.LncRNA GAS5过表达组HMC细胞中miR-135a-5p表达)
2.4 MiR-135a-5p负向调控SIRT1表达 经TargetScanHuman 8.0预测发现,SIRT1为miR-135a-5p的靶点之一(图4a)。在HMC细胞中共转染SIRT1-WT、miR-135a-5p后,LncRNA GAS5过表达组荧光素酶活性低于阴性对照组,差异有统计学意义(P<0.05),而共转染SIRT1-MUT、miR-135a-5p后,荧光素酶活性无明显改变(图4b)。过表达或敲减miR-135a-5p后,SIRT1的mRNA、蛋白表达水平均相应低于或高于阴性对照组,差异有统计学意义(P<0.05,图4c~4d)。敲减或过表达LncRNA GAS5后,LncRNA GAS5过表达组HMC细胞中SIRT1表达水平相应低于或高于对照组,差异有统计学意义(P<0.05,图4e、f)。
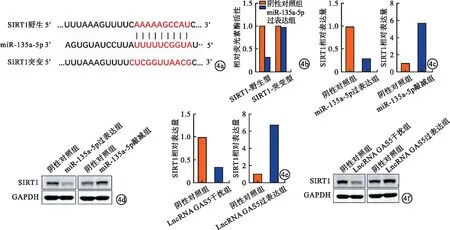
图4 MiR-135a-5p负向调控SIRT1表达(a.TargetScanHuman 8.0预测miR-135a-5p与SIRT1潜在结合位点;b.荧光素酶报告基因实验验证miR-135a-5p与SIRT1结合;c.过表达/敲减miR-135a-5p的 HMC细胞中SIRT1的mRNA表达水平;d.过表达/敲减miR-135a-5p的 HMC细胞中SIRT1蛋白表达水平;e.敲减 /过表达LncRNA GAS5的 HMC细胞中SIRT1的mRNA表达水平;f.敲减/过表达LncRNA GAS5的 HMC细胞中SIRT1的蛋白表达水平)
2.5 LncRNA GAS5通过miR-135a-5p/SIRT1调控DN纤维化进程 感染miR-135a-5p或转染siSIRT1后,LncRNA GAS5过表达组对HMC细胞增殖的抑制作用及对α-平滑肌肌动蛋白、纤连蛋白、α(I)胶原表达抑制作用均弱于阴性对照组,但差异无统计学意义(P>0.05)。见图5。
3 讨论
DN的重要病理特征之一为系膜细胞异常增殖,其过程复杂,具体机制尚不清楚[14]。外泌体是由细胞分泌的具有双层膜结构的小囊泡,广泛分布于体液中,其可参与细胞周期、血管生成以及组蛋白修饰等过程,且可用于多种疾病的诊断[15-16]。LncRNA通过调控下游miRNA参与包括DN在内的多种疾病的发生发展,且可作为DN潜在的生物标志物和治疗靶点[17-18]。有研究报道,miR-135a可通过调节人转化受体电位阳离子通道亚家族C成员1促进DN患者的肾纤维化过程[19]。此外,在大鼠DN模型中,抑制miR-135a也可减小肾的纤维化程度[20]。
本研究结果显示,模型组肾组织与血清外泌体中LncRNA GAS5表达水平低于对照组,且HMC细胞内及上清外泌体中LncRNA GAS5表达水平同样低于对照组。这提示,外泌体LncRNA GAS5具有作为DN检测标志物的临床应用价值。本研究结果发现,LncRNA GAS5过表达组HMC细胞中α-平滑肌肌动蛋白、纤连蛋白、α(I)胶原表达均低于阴性对照组。这提示,过表达LncRNA GAS5可以抑制高糖条件下HMC细胞的生长、转移和纤维化,LncRNA GAS5可作为DN的潜在治疗靶点。本研究结果还发现,敲减或过表达LncRNA GAS5后,HMC细胞中miR-135a-5p表达水平相应高于或低于阴性对照组,而SIRT1表达水平低于或高于阴性对照组。这表明,LncRNA GAS5通过靶向miR-135a-5p可以促进DN发病过程中的HMC增殖、迁移和纤维化因子的分泌,而特异性抑制该信号通路或可达到治疗DN的目的。
综上所述,LncRNA GAS5可通过miR-135a-5p/SIRT1轴调控DN的进展,为阐明DN进展的分子机制提供重要线索。
