豆科3种植物的抗氧化活性比较
2023-07-27刘满军王晓萍石会丽来元如
刘满军,魏 阳,王晓萍,石会丽,陈 昊,高 蓉,来元如,杜 君
陕西省中医医院,西安 710018
课题组在既往的研究中比较了苦刺花、山豆根、苦参中总黄酮成分的含量,建立了3味药材总黄酮高效液相色谱法(high performance liquid chromatography,HPLC)特征指纹图谱[1]。三者为同科属药用植物,均具有清热燥湿、解毒凉血、利湿消肿等功效,均含有苦参碱、槐果碱、槐定碱等化合物,属于双稠哌啶类,具有喹喏里西啶的基本结构,有较强的生物活性[2-5]。此外,3味药材中还含有黄酮类化合物。有报道苦参、山豆根提取的黄酮类化合物具有抗氧化活性及抑菌活性[6-7],关于二者所含生物碱及苦刺花抗氧化活性的研究目前鲜见报道。目前,普遍认为,自由基及由其诱导的氧化反应是衰老与各种疾病发生的主要原因之一[8-10]。所以天然抗氧化剂的开发和利用是研究的热点。本文根据3种植物中所含化学成分的性质,用系统溶剂提取法提取主要化学成分,用现行的3种体外抗氧化实验方法即1,1-二苯基-2-三硝基苯肼(DPPH)法、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABST)法、3-氧代-2苯基-4,4,5,5-四甲基咪唑啉-1氧(PTIO)法分别对三者不同提取部位进行了抗氧化活性研究,为其开发应用及其相互替代提供科学依据。
1 仪器与试药
1.1 仪器
KQ-250 DE型超声波清洗机(昆山市超声仪器有限公司);QUINTIX65-1 CN电子分析天平(d=0.01 mg;BSA224 S,d=0.1 mg,北京赛多利斯天平有限公司);移液枪(型号为2~20、10~100、20~200、100~1 000 μL,北京大龙兴创实验仪器股份公司);UV-1700PC型紫外可见分光光度计(上海凤凰光学科仪有限公司);电热恒温水浴锅(北京科伟永兴仪器有限公司);LRH-70/MJ-80-1培养箱(上海一恒科学仪器有限公司);RE-2000 B型旋转薄膜蒸发仪(上海亚荣生化仪器厂)。
1.2 试药
1,1-二苯基-2-三硝基苯肼(批号A800764)、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(批号C129138)、3-氧代-2苯基-4,4,5,5-四甲基咪唑啉-1氧(批号p838429),质量分数均≥98%,均购自上海麦克林生化科技有限公司;水为新鲜蒸馏水(自制);其余试剂均为分析纯。
苦刺花(批号20210410)为豆科植物白刺花SophoraviciifoliaHance的根,自采于宜君县;山豆根(批号20211001)为豆科植物越南槐SophoratonkinensisGagnep.的干燥根和根茎,苦参(批号20210901)为豆科植物苦参SophoraflavescensAit.的干燥根,均购自陕西兴盛德药业有限责任公司。由石会丽研究员鉴定。
2 方法与结果
2.1 供试品溶液的制备
分别取苦刺花、苦参和山豆根粉末(过40目筛)约50 g,精密称定,分别置于3个圆底烧瓶中,加入5 mL氨水、500 mL二氯甲烷回流1.5 h,同法处理2次,滤过,减压浓缩、干燥,得二氯甲烷提取物,备用;药渣挥干溶剂,加甲醇500 mL,同法回流处理2次,得甲醇提取物;提取物挥去溶剂,分别用无水乙醇溶解,超声(功率为250 W,频率为40 kHz)处理20 min,放冷,定容至所需质量浓度。将各部位的提取物名称简称为苦刺花(METH)、苦刺花(CH2Cl2)、苦参(METH)、苦参(CH2Cl2)、山豆根(METH)、山豆根(CH2Cl2)。
2.2 DPPH 法的建立
2.2.1制备DPPH乙醇溶液 精密称取DPPH 4.46 mg,置于100 mL棕色量瓶中,加无水乙醇溶解并稀释至刻度,超声5 min,充分混匀,避光放置,即得0.113 mmoL·L-1的DPPH乙醇溶液。取上述溶液,加适量无水乙醇稀释后,使其吸光度在0.6~1.0,即得DPPH工作液。
2.2.2预实验确定供试品溶液最适质量浓度 精密移取DPPH工作液2 mL,置于具塞试管中,加入少量的样品液。加样时,由少到多渐加,且边加边混匀,观察溶液颜色的变化,当溶液颜色基本褪去时,记录样品加样量。如果反应缓慢,可在37 ℃培养箱中放置0.5 h,等待完全反应。此加样量为样品的最大用量,在此最大用量的基础上,往前设置至少5个质量浓度,使之尽可能呈等差数列。如预实验中苦参(METH)的质量浓度为25 mg·mL-1、用量为1 mL时,DPPH溶液的颜色基本褪去,则1 mL为该供试品溶液的最大用量。对该样品而言,其质量浓度梯度宜设为5、10、15、20、25 mg·mL-1。分别通过预实验得出最大用量为1 mL时该供试品溶液的最大质量浓度,结果显示,苦参(CH2Cl2)为20 mg·mL-1,苦刺花(METH)为25 mg·mL-1,苦刺花(CH2Cl2)为80 mg·mL-1,山豆根(METH)为20 mg·mL-1,山豆根(CH2Cl2)为20 mg·mL-1。
2.2.3测定DPPH自由基清除率 按照2.1项下方法分别制备苦刺花、苦参和山豆根的供试品储备液,稀释成预实验所需最大质量浓度的供试品溶液,按照2.2.2项下梯度法,此法参考文献[11-13]稍作修改。分别取此溶液不同体积置于试管中,用无水乙醇补充每管供试品溶液至1 mL,混合均匀,制得系列质量浓度的溶液,再分别加入同一DPPH工作液2 mL,在适宜反应时间内使反应达到动态平衡后,在517 nm处测定吸光度值,记为Ai,同时,以1 mL无水乙醇与2 mL DPPH工作液的混合溶液作为对照组,其吸光度值记为A0;以相对应的供试品梯度溶液加2 mL无水乙醇作为空白组,其吸光度值记为Aj,按 DPPH自由基清除率(%)=[1-(Ai-Aj) /A0]×100%,计算清除率。以质量浓度(mg·mL-1) 为横坐标、清除率(%)为纵坐标,绘制清除率曲线,计算半数清除率(IC50)。最终每测1个用量需要测定3个平行数据。实验结果见表1、图1。

注:A.苦刺花(METH);B.苦刺花(CH2Cl2);C.苦参(METH);D.苦参(CH2CL2);E.山豆根(METH);F.山豆根(CH2Cl2)。
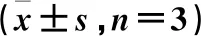
表1 3种不同植物不同提取部位对3种不同自由基清除率IC50值
2.2.4确定反应完成时间 分别移取低、中、高3种质量浓度的供试品溶液,按照2.2.3 项下方法,在反应时间分别为8、12、16、20、24、28、32、36、40、44、48、52、56、60 min时测定吸光度值(Ai),观察各质量浓度下Ai的变化情况。结果显示,当反应时间为32 min时,其Ai与相邻时间点(28、36 min)Ai的相对偏差(RSD)均小于5%,表明30 min能使反应达到动态平衡,故确定反应时间为30 min。
2.3 ABTS法的建立
2.3.1ABTS自由基工作溶液的配制 ABST二铵盐7.4 mmoL·L-1储备液:取ABST二铵盐6 mg,加蒸馏水1.47 mL,即得。
过二硫酸钾(K2S2O8)2.6 mmoL·L-1储备液:取K2S2O81 mg,加蒸馏水1.43 mL,即得。
ABTS自由基储备液:分别移取7.4 mmoL·L-1的ABTS溶液1 mL和2.6 mmoL·L-1的过二硫酸钾溶液1 mL,混合均匀,于黑暗环境下放置12~16 h,即得。
ABTS自由基工作液:实验前,移取ABTS自由基储备液2.0 mL,用pH 7.4的磷酸盐缓冲液将混合液稀释10~20倍至吸光度值为0.70~0.90左右,即得。
2.3.2预实验确定供试品溶液最适质量浓度 精密移取ABST溶液2 mL,置于具塞试管中,加入供试品溶液。加样时,由少到多渐加,且边加边摇,混合均匀,并观察溶液颜色的变化,当溶液颜色基本褪去时,记录样品质量浓度及加样量。如果反应缓慢,可在37 ℃培养箱中放置0.5 h,等待完全反应。此加样量即为样品的的最大用量,在此最大用量的基础上,往前设置至少5个质量浓度,使之呈等差数列。如预测苦刺花(CH2Cl2)质量浓度最大为1.0 mg·mL-1,则将其质量浓度设置为0.10、0.20、0.40、0.60、0.80、1.0 mg·mL-1;苦刺花(METH)最大质量浓度为0.20 mg·mL-1、苦参(METH)最大质量浓度为1.0 mg·mL-1、苦参(CH2Cl2)最大质量浓度为1.0 mg·mL-1、山豆根(METH)最大质量浓度为0.60 mg·mL-1、山豆根(CH2Cl2)最大质量浓度为0.20 mg·mL-1。
2.3.3ABTS自由基清除率测定 按照2.1项下方法分别制备苦刺花、苦参和山豆根的供试品储备液,依据2.3.2项下预实验结果,配制成最大质量浓度供试品溶液,将设置的等差系列质量浓度稀释成预实验所需质量浓度的供试品溶液。此法依据文献[14-16]稍作修改。分别取此溶液不同体积置于试管中,用无水乙醇补充每管供试品溶液体积至1 mL,混合均匀,再分别加入同一ABTS工作溶液,在适宜反应时间内使反应达到动态平衡后,在734 nm处测定吸光度值(Ai)。同时,以1 mL的无水乙醇与2 mL ABTS自由基工作液作为对照组,测定吸光度值(A0);将相应质量浓度的供试品溶液用无水乙醇稀释至1 mL,与2 mL pH7.4的磷酸盐缓冲液混合,作为空白组,吸光度值记为Aj,按 ABTS自由基清除率(%)=[1-(Ai-Aj)/A0]×100%计算清除率,以质量浓度(mg·mL-1)为横坐标、清除率(%) 为纵坐标,绘制清除率曲线,进而获得半数清除率(IC50)。按照2.2.3项下方法测量。实验结果分别见图2、表1。
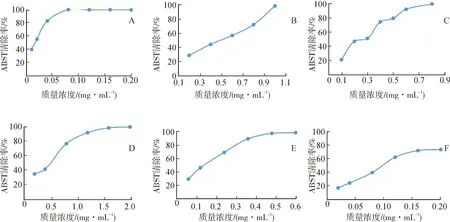
注:A.苦刺花(METH);B.苦刺花(CH2Cl2);C.苦参(METH);D.苦参(CH2Cl2);E.山豆根(METH);F.山豆根(CH2Cl2)。
2.3.4反应时间的确定 分别移取低、中、高3种质量浓度的供试品溶液,按照2.3.2项下方法,在反应时间分别为 5、10、15、20、25、30、35、40 min 时测定吸光度值(Ai),观察各质量浓度溶液Ai的变化情况。结果显示,当反应时间为25 min 时,其Ai与相邻时间点(20、30 min)Ai的RSD值均小于5%,表明25 min能使反应达到动态平衡,故确定反应时间为25 min。
2.4 PTIO法的建立
2.4.1PTIO工作液的制备 取15 mg PTIO,精密称定,置于100 mL棕色量瓶中,用乙醇溶解并稀释至刻度,超声5 min,充分混匀,避光放置,即得0.64 mmol·L-1的PTIO乙醇溶液。取上述溶液,加适量乙醇稀释后,在587 nm处测定,使其吸光度值为0.6左右。即得PTIO工作液,临用前现配。
2.4.2预实验确定供试品溶液最适质量浓度 精密移取PTIO工作液2 mL,置于具塞试管中,向其中加入少量的样品液。加样时,由少到多渐加,且边加边混匀,并观察溶液颜色的变化,当溶液颜色基本褪去时,记录样品质量浓度及加样量。如果反应缓慢,可在37 ℃培养箱中放置0.5~2 h,等待完全反应。此加样量即为样品的的最大用量,在此最大用量的基础上,往前设置至少5个质量浓度,使之呈等差数列。如预测苦参(METH)质量浓度为200 mg·mL-1时,用量为1 mL,PTIO溶液的颜色基本褪去,则1 mL为该样品液的最大用量。对该样品而言,其梯度质量浓度宜设为40、80、120、160、200 mg·mL-1。苦参(CH2Cl2)质量浓度为200 mg·mL-1、苦刺花(METH)质量浓度为100 mg·mL-1、苦刺花(CH2Cl2)质量浓度为360 mg·mL-1,山豆根(METH)质量浓度为200 mg·mL-1、山豆根(CH2Cl2)质量浓度为100 mg·mL-1。
2.4.3测定PTIO自由基清除率 按照2.1项下方法分别制备苦刺花、苦参和山豆根的供试品储备液,稀释成预实验所需质量浓度的供试品溶液。此法依据文献[17-18]稍作修改。分别取此溶液不同体积置于试管中,用无水乙醇补充至每管供试品溶液至1 mL,混合均匀,再分别加入同一 PTIO工作液,此反应较为缓慢,在37 ℃恒温培养箱中放置1 h,等待完全反应。在适宜反应时间内使反应达到动态平衡后,在587 nm处测定吸光度值,记为Ai。同时,以1 mL无水乙醇与2 mL PTIO工作液的混合溶液作为对照组,其吸光度值记为A0;以相应的供试品溶液加无水乙醇至1 mL与2 mL无水乙醇作为空白组,其吸光度值记为Aj,按DPPH自由基清除率(%)=[1-(Ai-Aj)/A0]×100%计算清除率,以质量浓度(mg·mL-1) 为横坐标、清除率(%)为纵坐标,绘制清除率曲线,计算IC50。最终测定同2.2.3项下方法。实验结果分别见表1、图3。

注:A.苦刺花(METH);B.苦刺花(CH2Cl2);C.苦参(METH ;D.苦参(CH2Cl2);E.山豆根(METH);F.山豆根(CH2Cl2)。
2.4.4确定最佳反应时间 分别移取低、中、高3种质量浓度的供试品溶液,按照2.4.2项下方法,置于37 ℃恒温培养箱中,于反应时间分别为10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90 min时测定吸光度值(Ai),观察各质量浓度溶液Ai的变化情况。结果显示,当反应时间为60 min时,其Ai与相邻时间点(65、55 min )Ai的RSD值均小于5.0%,表明60 min能使反应达到动态平衡,故确定反应时间为60 min。
2.5 抗氧化活性比较
本研究用3种不同的体外抗氧化活性评价方法考察3种同科属植物的不同溶剂提取部位的抗氧化活性变化情况。由图1至图3知,样品的抗氧化活性呈不同程度的量效相关性,三者具有相似的特点,对DPPH、ABTS、PTIO自由基的清除率随样品溶液质量浓度的增大而增大,计算三者对DPPH、ABTS、PTIO自由基的清除率IC50值,见表1。
由表1可知,自由基清除率IC50值由小到大排列顺序依次为:DPPH法为山豆根(CH2Cl2)<山豆根(METH)<苦刺花(METH)<苦参(CH2Cl2)<苦参(METH)<苦刺花(CH2Cl2);ABST法为苦刺花(METH)<山豆根(CH2Cl2)<山豆根(METH)<苦参(METH)<苦参(CH2Cl2)<苦刺花(CH2Cl2);PTIO法为苦刺花(METH)<山豆根(CH2Cl2)<山豆根(METH)<苦参(CH2Cl2)<苦参(METH)<苦刺花(CH2Cl2);其抗氧化活性由大到小排列顺序同上。自由基清除率IC50值越小,其抗氧化性越强。3种方法的测定结果基本相似,表明测定结果具有较高的可信度。
3 讨论
3.1 量效、构效关系
本研究分别以DPPH、ABST、PTIO自由基清除率为指标,测定了山豆根、苦刺花、苦参不同提取物的抗氧化活性,结果显示,3种植物药材均具有抗氧化性,且具有量效正相关性。苦刺花3法皆是甲醇部位大于二氯甲烷部位,表明其中的黄酮类成分抗氧化作用大于生物碱部位;或者是黄酮类成分的含量较高,酚羟基数量多,产生的抗氧化效果较强。苦参与山豆根则相反,二氯甲烷部位的抗氧化性强于甲醇部位,二者生物碱的含量相对较高,其抗氧化性较强。
3.2 实验特色及注意事项
PTIO作为一种常用的一氧化氮清除剂,区别于其他自由基,其带电基团为氧原子,DPPH为氮原子。PTIO易被还原,溶液由紫色褪为无色,反应程度与所接受的电子数为定量关系,因此可通过测量吸光度值进行定量分析。因3种植物药材均为提取部位,成分复杂,为使抗氧化实验结果精确,应选择在最为合适的条件下进行实验。故依据参考文献[19]选取芥子碱、原花青素、邻苯二酚3类不同结构类型的中药小分子,用PTIO消除自由基检测方法分别探讨依据中药小分子清除PTIO自由基的方法,得出结论为其清除PTIO自由基的能力以pH=7.0时为最强。由此可知,当反应液呈中性时,对PTIO的清除效果均较佳。借此条件,用 PTIO消除自由基的方法分析、比较3种同科植物的抗氧化活性及其构效关系,同时对抗氧化剂的研究也具有一定的指导意义,使其抗氧化性实验的结果更加准确。
3.3 共性结果及建议
本次实验所用的供试品为3种植物的不同溶剂提取部位,只能说明其含有总生物碱、总黄酮类成分,且皆具有抗氧化活性,其具体化学成分有待进一步深入研究,以进一步说明其作用机制。
4 结论
在最佳反应条件下,用DPPH法、ABTS法和PTIO法比较了山豆根、苦刺花、苦参不同提取物抗氧化能力的差异,结果表明,三者皆具有较强的体外清除自由基的能力,且具有量效正相关性。抗氧化作用与黄酮类、生物碱类成分的含量呈正相关性,奠定了三者相互替代的开发潜能;可为苦刺花资源的科学开发和综合利用提供参考;为扩展3种药材的临床应用提供实验依据。
