白花丹素缓解眼小梁网细胞氧化应激损伤的作用
2023-07-27郭燕华刘志强王金平
郭燕华,刘志强,王金平
1.张家口市第一医院眼科,张家口 075000;2.河北北方学院附属第二医院眼科,张家口 075100;3.廊坊市人民医院眼科,廊坊 065000
青光眼是一种常见的不可逆性致盲性眼病,主要表现为眼压升高、视神经受到压迫及视力损伤,其病理学基础为视网膜神经节细胞凋亡及其所致的特征性视神经结构和功能损伤,发病机制复杂,小梁组织变异在其发病中发挥重要作用[1-2]。研究发现[3],氧化应激是小梁网细胞功能发生异常的原因之一。白花丹素为中药白花丹的有效成分之一,具有抗炎、抗氧化应激和调节免疫等药理作用[4]。研究显示[5],白花丹素可减轻视网膜神经节细胞氧化应激损伤,降低细胞凋亡率。本研究重点分析白花丹素对小梁网细胞氧化应激损伤的影响,并探讨其机制。
1 仪器与材料
1.1 仪器
二氧化碳培养箱(美国Shellab公司);DMi8-M型倒置相差显微镜(德国徕卡微系统有限公司);MODEL550酶标仪(美国Bio-Rad公司)。
1.2 试药
白花丹素(质量分数≥98%,批号180214,上海乔羽生物科技有限公司);Kelch样ECH关联蛋白1(Kelch like ECH associated protein 1,Keap1)/核因子相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)信号通路抑制剂ML385(批号151123,美国Target Molecule Corp公司);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPX1)试剂盒均购自南京信帆生物技术有限公司;四唑盐(MTT)试剂盒(上海碧云天生物技术有限公司);Annexin V-PE细胞凋亡检测试剂盒(北京百奥莱博科技有限公司);兔抗人Keap1、Nrf2和抗氧化反应元件(antioxidant response element,ARE)一抗和山羊抗兔免疫球蛋白G(immunoglobulin,IgG)二抗均购自美国Santa公司。
1.3 细胞
永生化的人眼小梁细胞系iHTM购自美国ATCC细胞库。
2 方法
2.1 细胞培养与传代
取人眼小梁细胞系iHTM,加入含50 mg·L-1胎牛血清的DMEM培养基,置于体积分数为5%的二氧化碳培养箱中培养,温度为37 ℃。贴壁85%以上开始传代,传代3次,取处于对数生长期的细胞用于实验。
2.2 细胞分组及处理
取第3代对数生长期细胞,分为对照组、抑制剂组、模型组、白花丹素联合抑制剂组和白花丹素组。对照组正常培养细胞,其余4组建立小梁网细胞氧化应激损伤模型[6]:实验前取过氧化氢225 μL,溶于完全培养基1 mL中,混匀,制备100 μmol·L-1过氧化氢培养基混合液。小梁网细胞以50 mg·mL-1蛋白酶消化,细胞密度为104个·mL-1,在24孔板内接种24 h,观察细胞进入平台期,去除原有培养基,PBS冲洗。加100 μmol·L-1过氧化氢培养基混合液1 mL,细胞培养箱培养6 h。显微镜下观察正常培养小梁网细胞、氧化应激损伤小梁网细胞形态学改变。培养后,抑制剂组以10 μmol·L-1Keap1/Nrf2信号通路抑制剂ML385处理,白花丹素联合抑制剂组以10 μmol·L-1ML385和5.0 μmol·L-1白花丹素处理,白花丹素组以5.0 μmol·L-1白花丹素处理,对照组、模型组以等量生理盐水处理,均处理24 h。
2.3 检测MDA、SOD和GPX 1
取2.2项下5组细胞进行实验。用硫代巴比妥酸法检测MDA,根据试剂盒说明书操作,记录酶标仪450、532、600 nm波长处的吸光度(A)值,计算MDA;用黄嘌呤氧化酶法检测SOD,根据试剂盒说明书操作,记录酶标仪550 nm波长处的A值,计算SOD。用酶联免疫吸附试验检测GPX 1,根据试剂盒说明书操作,记录酶标仪450 nm波长处的A值,计算GPX 1。实验重复3次。
2.4 检测细胞增殖活性
用MTT法检测。取2.2项下5组细胞进行实验,细胞密度为104个·mL-1,接种在96孔板上,观察细胞进入平台期,换无血清DMEM培养基,各组复孔数均为3,另设空白孔(仅加20 μL培养液),培养48 h。各孔加5 mg·mL-1MTT溶液20 μL,培养箱孵育1 h,振荡,除去气泡。测定各组酶标仪450 nm波长处的A值,评估细胞增殖活性。
2.5 检测细胞凋亡率
用流式细胞仪检测。取2.2项下5组细胞进行实验,接种在96孔板上,各组复孔数均为3。观察细胞贴壁后,加胰酶消化。以EP管收集细胞,PBS清洗。各管加1×binding buffer 200 μL,重悬细胞。细胞重悬液加Annexin V-PE细胞凋亡检测试剂5 μL,避光孵育10 min。各管加7-AAD 5 μL,吹打混匀。用流式细胞仪检测细胞凋亡数,计算细胞凋亡率。细胞凋亡率=(凋亡细胞数量/总细胞数)×100%。
2.6 检测活性氧
用活性氧特异荧光探针DCFH-DA检测。取2.2项下5组细胞进行实验,细胞密度为104个·mL-1,接种在6孔板内,各组复孔数均为3。观察细胞贴壁后,加DCFH-DA溶液(10 μmol·L-1),37 ℃避光孵育20 min。未进入细胞的DCFH-DA以无血清培养基清洗。各孔加入2.5 g·L-1胰蛋白酶消化,制成细胞悬液,用流式管收集。用流式细胞仪测定各组DCF荧光强度,评估活性氧水平。
2.7 检测Keap1、Nrf2、ARE蛋白的相对表达量
用蛋白质印迹法检测Keap1、Nrf2、ARE蛋白的相对表达量。取2.2项下5组细胞,加蛋白裂解液200 μL,冰上裂解,离心,取上清液。考马斯亮蓝法进行蛋白定量,加2×上样缓冲液,沸水浴10 min,变性。100 g·L-1聚丙烯酰胺凝胶电泳,转PVDF膜,脱脂奶粉封闭1 h。4 ℃下加兔抗人Keap1(1∶1 000)、Nrf2(1∶1 000)和ARE(1∶1 000)一抗,孵育,过夜,洗膜。37 ℃下加入山羊抗兔二抗IgG(1∶2 500),摇床孵育2 h,洗膜。加入ECL发光液进行显影反应,以Scion Image图像分析系统分析各条带的灰度值。蛋白相对含量=各蛋白条带的灰度值/β-actin蛋白条带灰度值。实验重复3次。
2.8 统计学方法
3 结果
3.1 细胞形态
镜下显示,正常培养小梁网细胞外形呈梭形,细胞贴壁、伸展,折光性良好。氧化应激损伤小梁网细胞大多呈圆卵形、多皱缩、悬浮在培养液内。见图1。
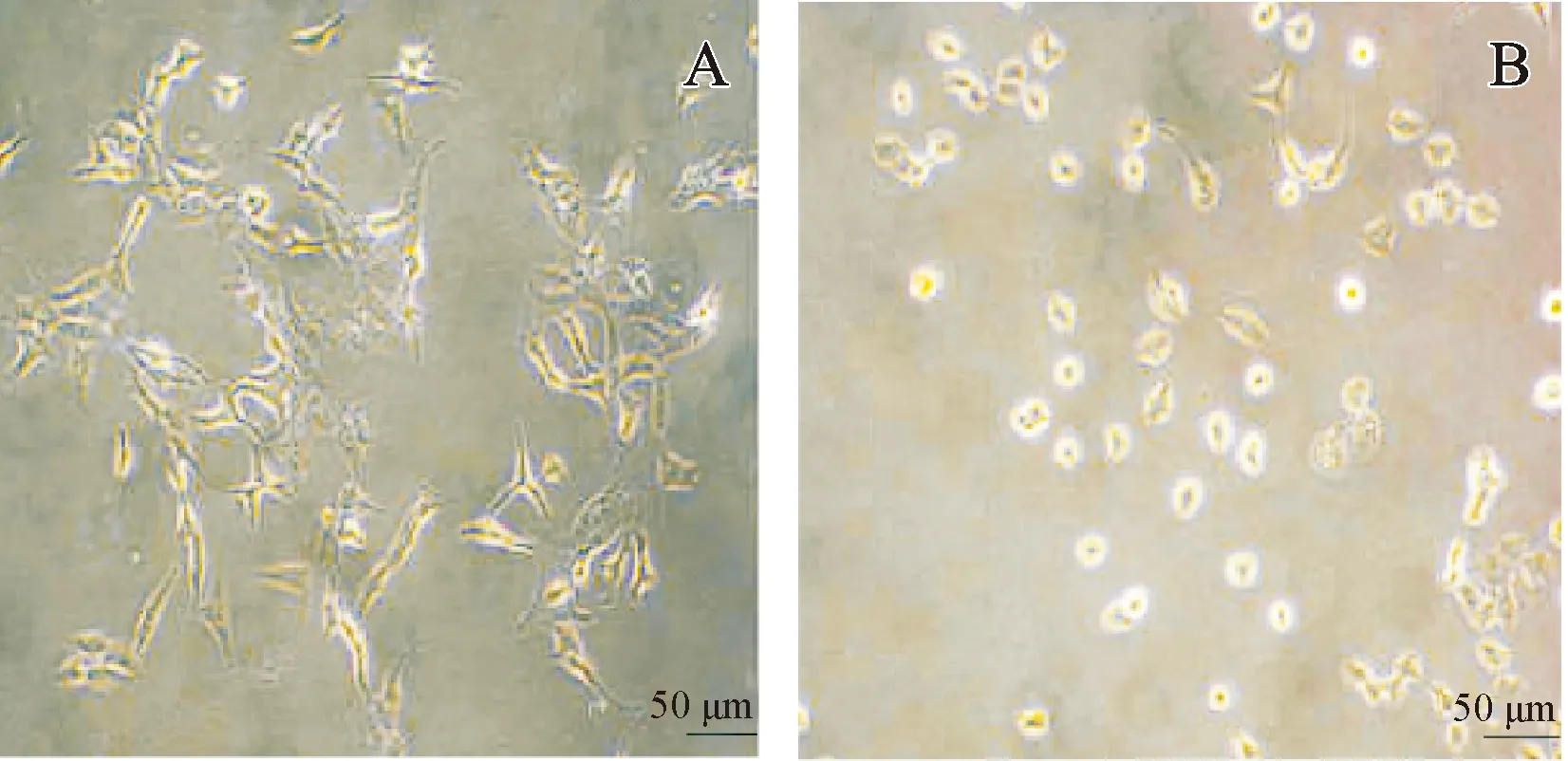
注:A.正常培养小梁网细胞;B.氧化应激损伤小梁网细胞。
3.2 MDA、SOD和GPX 1水平
各组间MDA、SOD和GPX 1水平比较,差异有统计学意义(P<0.01)。与对照组比较,其他4组MDA的水平均升高(P<0.01),SOD的水平均降低(P<0.01),GPX 1的水平均降低(P<0.01)。与抑制剂组比较,模型组、白花丹素联合抑制剂组和白花丹素组MDA的水平均降低(P<0.01),SOD与GPX 1的水平均升高(P<0.01)。与模型组比较,白花丹素联合抑制剂组、白花丹素组MDA水平降低(P<0.01),GPX 1水平升高(P<0.01),而且白花丹素组3项水平的变化更显著(P<0.01)。见表1。
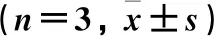
表1 各组MDA、SOD和GPX 1水平比较
3.3 细胞增殖活性
各组间细胞增殖活性比较差异有统计学意义(P<0.01)。与对照组比较,其他4组细胞增殖活性均升高(P<0.01)。与抑制剂组比较,模型组、白花丹素联合抑制剂组和白花丹素组的细胞增殖活性均降低(P<0.01)。与模型组比较,白花丹素联合抑制剂组、白花丹素组的细胞增殖活性均降低(P<0.01),白花丹素组的细胞增殖活性最低(P<0.01)。见表2。
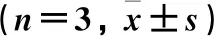
表2 各组A值的比较
3.4 细胞凋亡率
各组间细胞凋亡率比较差异有统计学意义(P<0.01)。与对照组比较,其他4组的细胞凋亡率均升高(P<0.01)。与抑制剂组比较,模型组、白花丹素联合抑制剂组和白花丹素组的细胞凋亡率均降低(P<0.01)。与模型组比较,白花丹素联合抑制剂组、白花丹素组的细胞凋亡率降低(P<0.01),白花丹素组的细胞凋亡率最低(P<0.01)。见图2、表3。
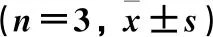
表3 各组细胞凋亡率的比较

注:A.对照组;B.抑制剂组;C.模型组;D.白花丹素联合抑制剂组;E.白花丹素组。
3.5 活性氧
各组间的活性氧水平比较差异有统计学意义(P<0.01)。与对照组比较,其他4组活性氧的水平均升高(P<0.01)。与抑制剂组比较,模型组、白花丹素联合抑制剂组和白花丹素组活性氧的水平均降低(P<0.01)。与模型组比较,白花丹素联合抑制剂组、白花丹素组活性氧的水平降低(P<0.01),白花丹素组活性氧的水平最低(P<0.01)。见表4。
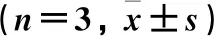
表4 各组活性氧水平的比较
3.6 Keap1、Nrf2和ARE蛋白的相对表达量
各组间Keap1、Nrf2和ARE蛋白相对表达量比较差异有统计学意义(P<0.01)。与对照组比较,其他4组Keap1蛋白的相对表达量升高(P<0.01),Nrf2蛋白的相对表达量降低(P<0.01),ARE蛋白的相对表达量降低(P<0.01)。与抑制剂组比较,模型组、白花丹素联合抑制剂组和白花丹素组Keap1蛋白的相对表达量均降低(P<0.01),Nrf2与ARE蛋白的相对表达量均升高(P<0.01)。与模型组比较,白花丹素联合抑制剂组、白花丹素组Keap1蛋白的相对表达量降低(P<0.01),Nrf2与ARE蛋白的相对表达量升高(P<0.01),而且白花丹素组3项水平的变化更显著(P<0.01)。见图3、表5。
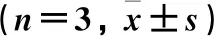
表5 各组Keap1、Nrf2、ARE蛋白的相对表达量比较

注:A.对照组;B.抑制剂组;C.模型组;D.白花丹素联合抑制剂组;E.白花丹素组。
4 讨论
青光眼是一种以视神经萎缩和视野缺损为特征的疾病,虽然高眼压为导致其发病的主要因素,但目前研究也发现一些协同致病因素,如血管异常、一氧化氮代谢异常和由氧自由基过多引发的氧化应激损伤等[7-8]。氧化应激损伤可导致小梁网细胞出现与青光眼类似的改变,而预先用抗氧化药物处理可减弱这些改变[9]。
白花丹为我国传统中药之一,可祛风除湿、消肿散瘀、解毒消疮、活血化瘀,具有抗炎、抗氧化应激和抗肿瘤等作用[10]。白花丹素为白花丹的有效成分之一,其醌环结构内酚羟基可通过中断油脂氧化过程发挥抗氧化应激作用[11]。白花丹素可减轻肝损伤大鼠血清氧化应激反应,其作用机制可能与白花丹素提高肝细胞抗氧化的能力有关[12]。研究显示[13],白花丹素可抑制免疫球蛋白A肾病大鼠活性氧的形成,减轻氧化应激反应,抑制肾脏组织细胞凋亡。还有学者提出[14],白花丹素可抑制视网膜色素上皮细胞增殖,有效预防、治疗增殖性玻璃体视网膜病变,但目前就白花丹素对青光眼小梁网细胞氧化应激损伤的作用尚无明确定论。本研究结果显示,用白花丹素处理后的细胞MDA水平降低,SOD、GPX 1水平升高,细胞增殖活性、细胞凋亡率降低,活性氧含量减少,表明白花丹素可减轻小梁网细胞氧化应激损伤,抑制细胞增殖、凋亡,促进细胞存活。
Keap1/Nrf2信号通路是调控机体氧化应激、维持氧化还原平衡的重要通路,其中Keap1为细胞氧化应激反应中的重要调控因子,Nrf2是细胞内氧化应激反应的关键协调者,可维持细胞氧化-抗氧化平衡[15-16]。一旦出现氧化应激损伤,Keap1内半胱氨酸残基出现修饰,可改变Keap1构象,导致Nrf2易位到细胞核,并与ARE结合,调节抗氧化酶表达,对抗氧化应激损伤。Keap1表达上调可导致Nrf2活性及稳定性降低,增强氧化应激反应[17]。黄金玲等[18]提出,通过调控Keap1、Nrf2表达,可增强糖尿病大鼠视网膜抗氧化能力,保护视网膜神经节细胞。研究显示[19],白花丹素可通过调控Nrf2通路发挥抗氧化作用。另外,王晓莉等[20]研究还发现,老年性青光眼患者小梁网组织中Keap1呈高表达,Nrf2、ARE呈低表达,其表达水平与氧化应激状态有关。
本研究中,与对照组比较,模型组Keap1蛋白的相对表达量升高,Nrf2、ARE蛋白的相对表达量降低,与上述研究结果一致,表明Keap1/Nrf2信号通路可能在青光眼小梁网细胞氧化应激损伤中发挥一定作用,推测激活Keap1/Nrf2/ARE信号通路可能有利于控制病情的发展。本研究结果还显示,用白花丹素处理后的细胞Keap1蛋白的相对表达量降低,Nrf2、ARE蛋白的相对表达量升高,并通过Keap1/Nrf2通路抑制剂得到进一步验证,表明白花丹素可激活Keap1/Nrf2信号通路,推测是白花丹素缓解小梁网细胞氧化应激损伤的重要作用机制之一。
综上所述,白花丹素可缓解小梁网细胞氧化应激损伤,调节细胞增殖、凋亡,其作用机制可能与激活Keap1/Nrf2信号通路有关。本研究局限之处在于仅分析了白花丹素通过Keap1/Nrf2信号通路发挥的作用,今后仍需进一步深入分析。
