高内涵分析系统联合激光扫描共聚焦显微镜观察细胞间隧道纳米管*
2023-07-19潘鹏宇赵秋宇王英王建波李想刘春英王淳
潘鹏宇 赵秋宇 王英 王建波 李想 刘春英 王淳**
(1)辽宁中医药大学中西医结合学院,沈阳 110847;2)辽宁中医药大学中医脏象理论及应用教育部重点实验室,沈阳 110847;3)珀金埃尔默企业管理(上海)有限公司,上海 201203)
隧道纳米管(tunneling nanotubes,TNTs)是存在于细胞间的细长膜管状结构,又称膜纳米管,主要由肌动蛋白、微丝和微管组成,直径大多在50 nm至几微米,长度约几十到数百微米[1-2]。TNTs作为一种新的细胞间相互作用方式,可将不同细胞的质膜和胞质连接在一起,实现不同细胞成分的远距离直接转运,完成生物信息交换[3]。TNTs可转运物质多样,包括如Ca2+、线粒体、高尔基囊泡、溶酶体、病毒、外泌体、蛋白质、microRNA和siRNA等[4-8]。TNTs直接且精准的转运功能使其在信号转导、免疫应答、凋亡、纳米与微米颗粒转运、胚胎形成与发育、细胞分化、代谢重编程、病原体传播、神经退行性病变、肿瘤发生与发展等生理、病理过程中发挥重要作用[9-10]。对于肿瘤细胞而言,TNTs可提高其增殖和侵袭、迁移能力,促进肿瘤细胞存活,并可通过线粒体的转运增加肿瘤细胞的氧化磷酸化和ATP生成以应对不利的环境压力[11]。此外,对于肿瘤血管生成、放化疗耐药,TNTs也发挥了重要作用[12]。其中,在肺腺癌的以往研究发现,利用转盘共聚焦显微镜可探明TNTs内转运物质包括囊泡、蛋白质和线粒体,可测量TNTs长度及直径(长度:大于70 μm;直径:400~1 500 nm),该结果与本研究相一致[13-14]。
目前,可以利用激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM)、扫描电子显微镜(scanning electron microscope,SEM)测量TNTs长度、观察TNTs表面结构,也可以利用透射电子显微镜(transmission electron microscope,TEM)观察TNTs内物质转运种类,利用光电融合成像技术(correlative light and electron microscopy,CLEM)可更精细地观察TNTs内运输物质如囊泡等的超微结构以及TNTs的超微结构与转运特点[15-17]。本研究利用高内涵分析系统(high content analysis system,HCA)结合LSCM观察TNTs形态学特征,捕获TNTs动态形成过程,观察经由TNTs的细胞间物质转运动态过程,并探究TNTs转运物质在数量和分布上的特点。LSCM是传统经典的高分辨率显微成像方法,其采用激光光源,结合单孔共聚焦成像方式,配合高数值孔径(NA)物镜成像可达到光学显微镜分辨率的极限,即200 nm左右。但LSCM也有不适用的情况,如普通的LSCM由于成像时间长、光毒性和光漂白作用强,应用于活细胞动态成像效果不佳[18-19]。HCA是新兴的显微成像和分析技术,它结合了高通量筛选技术的效率和细胞影像学技术的成像与分析能力,能从复杂生物系统中快速收集丰富的定量数据[20]。HCA往往使用转盘共聚焦光路结合水浸式物镜系统以实现高分辨率成像,具有成像速度快(成像时间以毫秒为单位)并保证成像质量和细胞活性特点,利用高NA物镜成像也可达到光学显微镜分辨率的极限。同时,HCA搭载的环境控制系统更利于活细胞动态拍摄和追踪[21-22]。因此,本研究选用HCA结合LSCM实现TNTs的形态、形成机制和功能的观察。
1 材料与方法
1.1 细胞与试剂
人肺腺癌A549细胞、顺铂耐药A549/DDP细胞购自中国医学院肿瘤研究中心;顺铂(cisplatin,Cis-DDP)(货号:PHR1624),德国Sigma公司;胎牛血清(fetal bovine serum,FBS)(货号:FB25015),美国Clark公司;McCoy’s 5A培养液(批号:WG210224C),北京中生奥邦生物科技有限公司;DMEM/F12培养液(批号:20210301),赛文创新(北京)生物科技有限公司;0.25%胰蛋白酶(批号:25200-056),美国Gibco公司;青霉素和链霉素(批号:SV30010),美国Hyclone公司;小麦胚芽凝集素和Alexa Fluor 488偶联物(wheat germ agglutinin Alexa Fluor 488 conjugate,WGA-488)(批号:2260867),美国Invitrogen公司;Vybrant DiD细胞标记溶液(Vybrant DID celllabeling solution,DID)(批号:2246612),美国Invitrogen公司;Hoechst 33342染色液(批号:20210507),中国北京索莱宝科技有限公司等。
1.2 实验方法
1.2.1 细胞培养
A549、A549/DDP细胞于37℃、湿度95%、CO2浓度5%条件下,分别在含10% FBS和100 U/ml青霉素、100 mg/L链霉素的DMEM/F12或McCoy’s 5A培养液中进行培养。A549/DDP细胞于1 μmol/L顺铂环境下持续培养以保持其耐药性,并于实验前2周更换为无顺铂的完全培养液用于后续实验[23]。
1.2.2 荧光染色、分组及药物干预
收集A549或A549/DDP细胞,调节细胞密度至1.0×106/ml。A549细胞以WGA-488偶联物+Hoechst 33342荧光染料染色(终浓度分别为8 mg/L、10 mg/L,37℃共孵育15 min);A549/DDP细胞以DiD+Hoechst 33342荧光染料染色(终浓度分别为5 μmoL/L、10 mg/L,37℃共孵育15 min);并互换荧光染料对A549与A549/DDP细胞进行染色。染色后的细胞经不含钙离子、镁离子、酚红的PBS洗涤,按下列方式接种于24孔TCT细胞培养板(Beaver公司)或15 mm共聚焦皿(NEST公司)中:a. A549细胞单独培养,2.0×105/孔;b. A549/DDP细胞单独培养,2.0×105/孔;c. A549与A549/DDP细胞按1∶1混合培养,细胞密度2.0×105/孔。继续孵育4 h待细胞贴壁后活细胞上机观察;固定细胞拍摄在染色后培养48 h结束时进行,采用4%多聚甲醛固定10 min,经D-PBS洗涤并加入抗荧光衰减封片剂上机。
1.3 高内涵分析系统实验参数设置
1.3.1 仪器型号
高内涵分析系统:PerkinElmer High Content Analysis System Operetta CLS。
1.3.2 系统参数设置
明场拍摄仪器设置如下。物镜:20×Air. NA 0.4;自动对焦:Two Peak(Default);拍摄模式:Non-Confocal,Binning:2;通道:Brightfield、Digital Phase Contrasts;单孔视野数量:246 Field;拍摄首层:-9.0 μm;拍摄层数:3;层数间隔:1.5 μm;单次拍摄循环时间:30 min;拍摄总时长48 h。
荧光拍摄仪器设置如下。物镜:20×Air. NA 0.4;自动对焦:One Peak(Default);拍摄模式:Confocal,Binning:2;通道:Brightfield、DID(Ex644/Em665)、Alexa Fluor 488、Hoechst 33342;单孔视野数量:58 Field;拍摄首层:-7.0 μm;拍摄层数:3;层数间隔:1.5 μm;单次拍摄循环时间:7~8 min;拍摄总时长48 h。
1.4 激光扫描共聚焦显微镜实验参数设置
1.4.1 仪器型号
激光扫描共聚焦显微镜:OLYMPUS FV10i。
1.4.2 参数设置
拍摄设置如下。物镜:60× NA1.35油浸物镜;通道选择:Hoechst 33342、Alexa Fluor 488、DID、Phase contrast;Acquire Map Image成像通道:Alexa Fluor 488、DID;各通道光敏感度依次:49.6%、49.6%、41.6%、36.6%;各通道激光强度依次:68.3%、51.1%、27.9%、默认;扫描像素:1 024×1 024;扫描层数:15~20层;层间间隔1 μm;单通道扫描时间:约00:00:26.0;总扫描时间:约00:26:40.4。
1.5 TNTs 三维重构
应用IMARIS 9软件对激光扫描共聚焦显微镜成像图片进行细胞表面三维重构,并对细胞核荧光信号进行透明化处理。利用Sport工具标记供体细胞经TNTs转运的荧光信号,观察被转运囊泡在受体细胞内的分布情况。
1.6 TNTs统计分析
TNTs形成指数即每100个细胞的TNTs数[17],TNTs直径、长度和形成指数统计应用高内涵软件Harmony 4.1采集5个随机时间点视野进行记录。整理数据,采用GraphPad Prism 9 软件对其处理,计量资料以表示,两组间比较采用独立样本t检验(数据符合正态分布且方差齐)。以P<0.05为差异具有统计学意义。
2 结果
2.1 HCA观察TNTs形成过程
应用高内涵分析系统拍摄到A549/DDP细胞间由细胞接触-膜融合-细胞反向易位-胞膜融合区拉长变细机制形成TNTs的全过程(即接触分离机制形成TNTs)(图1)。同时,应用高内涵分析系统分别在5个随机时间点采集图像,观察同种肿瘤细胞间TNTs形成情况。结果显示:单独培养的A549细胞,当细胞密度较高、距离较近时可观察到TNTs形成,TNTs平均长度为14.71 μm,平均直径为2.27 μm,TNTs形成指数为4;与A549细胞相比,单独培养的A549/DDP细胞,在细胞密度较低、距离较远时即可观察到TNTs形成,且形成TNTs更多,TNTs形成指数为11(P<0.001),TNTs结构更粗、长,平均长度为25.44 μm,平均直径为2.59 μm(图2)。
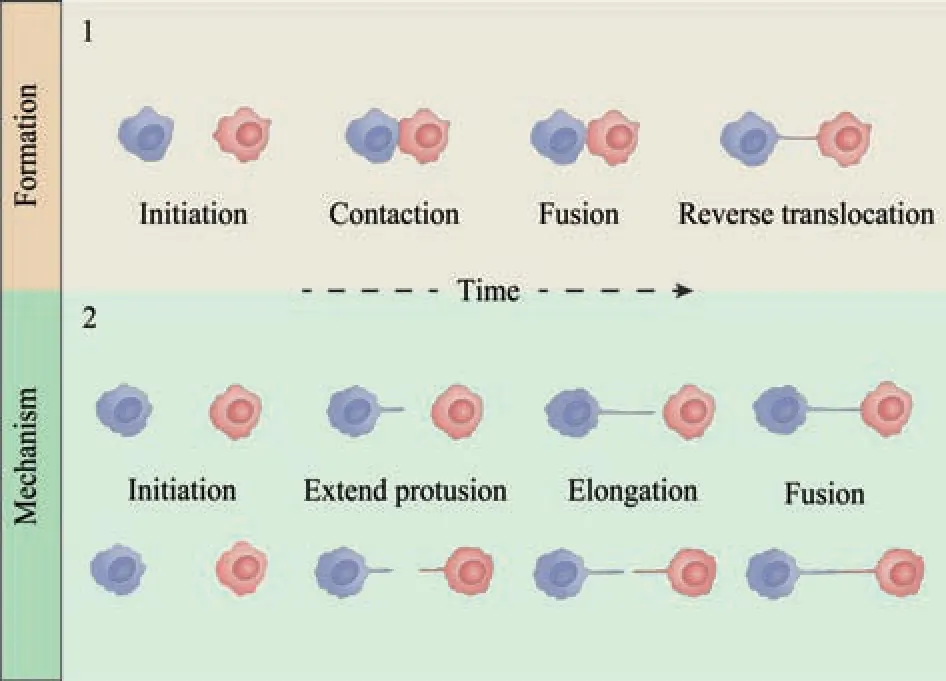
Fig. 1 Pattern diagram of formation mechanism of tunneling nanotubes
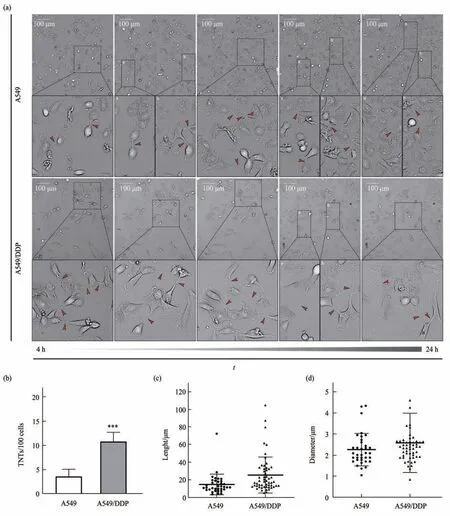
Fig. 2 Observation of intercellular TNTs by high content analysis system

Fig. 3 Observation on the dynamic formation of TNTs by high content analysis system

Fig. 4 Structural Characteristics of TNTs Observed by LSCM
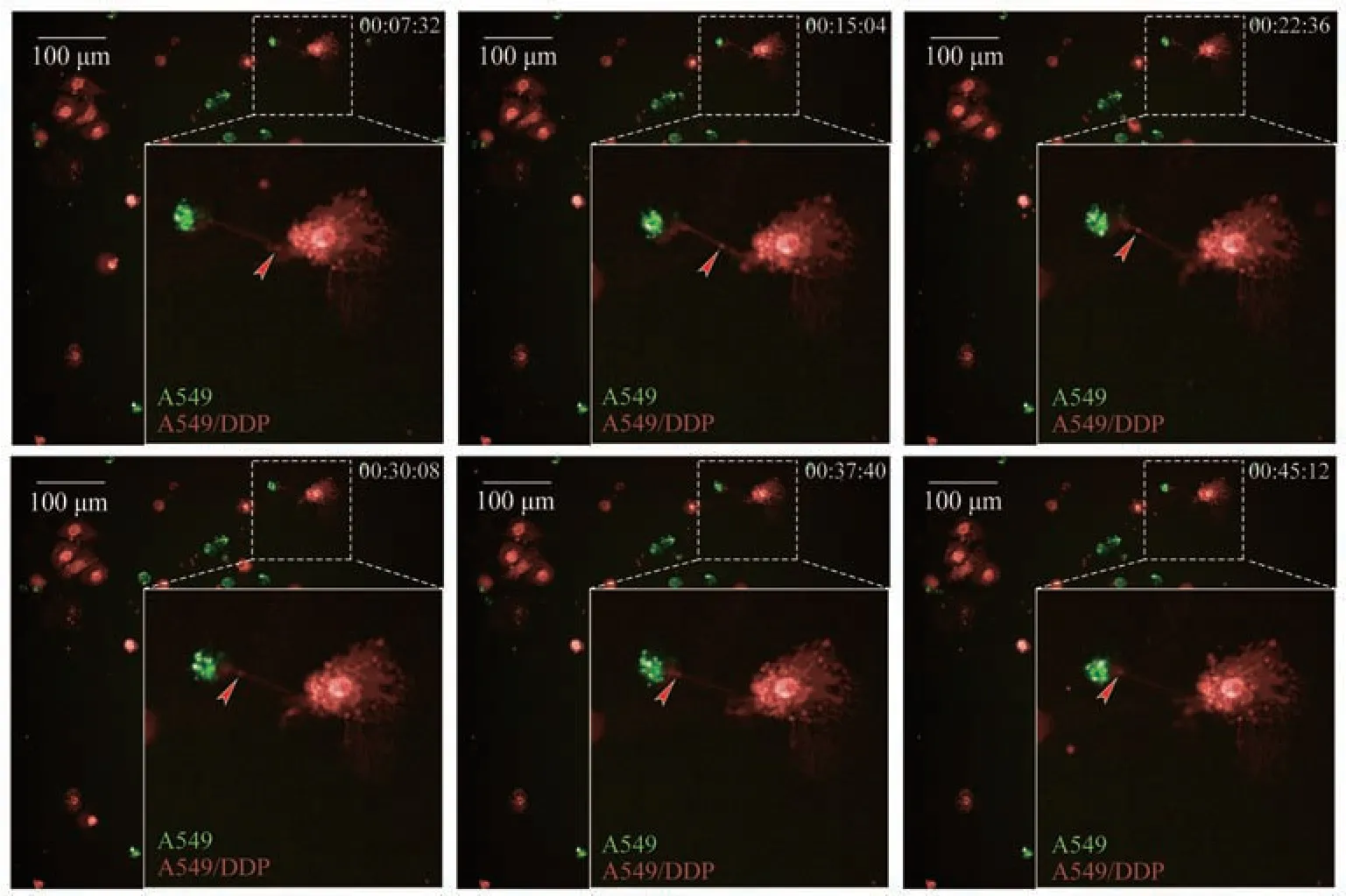
Fig. 5 The material transport through tunnel nanotubes observed by high content imaging system
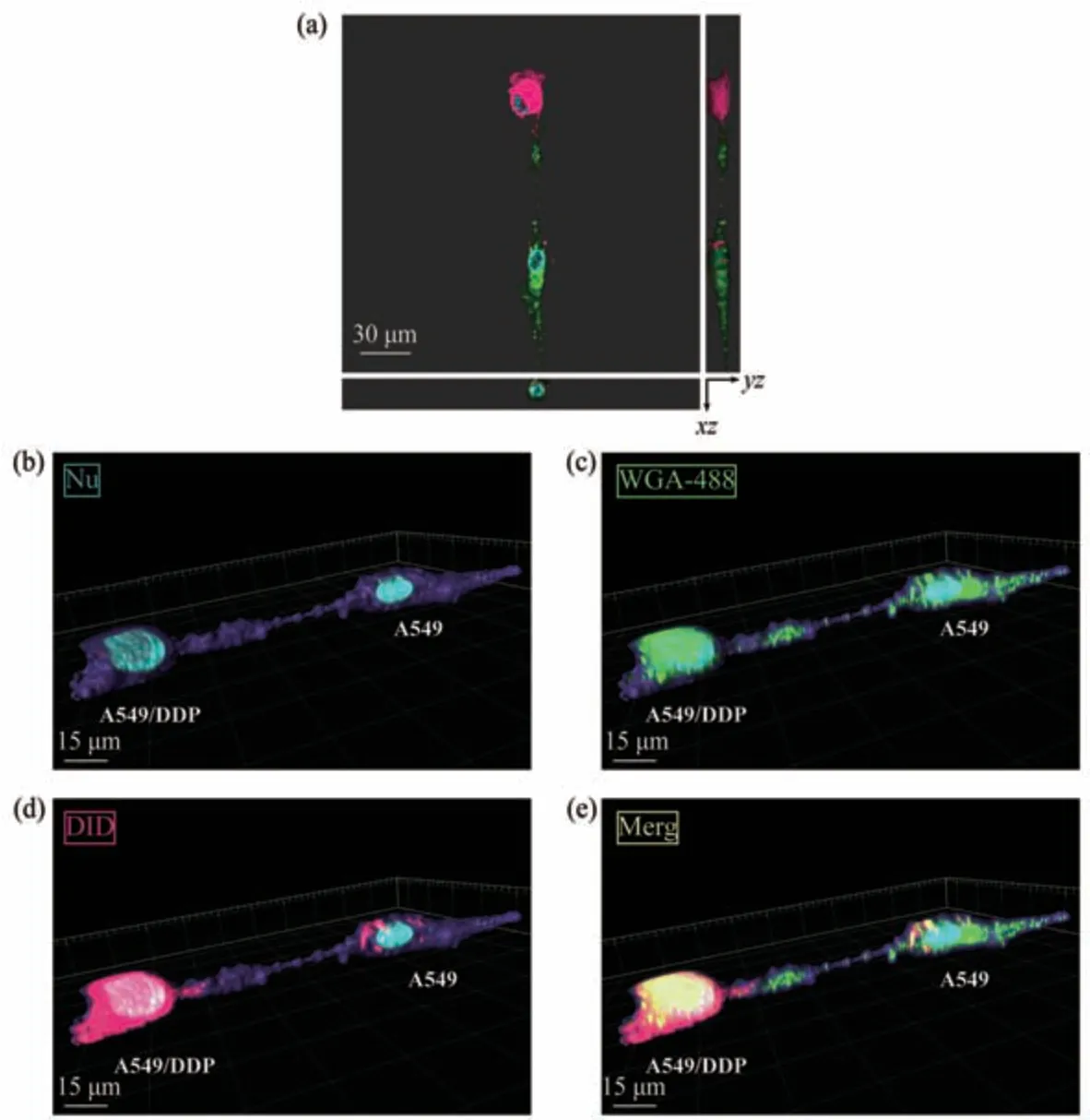
Fig. 6 Observation on the bidirectional material transport Function of TNTs by LSCM imaging 3D reconstruction

Fig. 7 TNTs material transportation analyzed by LSCM imaging 3D reconstruction

Fig. 8 Observation of transported vesicles distribution in recipient cells by LSCM imaging 3D reconstruction
0~8 min时,标记了红色荧光的两个A549/DDP细胞彼此接近;16 min时,两细胞胞膜接触;16~72 min时,两细胞胞膜接触面积进一步增加;72~136 min时,两细胞逐渐分离,并在144 min时形成TNT结构;144~224 min时,TNT不断拉长变细,直至232 min时消失。TNT全程存在80 min(图3,图S1)。图3a说明了TNTs接触分离的形成机制;图3b,c说明了胞膜接触面积增大之后再分离才能形成TNTs,我们在其他视野观察中发现有细胞短暂、小面积的接触并不会形成TNTs;图3d展示了TNTs形成并消失后细胞的状态。图S1是从各个时间点或时间段的细胞接触,胞膜接触面积增加、减少,TNTs存在时间,以及TNTs消失是突然远距离中断等完整地呈现了TNTs形成全过程,可以使后续的研究者整体上把控TNTs形成阶段并在早期区分是否有TNTs形成趋向。
2.2 LSCM观察TNTs三维结构及TNTs囊泡物质运输
进一步利用LSCM观察不同亚型肿瘤细胞间形成的TNTs结构。图4a所示为A549/DDP细胞(绿色荧光)伸向A549细胞(红色荧光)的TNTs结构。为了排除不同荧光探针标记原理所产生的差异互换荧光标记物,图4b所示为A549细胞(绿色荧光)伸向A549/DDP细胞(红色荧光)的TNTs结构。由此可见,不同亚型的肿瘤细胞间可以形成TNTs。此外,还观察到了由A549细胞(红色荧光)发出的丝状伪足样膜凸起正伸向A549/DDP细胞(绿色荧光),以细胞膜凸起-膜凸起丝状伪足样拉长-膜凸起与其他细胞膜融合机制形成TNTs(即以丝状伪足样膜凸起伸出后融合的方式形成TNT)(图4c,图1)。
进一步利用IMARIS软件对TNTs结构进行三维观察,图4所示yz视野下可观察到悬浮于基质的典型TNTs结构特征,且通过xy与yz视野还可清晰地观察到TNT中运送的囊泡物质(图4a,b)。
2.3 HCA联合LSCM分析TNTs囊泡转运功能
利用高内涵分析系统进行延时拍摄,不仅可以观察TNTs的形成,还可观察TNTs内囊泡物质的动态转运。图5中观察到由A549/DDP细胞(红色荧光)发出TNT伸向A549细胞(绿色荧光),此时A549/DDP、A549细胞可分别被称为供体细胞和受体细胞。7'32''~22'36'',可观察到来源于供体A549/DDP细胞的红色囊泡在TNT内快速转运至受体A549细胞,30'8''~45'12'',囊泡在TNT内转运速率大幅下降,这表明A549/DDP作为供体细胞向受体A549细胞转运囊泡物质的速率随转运过程由快至慢。由此可见,通过HCA延时拍摄成像可进一步在动态观察中明确TNTs物质转运功能在物质运送方向、运输速率方面的特性。
利用LSCM拍摄图像进行三维重建,可观察到TNTs的双向物质转运功能。例如,对图6a(即图4b)中层扫的细胞图像进行三维重建:a. 首先,开放Hoechst 33342通道并重构细胞表面,可见蓝色荧光标记的细胞核及由胞膜包裹的细胞轮廓(图6b),此时可清晰观察到连接两细胞间(A549及A549/DDP)悬浮于基质的TNT结构;b. 开放Hoechst 33342及WGA-488通道,可见供体A549细胞(WGA-488偶联物标记,绿色荧光)内的物质(绿色荧光)通过TNT进入受体A549/DDP细胞中(图6c);c. 开放Hoechst 33342及DID通道,可见供体A549/DDP细胞(DID标记,红色荧光)内的物质(红色荧光)通过TNT进入受体A549细胞中(图6d);d. 开放所有通道(即Hoechst 33342、WGA-488及DID通道),则全面观察到TNT形成后细胞间双向的物质运输情况(图6e)。
利用IMARIS软件进一步量化TNTs囊泡转运功能,比较LSCM图像中TNT直径与不同点状荧光信号斑直径大小,根据两者比值选择合适直径荧光信号斑作为实际可被转运的囊泡。本次研究对图6进行分析,选择荧光信号直径为2.0 μm,并用软件Quality功能过滤杂信号,最终将两种荧光信号量化成数目不等的球体(红色球体代表DID荧光标记的囊泡、绿色球体代表WGA-488荧光标记的囊泡)(图7a~d)。量化结果显示,a. 供体A549细胞向受体A549/DDP细胞的物质运输:图7a,c显示,源于供体A549细胞的绿色小球体共109个,其中在TNT管内15个,占总绿色球体的14%,转运进受体A549/DDP细胞内38个,占总绿色球体的35%,剩余在供体A549细胞中56个,占总绿色球体的51%。通过上述三维建模分析,可知供体A549细胞内约49%(即35%+14%)的物质已转运/正转运至受体A549/DDP细胞中(图7e,f,c)。b. 供体A549/DDP细胞向受体A549 细胞的物质运输:图7b,d显示,源于供体A549/DDP细胞的红色小球体共82个,其中在TNT管内4个,占总红色球体的5%,转运进受体A549细胞内17个,占总红色球数的21%,剩余在供体A549/DDP细胞内61个,占总红色球体的74%。通过上述三维建模分析,可知供体A549/DDP细胞内约26%(即21%+5%)的物质已转运/正转运至受体A549 细胞中(图7e,f,d)。综合上述三维建模分析可知,在A549与A549/DDP细胞的双向转运中,以供体A549 细胞向受体A549/DDP 细胞的转运方向为优势转运方向,相比于A549/DDP细胞,A549细胞在囊泡物质转运的数量和比例上更高。
此外,对LSCM成像进行三维重建进行后续处理,还可观察转运物质在受体细胞内的分布情况。在图8a的三维图像基础上对细胞核进行透明处理(图8b),并沿TNT长轴与两细胞核中心相交做斜切面分为上、下两个空间,观察转运物质在两受体细胞内的分布情况:a. 受体A549/DDP细胞中,由A549细胞转运来的物质(绿色球体)主要分布在细胞膜膜下、细胞质以及核膜周围(图8c,d);b. 受体A549细胞中,由A549/DDP细胞转运来的物质(红色球体)仅分布于细胞膜膜下(图8e,f)。
综上,HCA可观察到TNTs动态的形成机制和物质转运,LSCM成像进行三维重建与建模分析,可获知物质在TNTs内双向转运的特点,可量化转运物质的数量与比例,并可观察被转运物质在受体细胞内的分布情况。因此,HCA联合LSCM可以更好地进行TNTs观察与分析。
3 讨论
TNTs是近几年发现的一种远距离连接细胞的膜管样结构,其由脂双层包裹并以F肌动蛋白(F-actin)单独构成或与微管共同组成基本骨架,使被连接的同种或异种细胞间产生远距离的直接细胞通讯。在形态上,TNTs的直径从几十纳米到几微米,长度可跨越几个细胞达到100微米以上。由于目前尚没有明确的TNTs形成分子标志,因此悬浮于基质是TNTs区别于其他不同细胞膜样凸起结构(如丝状伪足等)的显著特征[24]。TNTs形成机制有2种:a. 相互靠近的两个细胞,细胞膜彼此接触,胞膜发生融合,随后两细胞反向易位分离,膜融合区域拉长、变细,最终形成TNTs;b. 由一个细胞单独伸出或两细胞共同伸出丝状伪足样膜凸起,当接触到对方细胞膜或丝状伪足样膜凸起后发生膜融合,形成TNTs[25]。本研究中,利用HCA清晰地捕捉到两个同种细胞(A549/DDP细胞)通过第一种方式,即接触分离机制形成TNTs的完整过程(图3,图S1),利用LSCM观察到第二种以丝状伪足样膜凸起发出再融合机制形成的TNTs,构成不同亚型肿瘤细胞间的TNT形成机制,这表明肿瘤细胞间有着两种不同的TNTs形成方式(图1)。
作为一种新的细胞间通讯方式,不仅要观察TNTs的形态学特征,还要分析TNTs的功能。TNTs长度、直径以及形成指数均可作为分析TNTs物质传递功能的评价基础,如直径大、延伸长的TNTs有利于细胞间较大物质(线粒体、高尔基体囊泡等)的远距离转运[15,26]。本研究利用HCA测量了肿瘤细胞间形成的TNTs长度、直径及形成指数,结果发现,与亲本人肺腺癌A549细胞形成的TNTs(平均长度14.71 μm、平均直径2.27 μm、TNTs指数4)相比,顺铂耐药的A549/DDP细胞间形成的TNTs(平均长度25.44 μm、平均直径2.59 μm、TNTs指数11)更长、更粗,且更广泛。该结果表明,耐药的肿瘤细胞可能具备更强的TNTs相关细胞间物质转运能力或细胞通讯功能。
在细胞培养过程中,如何确定细胞间形成的丝状/管状结构是TNTs?目前认为观察到细胞间形成悬浮于基质的膜管结构是确定TNTs形成的显著特征[1]。2004年Rustom等[27]首先利用TEM结合SEM观察到了TNTs结构,这种观察方法虽清晰地获得了TNTs三维图像,但无法区分细胞间TNTs的发出者。随后很多学者采用CLEM观察TNTs,但由于CLEM技术繁杂,存在耗时的操作步骤与交联固定剂的使用等不利因素,加之TNTs本身具有形成的随机性、形态的多变性以及结构易破坏性等特点,因此该方法对TNTs结构保存和动态观察不利[28]。此外,多色受激辐射损耗超分辨显微技术(stimulated emission depletion nanoscopy,STED Nanoscopy)也应用于TNTs的研究,但其过强的激发光会造成细胞标记荧光基团快速漂白,亦不利于TNTs的长时间动态成像观察[14,29]。本文尝试利用质膜探针染料标记细胞,采用HCA联合LSCM进行观察、拍摄,并应用IMARIS软件建模分析,观察同种或不同亚型肿瘤间TNTs形成及物质转运情况。首先,使用不同的膜结合荧光染料(DID、WGA-488)有助于判断细胞间TNTs结构的发出者,以及观察囊泡物质在TNTs中的转运及在受体细胞中的定位。其次,HCA具有通量高、成像迅速、延时拍摄时间长、光毒性低、可层扫并随机调整拍摄视野、拍摄后批量化分析的优点[30-31]。因此,利用该系统测量TNTs直径、长度,并对TNTs指数进行统计,观察到了活细胞TNTs形成机制(即接触分离机制形成TNTs)及其内部物质实时转运的动态过程。但HCA高分辨率成像时需要配备相对昂贵的水镜成像系统,且因其通量高会造成孔板不必要的浪费,因此尝试将HCA(用于活细胞成像)与LSCM(固定细胞成像)结合使用实现优势互补,以更有效、快速、经济的方式进一步观察TNTs转运过程并分析转运功能。应用IMARIS软件对LSCM采集的图像进行三维重建和建模分析,探明了TNTs的另一种形成机制(即以丝状伪足样膜凸起伸出后再融合形成TNT的机制),确定了经TNTs的转运优势方向、转运效率及转运物质在受体细胞内的空间分布情况。
4 结论
综上所述,利用HCA联合LSCM可有效观察TNTs结构、形成机制、内部物质(如囊泡)转运特点及物质被转运后在受体细胞内的分布特点。同时HCA联合LSCM观察TNTs结构与功能还具有经济、便利的优势,有利于在细胞形态学实验中推广使用。
附件见本文网络版(http://www.pibb.ac.cn或http://www.cnki.net):
PIBB_20220453_Figure S1.pdf
数据可用性声明本论文的关联数据(DOI: 10.57760/sciencedb.06337/CSTR: 31253.11.sciencedb.06337)可在Science Data Bank数据库(https://www.scidb.cn/)中访问获取。其中*.ims文件的打开软件为Imaris,*.pzfx文件的打开软件为Graphpad Prism。