卟啉金属有机骨架材料在肿瘤治疗中的应用*
2023-07-19尚静胡欣赵瑞楠齐琪龚雪宣扬权春善张艳梅
尚静 胡欣 赵瑞楠 齐琪 龚雪 宣扬权春善 张艳梅**
(1)大连民族大学生命科学学院,大连 116600;2)生物技术与资源利用教育部重点实验室(大连民族大学),大连 116600)
目前,肿瘤已经成为人类健康的主要威胁之一,每年全球发病率持续上升。在临床上,肿瘤治疗常用的方法为放疗法和化疗法,上述治疗方法虽然能在一定程度上抑制肿瘤的生长和转移,但对大多数恶性肿瘤的效果不佳[1]。而且,在药物递送过程中,因缺乏靶向性,在杀死肿瘤细胞的同时,也对周围正常的组织细胞造成严重破坏[2]。近期研究发现,相对于单一治疗模式,多模式协同治疗策略效果更强,生物安全性更高[3-4]。因此,通过构建智能响应型多功能纳米载药系统实现肿瘤精准诊断和治疗成为研究热点。
纳米药物传递体系能够克服游离药物的许多缺陷,明显改善药代动力学和药物的药效学,增强药物在血液循环中的稳定性、降低毒副作用、增强靶向性和控制释放能力[4-5]。而且,通过对纳米载体的表面进行改性或修饰,可以延长纳米药物在血液循环中的滞留时间,或者提高纳米药物载体的靶向传递能力,并利用细胞内外因素实现刺激响应型药物控释等,从而实现肿瘤精准诊断和治疗[4-5]。刺激响应型纳米药物传递系统可动态响应内源性肿瘤微环境刺激或外源性特定刺激信号,从而使被转运的药物在时间和空间上进行可控释放。肿瘤细胞的刺激信号可以分为两大类:内源性组分和外源性信号。内源性组分是指在肿瘤细胞内部的低pH、过度表达的酶、氧化还原物质等,它们代表着肿瘤组织内细胞代谢过程中所产生的物质和特异标记物。外源性信号主要是通过外部施加的物理刺激,如超声、磁共振、光等,以促进从纳米载药系统中“按需(on-demand)”释放有效成分[6]。
卟啉金属有机骨架(mental-organic frameworks,MOFs)材料是由金属离子或金属离子簇与卟啉类配体通过配位键自组装成的高度有序的新型有机无机杂化材料。由于卟啉独特的结构和光吸收特点,使得该材料在应用过程中会展示出优于一般MOFs的特性。将卟啉与金属有机骨架结合,既可以保持卟啉分子的单分散状态,避免卟啉分子的聚集和自猝灭[7]。同时,卟啉MOFs材料的多孔性有助于单线态氧(1O2)的扩散,从而展现更优越的光动力治疗效果[8]。而且,卟啉MOFs具有较好的生物相容性、比表面积大、多孔性,可以实现药物载体联合用药和主动肿瘤靶向性。特别是,卟啉MOFs展现出多种模拟酶活性,不仅可以作为药物载体和光敏剂,还可以作为仿生催化剂参与肿瘤治疗[9-11]。因此,基于卟啉MOFs的智能响应型多功能纳米载药系统成为研究热点,取得了许多重要研究进展。本综述从刺激响应型治疗策略的视角,介绍了近年来基于卟啉MOFs的肿瘤治疗和诊断新策略(图1),特别是基于内源性组分、外源性组分响应的刺激响应型纳米平台在肿瘤联合治疗和诊断中的最新研究成果,同时讨论了卟啉MOFs在生物医学应用中面临的挑战和前景。
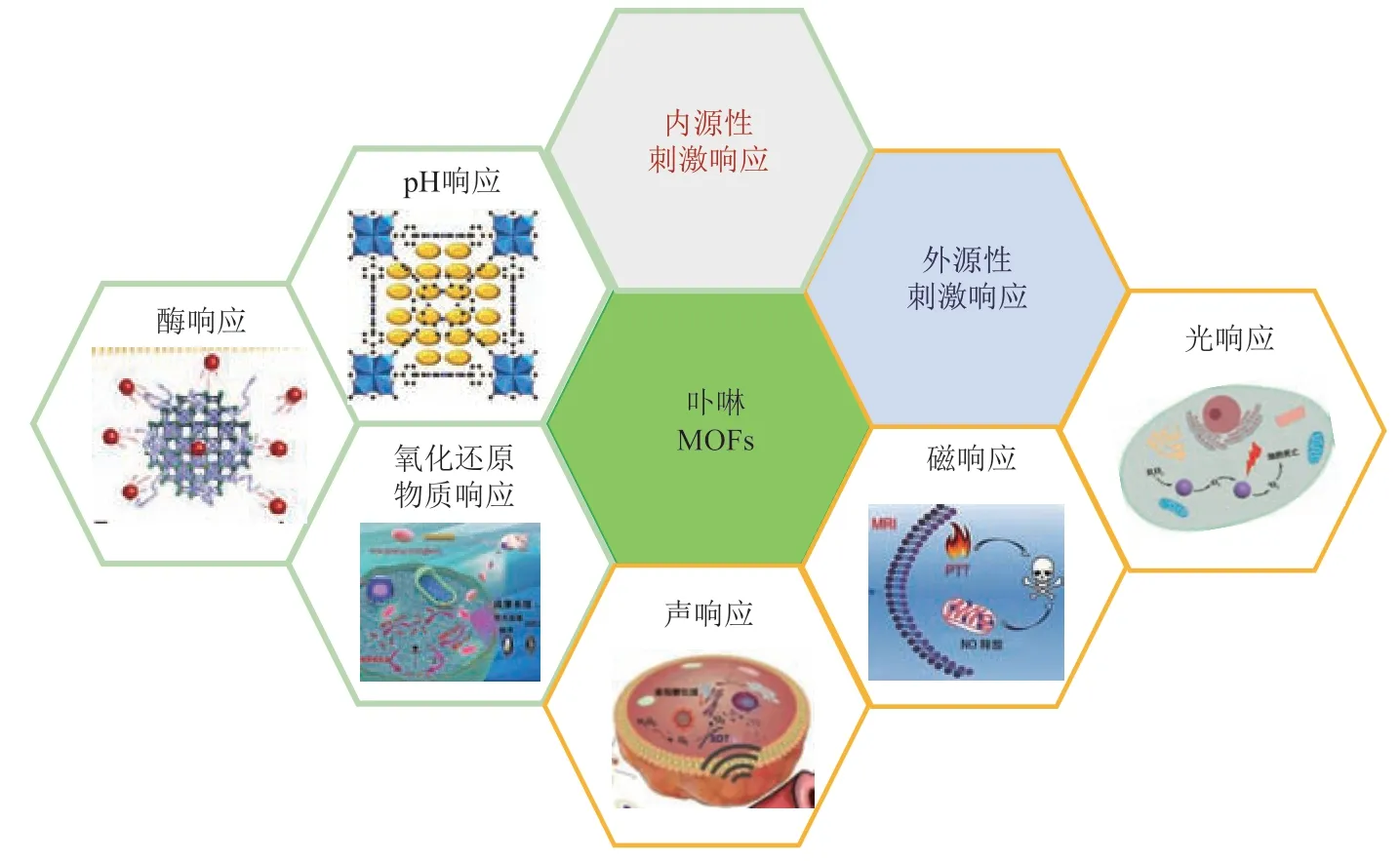
Fig. 1 Porphyrin metal-organic frameworks-based tumor therapies[12-17]图1 基于卟啉MOFs的肿瘤治疗策略[12-17]
1 基于卟啉MOFs的内源性组分响应型肿瘤治疗方法
相比于正常细胞,肿瘤细胞内微环境具有弱酸性、低氧、谷胱甘肽含量高、酶过表达以及氧化应激增加等系列异常特征。这些内源性差异在肿瘤增殖、侵袭、迁移以及新生血管生成等环节发挥重要作用,同时也为肿瘤精准诊疗提供了机遇[18]。如何利用肿瘤细胞内的微环境特点,设计构建内源性刺激响应型纳米诊疗体系,实现肿瘤部位靶向药物递送和精准肿瘤治疗,是当前纳米肿瘤学领域的研究热点和重大挑战之一[19]。基于卟啉MOFs的内源性组分响应型材料可对肿瘤细胞代谢改变引起的差异进行响应治疗。内源性刺激包括pH值、酶、氧化还原物种等,因此可以根据这些内源性刺激设计出多种基于卟啉MOFs的智能肿瘤治疗方法。
1.1 pH响应型
受肿瘤细胞过度增殖以及异常的血管结构影响,肿瘤组织的代谢过程以无氧糖酵解为主,导致肿瘤微环境具有弱酸性。弱酸性微环境对肿瘤侵袭、免疫、自噬以及耐药性产生等过程起促进和调节作用,因此也成为肿瘤精准诊疗的重要靶点[20]。
药物分子与卟啉MOFs可通过形成氢键、静电相互作用、范德华力、π-π相互作用等方式发生作用,因此在不同pH下,卟啉MOFs与药物的作用方式和强度不同。如图2a所示,Lin等[12]以四羧基苯基卟啉(TCPP)和ZrCl4为原料,制备了以锆为金属节点的卟啉基MOFs材料PCN-221。然后通过简单的浸渍法,首次将甲氨蝶呤(MTX)封装到PCN-221的纳米孔道内,形成了MTX/PCN-221复合材料。研究发现,药物MTX在不同pH值的模拟胃肠道系统液中释放模式不同。在pH 2.0时(接近胃的pH值),72 h后药物释放量约为40%;而在pH 7.4时(接近肠道的pH值),药物释放量约为100%。在模拟胃环境下,材料中药物的释放速度比在肠道环境下慢,可能与骨架卟啉环与药物分子之间的静电相互作用有关[21]。Leng等[22]采用溶剂热法合成了生物相容性良好的Zr-TCPP(PCN-222)。通过与东凌草素(oridonin)间形成氢键制备得到PCN-222@Ori纳米药物,东凌草素的有效负载量可达38.77 wt%。然后,分别研究了PCN-222@Ori在pH 7.2和pH 5.5下的东凌草素的累计释放值。结果表明,PCN-222@Ori在酸性条件(pH 5.5,86.29%)下168 h后的释药率显著高于中性条件(pH 7.2,63.30%)。因此,这类低毒、载药量大并且具有pH响应释放的卟啉MOFs材料,有望成为一类有前景的智能药物载体。

Fig. 2 Porphyrin MOFs-based endogenous stimuli-responsive tumor therapies图2 基于卟啉MOFs的内源性响应型肿瘤治疗策略
近期研究成果表明,石墨烯二维薄片具有高比表面积和柔韧性好、毒性低、易于表面修饰和良好的生物相容性等优点,是最有应用前景的pH智能药物载体之一。在酸性肿瘤微环境中,通过使其质子化可以削弱其与疏水性药物的相互作用,导致药物从石墨烯纳米片在靶点的选择性释放[23]。但是,石墨烯纳米片表面复函的高负电荷强度会导致肝脏摄取量的增加,从而限制了其长时间的血液循环。将带正电荷的MOFs材料引入到氧化石墨烯表面,不仅提高了表面电势,使纳米复合材料具有增强的渗透保留效应和肿瘤细胞对纳米药物的摄取能力,而且使小分子药物可以保留在MOFs的开放框架中。基于这个思路,Gharehdaghi等[24]制备了一种基于氧化石墨烯-Cu(II)-卟啉MOF纳米复合材料(CuG-GO,CuG1)的新型pH响应药物递送体系。这个智能药物递送系统具有以下优势:a. 材料具有高比表面积和丰富的表面基团,因此药物负载量高;b. 在水相中稳定;c. 在肿瘤细胞中具有pH响应的药物释放能力,而且药物释放量高;d. 对正常细胞毒性低;e. 比游离的DOX抗肿瘤效果好;f. 体内药物利用度高且副作用小。结果表明,这种pH响应的基于氧化石墨烯-Cu(II)-卟啉MOF纳米复合材料的智能载药系统在生物医药领域有很好的应用前景。
1.2 酶响应型
透明质酸(HA)因具有良好的生物相容性、生物可降解性、非免疫原性及可作为肿瘤细胞表面过表达CD44受体的配体的特点,在抗肿瘤纳米给药载体中得到广泛应用[25]。纳米给药载体与CD44受体结合富集于肿瘤细胞表面后,以HA为配体的纳米给药载体在外源性刺激物(如加热升温、施加外部磁场、近红外光照射等)的作用下,纳米药物载体释放药物,实现肿瘤的靶向给药。而当药物载体被内吞入肿瘤细胞后,在肿瘤内环境的pH值、氧化还原电位、酶等内源性刺激物的作用下药物载体裂解释放出抗癌药物。双重或多重刺激响应的纳米给药载体能够更好的控制药物传递和释放,具有良好的癌症靶向治疗潜力[26]。为了实现封装在卟啉MOFs内的药物分子的可控释放,Kim等[13]在纳米MOFs材料表面包裹了一种基于透明质酸酶催化反应的聚合物智能守门员。如图2b所示,首先,选择了纳米尺寸的卟啉MOFs PCN-224作为药物载体,这个MOFs材料虽然结构稳定但生物可降解,比表面积大,而且在一个很宽的pH范围内结构稳定。特别是,合适尺寸的纳米PCN-224材料可以被细胞很好地吞噬,并且被640 nm的激光激发后,表现出较好的光动力抗肿瘤效果。吸附药物分子后,为了实现药物的可控释放,在MOFs材料表面包裹上透明质酸作为守门员,阻止药物的提前释放。透明质酸的修饰,不仅可以使PCN-224具有很好的胶体稳定性,而且可以被肿瘤细胞中过度表达的CD44蛋白识别,实现靶向递药。最重要的是,透明质酸可以被肿瘤细胞中的透明质酸酶降解,从而实现药物在靶点的诱导可控释放。因此,上述一步精准医药体系可同步实现多种功能:肿瘤靶向、定点药物释放以及光动力治疗。研究结果表明,与游离DOX化疗相比,这种靶向的化疗和光动力联合疗法对抗多重耐药性肿瘤细胞MCF-7/ADR非常有效[13]。
1.3 氧化还原响应型
内源性氧化还原物种通过形成一个复杂的抗氧化防御系统来调节氧化还原平衡,影响细胞生长、增殖以及凋亡等多阶段。其中,葡萄糖、过氧化氢(H2O2)和谷胱甘肽(GSH)是最具代表性的内源性氧化还原物质,已被作为有效的“调节因子”和“靶点”用于氧化还原响应型肿瘤诊疗平台的构建[27]。
近年来,光动力疗法(PDT)被用于治疗癌症。它可以通过光照射产生活性氧(reactive oxygen species,ROS),特别是单线态氧,导致细胞凋亡和坏死[28]。但是,由于光的穿透力有限,而且细胞内微环境具有缺氧特性,PDT对深层肿瘤的实际疗效非常有限。肿瘤细胞微环境具有一定浓度的过氧化氢,化学动力疗法(CDT)可以通过芬顿(Fenton)反应分解内源性H2O2产生活性氧来引起细胞凋亡。虽然化学疗法不依赖外源性氧气和光照,但肿瘤细胞内的环境接近中性,Fenton反应效果很低,因此单一模式的CDT疗效不佳[29]。联合疗法可以整合单一疗法的优势,并避免单一疗法的缺点[30-31]。比如,An等[32]构建了一种级联酶/Fenton催化的纳米平台(Co-Fc@GOx),用于增强肿瘤治疗效果。在肿瘤微环境中,Co-Fc-NMOF递送的葡萄糖氧化酶(GOD)催化肿瘤细胞内源性葡萄糖转化为葡萄糖酸和过氧化氢,从而提高了肿瘤微环境的酸性和H2O2的含量,有利于促进Co-Fc-NMOF诱导的Fenton反应,进而促进肿瘤细胞内活性氧的产生。体外和体内实验结果表明,Co-Fc@GOx纳米酶引发的级联酶/Fenton催化反应具有显著的抗肿瘤活性。为了实现高效、精准的肿瘤治疗效果,Yin等[33]报道了一种多酶激活的自增强级联仿生治疗纳米平台,集成了化学发光诱导的光动力治疗(CL-PDT)、基于Fenton反应的CDT、葡萄糖氧化酶介导的饥饿治疗协同加强癌症治疗。在这个加强治疗体系中,铁卟啉MOF可以触发Fenton反应以达到化学动力治疗效果,携带的双草酸酯(bis(2-carbopentyloxy-3,5,6-trichlorophenyl)oxalate,CPPO)作为能量供体用于原位激发光敏卟啉MOF以产生单线态氧用于光动力治疗,葡萄糖氧化酶催化内源性葡萄糖转化为H2O2和葡萄糖酸以实现饥饿治疗。而包裹在纳米颗粒上的癌细胞膜可以实现同源靶向性,有利于取得更好的治疗效果。特别是,铁卟啉MOFs具有过氧化氢酶样活性可分解H2O2产生O2,有效缓解肿瘤缺氧,从而增强肿瘤细胞的葡萄糖氧化酶的催化活性和光动力治疗功效。此外,生成的H2O2和葡萄糖酸可以进一步改善CPPO-H2O2触发的化学激光诱导的动力学疗法,并促进低pH依赖性的基于Fenton反应的化学动力治疗。体外和体内研究均表明,构建的纳米平台显示出良好的协同抗肿瘤性能,该纳米平台未来有望在临床环境中使用,从而实现更精确、有效的肿瘤治疗。
癌细胞的异常增殖需要足够的营养和能量供应来支持它们的存活和生长。大多数肿瘤细胞则依赖有氧糖酵解,导致肿瘤细胞对葡萄糖浓度的变化更加敏感[34]。基于此,科学家们提出了一种通过消耗肿瘤内葡萄糖来进行饥饿治疗癌症的策略[35]。但是,正常细胞同样需要葡萄糖进行代谢,传统的饥饿策略缺乏肿瘤靶向性,可能会引起严重的脱靶效应[36]。为了增强治疗效果,可以通过一种补充模式来切断癌细胞的葡萄糖供给并破坏葡萄糖代谢过程[37]。基于此,Li等[38]通过将葡萄糖氧化酶和过氧化氢酶嵌入癌细胞细胞膜伪装的卟啉金属有机框架PCN-224中,构建了一个肿瘤靶向的级联生物反应器(mCGP),用于饥饿疗法和光动力疗法协同增效。由于表面仿生功能化,mCGP反应器的免疫逃逸和同型靶向行为显著增强其肿瘤靶向和保留能力。一旦被肿瘤细胞内吞,mCGP反应器将通过催化内源性H2O2生成O2来促进微环境富氧化,从而加速细胞内葡萄糖的分解,并在光照射下增强单线态氧的生成。因此,mCGP反应器显示出饥饿治疗和光动力治疗的增强协同效果,单次给药后就可以有效抑制肿瘤生长[33]。
由于可见光的穿透性差,肿瘤微环境高度缺氧,同时过度表达的GSH会消耗大量ROS,使光动力疗法疗效有限[28,39-41]。而且,由于肿瘤微环境中的弱酸性和过度表达的GSH,单一模式的化学动力疗法疗效也很有限[29,42]。葡萄糖氧化酶可以氧化内源性葡萄糖生成H2O2和葡萄糖酸,提高细胞内的H2O2浓度并降低pH值,从而提高基于Fenton反应的化学动力疗法效果。基于上述基础,Wang等[14]首次设计并构建了纺锤状铜(II)基TCPP纳米金属有机框架(PCN-224(Cu)-GOD@MnO2),不仅可以作为精准成像系统,而且可以通过联合缓解缺氧和谷胱甘肽消耗,促进化学动力学和饥饿疗法的效果。如图2c所示,在这个多功能诊疗平台中,表面的MnO2的包裹层避免了GOD共价键对正常组织造成伤害,而且还可以在细胞内分解H2O2产生O2,缓解细胞内缺氧情况,并加速葡萄糖的氧化反应。Cu+被细胞内的GSH反应氧化成Cu2+,消耗细胞内的GSH,并降低细胞内的氧化还原电势,从而增强化学治疗效果。而且,与TCPP配体键合的Cu+可以通过Fenton反应,将葡萄糖氧化产生的H2O2分解成毒性的羟基自由基等活性氧,与O2和H2O通过Russel机制生成单线态氧,达到协同治疗效果。除了诱导细胞的凋亡,这个多功能平台还具备荧光成像和核磁共振成像的功能,可以实现精准治疗。
青蒿素及其衍生物,如双氢青蒿素(DHA),作为新型抗癌药物已经引起越来越多的关注[43]。但是,使用DHA治疗癌症的效果通常取决于外源性成分的协同作用,转运过程中DHA的丢失降低了其在肿瘤治疗中的有效性。为了解决这个问题,唐波教授课题组[44]报道了一种基于内源性物质刺激响应的CaCO3包裹的铁卟啉纳米MOF纳米药物平台用于肿瘤细胞协同治疗,避免了在血液循环过程中DHA的泄露。当该纳米药物到达肿瘤区域后,细胞微环境中的弱酸性以及高浓度谷胱甘肽会触发DHA的释放和TCPP的激活,进而实现Fe2+-DHA介导的化学动力学治疗、Ca2+-DHA介导的肿瘤治疗和TCPP介导的光动力治疗。体内实验表明,这种三重协同治疗策略具有显著增强的抗肿瘤效果,而且毒副作用也很小,是一种非常安全、可控、有效的药物递送平台。
2 外源性响应的基于卟啉MOFs的肿瘤治疗方法
外源刺激包括声、磁场和光等。声动力治疗是一种新颖有效的抗肿瘤治疗方法,具有成本低、使用方便、渗透性强等优点[45-46]。磁场能引导药物靶向、触发药物释放,抑制肿瘤的生长,但成本较昂贵[47]。相对于其他外源刺激,光具有便捷性、非侵入性及具有良好的生物相容性等优势,可高时空精度调控药物的递送[48]。
2.1 声响应型
声动力治疗(SDT)是一种新颖有效的抗肿瘤治疗方法[49-51]。在超声波辐照下,在肿瘤部位局部ROS增强,促进肿瘤凋亡和坏死,避免全身毒性,相比于其他ROS增强的方法,如放疗[52]和PDT[53],SDT具有成本低、使用方便、渗透性强等优点[54]。声敏剂是SDT中将声波能量转换为大量ROS的介质,但因其负载效率低、自猝灭性较高,减弱了它在肿瘤治疗方面的效果[49-50,55]。氧是SDT的关键反应物,SDT在缺氧的肿瘤组织中的作用效果较差[55]。已有研究表明,铂纳米粒子(Pt NPs)[56]和MnO2[57]纳米酶能在体内模拟天然过氧化氢酶发挥稳定的催化作用。为了克服缺氧的缺陷,Bao等[15]利用PCN-224作为声敏剂,并在红细胞膜伪装的PCN-224上原位生长Pt NPs并负载GOX(命名为:PCN-224@Pt@GOx@EM纳米载体),用于协同抗肿瘤治疗。如图3a所示,当PCN-224@Pt@GOx@EM纳米载体被肿瘤细胞内化时,PCN其表面装载的Pt纳米粒子能够分解内源性H2O2产生O2来缓解肿瘤缺氧,从而增强SDT效应。同时,葡萄糖氧化酶可以消耗肿瘤部位的葡萄糖,实现饥饿治疗并进一步提高肿瘤部位H2O2的水平。PCN-224表面负载红细胞膜(EM)能够提高纳米材料在体内的生物相容性[58],而且PCN-224@Pt@GOx@EM纳米载体可以在肿瘤组织中通过增强积聚渗透和保持效应(EPR效应),在超声触发下在局部快速产生大量ROS杀死肿瘤细胞。这种新型SDT平台有望为肿瘤治疗提供一种有效的治疗策略。

Fig. 3 Porphyrin MOFs-based Exogenous stimuli-responsive tumor therapies图3 基于卟啉MOFs的外源性刺激响应型肿瘤治疗策略
2.2 磁响应型
与化疗相比,肿瘤治疗的物理治疗策略如光疗(包括光热疗法(PTT)和光动力疗法(PDT))显示出独特的优势,如远程控制、高选择性、低生物毒性等[59]。但光敏剂的位置对光疗效果具有重要意义。因此,多功能肿瘤治疗平台(MCTPs)应运而生,越来越多的人期望将成像和治疗整合到单一系统,通过成像提高治疗的疗效和安全性[60]。磁共振成像(magnetic resonance imaging,MRI)平台是将影像和肿瘤治疗整合到一个系统中,通过影像引导治疗来提高治疗效率和安全性,解决了由于单独化疗药物不能靶向给药而导致对正常器官的毒性和不良影响的问题,此平台在近年来的研究中备受关注[61]。基于此设想,Zhang等[62]首次在Fe3O4@C核上原位生长卟啉金属有机骨架材料(PMOF)壳层形成Fe3O4@C@PMOF,用于荧光-磁共振双模态成像引导的光热和光动力共同治疗肿瘤。由于卟啉的光学性质在PMOF中得到了很好的保留,同时Fe3O4纳米粒子的团簇结构能够增强MRI效应,研究结果表明,Fe3O4@C@PMOF是一种用于肿瘤诊断和治疗的双成像引导PTT和PDT双重治疗平台,而且具有低细胞毒性和生物毒性。
诊断和治疗相结合,将癌症治疗推向了一个新的发展阶段[63]。影像引导化疗解决了化疗药物对正常器官的毒性和不良反应,但持续的药物输送可能会带来耐药性的问题[64]。开发能够替代化疗的新策略一直是癌症治疗的重要挑战之一[65]。最近,人们开发了对正常器官毒性小的“绿色”光疗法,包括PTT和PDT[66]。但是,基于单线态氧的光动力疗法的主要障碍是肿瘤的局部缺氧,这被认为是限制光动力疗法疗效的主要因素[67]。自由基气体一氧化氮(NO)作为一种新兴的肿瘤治疗方法,引起了广泛关注[68]。与其他治疗方案(如化疗)的结合,可以达到很好的协同治疗效果[69]。如图3b所示,Zhang等[16]首次开发了一种Mn/卟啉NMOF平台,用于磁共振引导NO和光热协同治疗癌症。Mn离子在卟啉环中的掺入赋予了NMOFs光热转换能力[70],S-亚硝基硫醇(SNO)是一种热不稳定的NO供体[71]。以细胞和小鼠为模型,在MRI成像引导下,成功实现了NO和光热协同治疗癌症。研究表明,在耐药模型中,NMOF-SNO复合材料比DOX化疗单一模式表现出更高的抑瘤效率。但是,NO系统具有不稳定性,NO疗法的生物学效应还需要进一步评估。虽然还存在一些尚未解决的问题,但研究结果表明,这种策略在未来可能可以作为化疗的替代方案,促进非药物治疗系统的发展。
2.3 光响应型
PDT是指采用特定波长照射光敏剂(photosensitizer,PS),使其被激发从而产生ROS,然后利用ROS破坏靶细胞膜以及胞内活性分子,从而杀灭靶细胞的方法[72-74]。对比传统治疗手段,PDT具有高时空分辨率、非侵入性、副作用小等优势。而且,该治疗手段便于联合其他治疗方式,构建更高效的协同治疗体系,被认为是治疗肿瘤以及其他多种疾病的有效方法之。但肿瘤微环境高度缺氧,使得光动力疗法疗效有限[28,39-41]。Pt NPs是一种优良的纳米材料,具有过氧化物酶和超氧化物歧化酶的特性[75],能有效催化转化H2O2生成O2。为了提高光动力治疗效果,增强生成O2的能力,Zhang等[17]通过在MOFs光敏剂上修饰Pt纳米粒子,增强其光动力治疗效果。如图3c所示,该纳米平台可以分解H2O2生成O2,促进肿瘤缺氧部位单线态氧的形成,从而增强PDT治疗效果。虽然光动力能够产生ROS达到抗肿瘤的目的,但是因为光的穿透深度有限,限制了其在深层组织治疗中的应用[76]。为了克服此缺陷,Lin等[77]设计了一个(d-Lu)PCN-224(d-Lu=d-荧光素)系统,此系统能利用基于内源性生物发光的特性触发PDT生成活性氧杀死肿瘤细胞。因为d-荧光素的生物发光(BL)光谱与PCN-224的吸收光谱重叠,因此PCN-224与d-荧光素之间存在生物发光共振能量转移(BRET)效应。即使没有外部光源,这种(d-Lu)PCN-224系统也可以产生单线态氧来杀死肿瘤细胞,这项研究为深层组织PDT治疗提供了可能性。
细胞毒性过大或者抗癌药物的水溶性差,都会影响化疗的治疗效果[78]。因此迫切需要发展新的治疗策略来提高抗癌药物的抗肿瘤效果,其中构建多种治疗方法协同将是提高抗肿瘤疗效的新型治疗策略[79]。由于近红外光(NIR)能精准照射到病变组织,可以减少对活体组织和器官的损伤,达到最大限度地减少副作用[80],因此联合化疗和光动力疗法已在癌症治疗研究中得到广泛应用[81]。但是,在同一激发条件下,同时实现化疗药物的可控释放和光动力治疗效果存在一定的难度[82],因此开发一种同时实现药物按需释放和增强光动力治疗效果的方法是非常必要的。研究发现,含硒聚合物通过负载光敏剂后的氧化还原反应,可以实现药物的可控释放[83]。基于上述研究基础,Luo等[84]设计一种核壳结构的、可以在单一光源下同步实现光动力治疗和化疗药物按需释放的给药系统。首先,以具有光触发ROS生成能力的多孔锆卟啉MOFs(PCN-224)为核心,以可以被ROS分解的两亲性含硒聚合物为壳,制备了核壳结构的可控给药系统(poly(DH-Se/PEG/PPG聚氨酯)@MOF)。壳层聚合物包含可以被ROS分解的DHSe部分,增强生物相容性的亲水性PEG部分,还包含稳定复合物结构的疏水性PPG部分。这种设计不仅有助于提高涂层后MOFs的生物安全性和稳定性,还可以在光照下诱导MOFs产生ROS,实现光动力治疗。而且,产生的ROS还可以破坏聚合物涂层,实现抗肿瘤药物的按需释放。综上所述,在同一光源刺激下,这种核壳结构的可控给药系统可以同步实现光动力治疗和抗肿瘤药物的按需释放。
金属离子可以用于疾病的诊断和治疗,但仍面临脱靶效应和急性毒性的挑战[85]。研究发现,利用近红外光激发可以实现金属离子准确、高效和可控输送,同时还能缓解金属离子引发的全身毒性[86]。Ag纳米粒子表现出低毒,但在氧化环境下能被有效激活并释放剧毒Ag+杀灭肿瘤细胞和细菌。为了构建银离子的智能转运系统,Zhang等[87]构建了一种生物相容性好的近红外控制的Ag+释放系统,实现按需激活和释放Ag+。首先,将银纳米颗粒(AgNPs)组装到卟啉金属有机框架(PCN)上,然后用具有炎症靶向能力的中性粒细胞膜(NM)包裹,成功构建了PAM纳米平台。在NIR光照下,PCN受光激发活化分子氧产生单线态氧,并氧化Ag纳米粒子释放有毒的Ag+从而诱导肿瘤细胞和细菌死亡。同时,由于局部电场效应,银纳米粒子会增强PCN通过光动力产生单线态氧的能力。而且,在没有光照射的情况下,PAM对循环或正常细胞没有造成任何损伤。总之,这项研究通过Ag纳米粒子和卟啉MOFs之间的连锁相互作用,可以同时实现精确控制的金属离子释放和增强的PDT治疗,从而有效消除肿瘤和细菌。
光驱动的肿瘤疗法因其对肿瘤治疗的显著优势,吸引了越来越多的关注,光动力和光热联合治疗有利于克服单一治疗模式的不足[88]。但目前这种联合治疗还存在两大问题:a. 肿瘤细胞内的缺氧微环境限制了光动力的治疗效果[89];b. 光热效应产生的热休克蛋白(HSP)使肿瘤细胞抵抗热诱导的凋亡,从而无法达到预期效果[90]。为了解决上述问题,Cheng等[91]在普鲁士蓝(PB)纳米颗粒上包覆锆-卟啉(PCN)MOFs,制备了核-壳结构的纳米复合物(PB@PCN),并用小鼠结肠癌细胞膜包裹,赋予纳米复合物良好的免疫逃避和主动靶向能力[91],并通过调节PCN壳层厚度,获得综合性能最好的PB@PCN@MEM纳米复合物用于肿瘤治疗和成像[92]。PCN壳层易于单线态氧扩散、避免自猝灭和高光敏剂负载,可以有效地将O2转化为剧毒的单线态氧,通过PDT杀死肿瘤细胞并攻击热休克蛋白以促进PTT效应[93]。此外,PB核不仅可以用于近红外辐射下肿瘤的PTT治疗,还可以将肿瘤细胞中过量产生的内源性H2O2转化为O2,有效缓解肿瘤缺氧,提高PDT的治疗效率[94]。而且,PB@PCN@MEM可用于多个成像技术,包括MRI、荧光成像(FL)、光声成像(PAI)和红外成像(IR),提供关于肿瘤的详细信息,并改善PTT/PDT治疗效果。红外光比紫外光和可见光在组织中的穿透能力更强,上转化纳米材料(UCNPs)可以吸收红外光并发射可见光,从而可以激发卟啉MOFs的光动力治疗。He等[95]通过DNA相互作用制备了MOF-UCNP核心-卫星上层结构,在980 nm激光照射下获得大量单线态氧。而且,相比于两种单组分的物理混合体系,复合材料的细胞毒性较照射时增强。复合材料与表皮生长因子受体结合后,靶向光动力治疗显著增强,在近红外激发20 min后,约82%的肿瘤细胞死亡。这一工作将促进利用UCNP和MOF组装构建纳米结构的多功能PDT材料的发展。
近年来,研究发现苯基砷氧化物(PAO)的三价砷可抑制线粒体蛋白质以增加ROS的产生和诱导凋亡信号通路,其毒性比常用的As2O3更大[96]。此外,砷酸盐能够通过与GSH半胱氨酸上的游离巯基结合来调节细胞氧化还原系统[97]。此外,作为一种电子传递链(ETC)抑制剂,它还可以通过线粒体呼吸抑制来缓解肿瘤缺氧[98]。尽管存在上述多种抗肿瘤机制,但由于高剂量砷的治疗效果不理想和严重不良反应,砷的实际应用仍然受到限制[99]。因此,有必要在增加靶向药物的同时,通过PAO与其他药物联合来提高抗肿瘤效率。基于此,Yuan等[100]开发了一种基于PAO和卟啉MOF的肿瘤靶向自协同纳米平台(PAO@PCN@HA),用于化疗致敏的光动力治疗。首先在PCN-224卟啉金属有机骨架中装载氧化苯胂(PAO),然后用HA进行表面修饰。HA表面改性不仅提高了纳米平台的生物相容性,而且增强了肿瘤细胞对纳米平台的优先聚集和吞噬[101]。更重要的是,PAO作为化疗药物能增加ROS的生成,破坏线粒体,促进细胞凋亡。另一方面,PAO还可以抑制线粒体的呼吸功能,减轻肿瘤缺氧,并与细胞内的GSH反应,以减少ROS消耗增强PCN-224的PDT效应。值得注意的是,这种自协同策略弥补了对肿瘤PAO化疗的不敏感性,减少了治疗剂量PAO的副作用。因此PAO@PCN@HA在缺氧肿瘤微环境中显示出有效的肿瘤抑制效果,而且全身毒性较低。这种肿瘤靶向协同作用可能为开发临床应用中基于砷的抗肿瘤策略提供新的视角。
MnO2纳米粒子作为肿瘤微环境反应性治疗药物试剂具有许多优势,比如MnO2纳米粒子可以与肿瘤微环境中的H+和GSH反应,释放顺磁性Mn2+离子进行T1磁共振成像[102]。同时,MnO2诱导可以H2O2分解产生O2,从而缓解肿瘤缺氧[103]。而且,MnO2可以抑制肿瘤内GSH消耗O2从而增强PDT效应[104]。但是,MnO2是一种高效的荧光猝灭剂,可能会严重影响光敏剂生成ROS[105]。此外,MnO2纳米颗粒缺乏特异性,将导致其在肿瘤内的积累有限。即使所有这些问题都能被解决,单一模式的PDT依然很难达到很好的抗肿瘤效果,构建多模式系统体系是提高抗肿瘤效果的有效途径[106]。比如,Li等[107]构建了一个PCN@MnO2@DOX@HA(PMDH)智能纳米平台,用于在MRI指引下,联合化学疗法和光动力治疗进行缺氧微环境下的靶向肿瘤治疗。由于HA功能化,纳米平台可以特异性识别细胞内过度表达的CD44受体,从而具有靶向功能。而且,纳米平台在肿瘤部位积累,在肿瘤细胞微环境中可将细胞中丰富的H2O2分解为O2,缓解肿瘤缺氧,通过O2自给与GSH还原能力相结合,增强光动力治疗效果。特别是,与肿瘤微环境中的H+和GSH反应,释放顺磁性Mn2+进行T1磁共振成像。这种肿瘤微环境触发的化疗/光动力联合治疗有望实现对低氧肿瘤的高效靶向治疗和副作用最小化。
3 总结与展望
本文从刺激响应角度,总结了卟啉金属有机骨架材料在肿瘤诊疗中的最新研究进展。利用纳米药物载体对内源性组分和外源性物理信号的刺激响应,可以克服目前传统治疗方法中存在的药物利用率低、靶向性较差、损害活体组织等缺点和局限性。多种策略已被用于提高其肿瘤治疗效果和生物安全性。如:a. 利用卟啉MOFs具有可控合成及修饰的特点,控制纳米材料的形貌和粒径,并根据靶标部位或功能区域进行表面修饰,利用刺激响应实现药物的可控转运和释放,并提高对肿瘤的靶向递送效率;b. 在卟啉MOFs中封装其他可以干扰肿瘤细胞生存机制的小分子药物,构建多机制协同肿瘤治疗体系;c. 利用刺激响应型聚合物包裹卟啉MOFs,构建多重刺激响应的肿瘤诊疗智能体系,提高药物释放的精准度;d. 构建多模式协同治疗体系,克服单一系统单一模式的局限性治疗。
基于卟啉MOFs的刺激响应型纳米药物载体拥有广泛的生物医学应用前景,包括药物运输、组织工程等,构建基于组分响应的肿瘤治疗方式是迈向智能化和个性化治疗的一步。但是,目前该领域的研究还处于基础研究阶段,要将卟啉MOFs刺激响应型纳米药物应用于临床治疗,仍有一些问题亟需解决。比如:a. 是否可以通过优化卟啉MOFs材料的微观结构、形貌、粒径尺寸、表面微环境等提升其肿瘤治疗效果和生物安全性;b. 需要深入开展基于卟啉MOFs的纳米药物的刺激响应型多机制协同治疗肿瘤的机制研究;c. 健全完善临床前动物模型和相关器官实验,优化肿瘤治疗策略。