生长分化因子15在多发性骨髓瘤细胞MM.1R中的表达及生物学作用研究
2023-06-23吴菁王禹覃宏平王其财黄春妮姚奕斌凌志安李若林
吴菁 王禹 覃宏平 王其财 黄春妮 姚奕斌 凌志安 李若林


【摘要】 目的 探讨生长分化因子15 (growth differentiation factor 15,GDF15)在多发性骨髓瘤(multiple myeloma,MM)中的表达,并初步分析其对细胞生物学功能的影响。
方法 应用实时荧光定量 PCR(qRT-PCR)检测GDF15在多发性骨髓瘤细胞株MM.1R 中的表达水平。再通过构建 GDF15的过表达和沉默质粒分别转染MM.1R细胞株,检测细胞增殖、细胞迁移、细胞侵袭、细胞周期和凋亡。
结果 在72 h、96 h、120 h三个时间点,过表达GDF15组细胞增殖较阴性对照组明显增高,差异有统计学意义(P均<0.05);过表达GDF15后MM.1R细胞的迁移和侵袭能力有所增加,但差异无统计学意义(P>0.05)。在72 h和96 h,沉默GDF15组细胞增殖较阴性对照组明显降低,差异有统计学意义(P<0.05);与阴性对照组相比,沉默GDF15组能显著抑制MM.1R细胞的迁移和侵袭能力。48 h后,沉默组G0/G1期细胞比例显著高于阴性对照组,沉默组S期细胞比例显著低于阴性對照组,差异均有统计学意义(P均<0.05),但未见明显诱导MM.1R细胞凋亡的作用。
结论 GDF15基因影响多发性骨髓瘤细胞MM.1R的增殖、迁移和侵袭能力,并调节细胞周期,这可能会促进多发性骨髓瘤的进展。
【关键词】 多发性骨髓瘤;生长分化因子15(GDF15);生物学行为;细胞增殖;细胞迁移
中图分类号:R733.3 文献标志码:A DOI:10.3969/j.issn.1003-1383.2023.04.004
Expression and biological role of growth differentiation factor 15 in multiple myeloma cells of MM.1R
WU Jinga, WANG Yua, QIN Hongpingb, WANG Qicaia, HUANG Chunnia, YAO Yibinc, LING Zhiand, LI Ruolinb
(a. Department of Laboratory Medicine, b. Clinical Medical Experiment Center, c. Department of Hematology, d. Department of
Orthopedics, the First Affiliated Hospital of Guangxi Medical University, Nanning 530021, Guangxi, China)
【Abstract】 Objective To investigate the expression of growth differentiation factor 15 (GDF15) in multiple myeloma (MM), and to preliminarily analyze its effect on cell biological function.
Methods The expression level of GDF15 in multiple myeloma cell line MM.1R was detected by quantitative real-time PCR (qRT-PCR). The MM.1R cell lines were then transfected by constructing overexpression and silent plasmids of GDF15, and cell proliferation, cell migration, cell invasion, cell cycle and apoptosis were detected.
Results At 72 h, 96 h and 120 h, cell proliferation in overexpressed GDF15 group was significantly higher than that in negative control group, and difference was statistically significant (all P<0.05);the migration and invasion capacity of MM.1R cells were increased with the GDF15 overexpression, but the difference was not statistically significant (P>0.05). At 72 h and 96 h, cell proliferation in silence GDF15 group was significantly lower than that in the negative control group, and the difference was statistically significant (P<0.05);compared with the negative control group, the silence GDF15 group significantly inhibited the migration and invasion of MM.1R cells. After 48 h, the proportion of cells in G0/G1 phase in the silence group was significantly higher than that in the negative control group, and the proportion of cells in S phase in the silence group was significantly lower than that in the negative control group, the differences were statistically significant(all P<0.05), but there was no obvious effect on inducing apoptosis of MM.1R cells.
Conclusion GDF15 gene affects the proliferation, migration, and invasion ability of multiple myeloma cells MM.1R, and regulates cell cycle, which may promote the progression of multiple myeloma.
【Key words】 multiple myeloma; growth differentiation factor 15(GDF15); biological behavior; cell proliferation; cell migration
多发性骨髓瘤(multiple myeloma,MM)是以浆细胞异常增生和分泌大量单克隆免疫球蛋白(M 蛋白)或本周氏蛋白为特征的一种恶性肿瘤性疾病[1]。MM 发病率为 (1~2)/10万[2],是很多国家(包括中国)血液系统排名第二位的常见恶性肿瘤[3]。目前 MM 仍属于不可治愈的疾病,临床表现多样化,起病缓慢,早期可数月至十多年无临床症状,治疗难度大,早期易被误诊,预后评估仍存在很大的局限性。因此,探索新的诊断生物标志物或治疗靶点至关重要。
生长分化因子15(growth differentiation factor 15,GDF15)能调剂肿瘤细胞干性程序化死亡分子(programmed death 1,PD-1)和细胞程式死亡-配体1(programmed cell death-Ligand 1,PD-L1),既有致瘤作用,也有抗肿瘤的作用,但大部分报道都是以其发挥致瘤作用为主[4]。本课题组在前期研究发现GDF15在MM患者血清中处于高表达水平,其遗传位点与MM的ISS期和DS分期有一定的相关性[5]。因此,笔者推测GDF15可能作为MM细胞形成的关键诱导因子或MM细胞恶性转化的重要调节因子,参与了MM肿瘤微环境生物学过程。但目前有关GDF15基因对MM细胞生物学功能研究的文献报道较少,未见对MM.1R细胞的表型作用进行研究。
本研究以人多发性骨髓瘤细胞株MM.1R为研究对象,通过检测GDF15在MM.1R 细胞中的表达水平,并构建 GDF15的过表达和沉默质粒转染细胞MM.1R,观察GDF15基因对MM细胞生物学行为的影响,为进一步明确GDF15基因在MM发病机制中的作用提供细胞水平的信息。
1 材料與方法
1.1 研究对象
人多发性骨髓瘤细胞株MM.1R(BFN60804002),购自上海中科院细胞库。
1.2 仪器与试剂
RPMI-1640培养基(C11875500BT),美国Invitrogen公司;胎牛血清(10270-106)和0.25%胰蛋白酶(25300062),美国Gibco公司;Transwell小室(8 μm孔径)(3422)和Matrigel Matrix(354230),Corning公司;CCK-8试剂(LB788),Dojindo公司;Trizol试剂盒(15596-026),Thermo公司;Lipofectamine 3000转染试剂(L3000-015),美国Invitrogen 公司;jet PRIME试剂盒(PT-114-15)和INTERFERin?倕
试剂盒(409-10),美国polyplus公司;qRT-PCR试剂盒(208054),QIAGEN公司;细胞周期(550825)检测试剂盒和细胞凋亡检测试剂盒(556547),BD Biosciences公司;GDF15质粒(HG10936-UT)及空载质粒、siRNA-GDF15及阴性对照siRNA,SinoBiological公司;台式高速冷冻离心机(H1850R),湖南湘仪有限公司。
1.3 方法
1.3.1 细胞培养
用含10%胎牛血清及1%青霉素/链霉素的RPMI-1640作为培养基进行培养。将细胞放置于37 ℃,5%CO2湿化培养箱中培养,隔3~5 天传代一次。
1.3.2 质粒转染
按照转染试剂盒说明书进行转染,过表达组转染GDF15过表达载体,沉默组细胞转染siRNA-GDF15,阴性对照组转染空载质粒或阴性对照siRNA,空白对照组细胞不转染任何质粒。转染48 h后,采用 qRT-PCR检测细胞转染效率(测定细胞中GDF15 mRNA表达水平)。
1.3.3 RNA提取和qRT-PCR 应用
Trizol提取MM.1R细胞株的总 RNA,检测RNA浓度和纯度后, 以RNA为模板逆转录为cDNA。以GAPDH为内参检测GDF15 mRNA的表达水平。GAPDH上游引物为5'-AATCAAGTGGGGCGATGCTG,下游引物为5'-GCAAATGAGCCCCAGCCTTC;GDF15上游引物为5'-ACTCACGCCAGAAGTGCGG,下游引物为5'-TCACGTCCCACGACCTTGAC。qRT-PCR反应参数为2 min,95 ℃,5 s,95 ℃,30 s,60 ℃,40个循环。获得的数据运用2-ΔΔCt方法计算表达量。
1.3.4 CCK-8检测细胞增殖活性
将各组细胞制备成2×105个/mL细胞悬液,分别取100 μL接种在96孔板,每个样本设复孔3个,分别在培养24 h、48 h、72 h、96 h和120 h时, 加入CCK-8显色液,置于37 ℃ 二氧化碳培养箱,孵育2 h。短暂振荡,放入酶标仪中,于450 nm处检测吸光度(OD)值。
1.3.5 Transwell 小室实验检测各组细胞中侵袭和迁移细胞数
侵袭细胞数:将Matrigel基质胶移到4 ℃ 冰箱中过夜融化,用无血清RPMI-1640培养基8倍稀释后的Matrigel基质胶覆盖在Transwell小室上室中,将细胞密度调整至1×106个/mL,分别取100 μL加入Transwell小室,下室加入 RPMI-1640 培养基,置于培养箱中继续培养,24 h后将小室取出,4%多聚甲醛固定30 min,PBS清洗两次后,用1%结晶紫染色30 min,PBS洗净残留的染液,用棉棒轻轻擦去上室的细胞,在荧光显微镜下(40×)选取5个视野观察细胞侵袭的情况。迁移细胞数:小室上室不用基质胶包被,其余步骤同侵袭细胞数测定。细胞相对迁移率=不同处理的迁移细胞数/空白对照组的迁移细胞数×100%。
1.3.6 流式细胞仪检测MM.1R细胞周期
转染48 h和72 h后取5×105个细胞,PBS清洗一次,离心弃上清。每个样本中加入500 μL PI/RNase 染料,室温避光孵育15 min,在0.5 h内上机检测细胞周期情况。
1.3.7 流式细胞仪检测MM.1R细胞凋亡
转染48 h和72 h后取1×105个细胞,离心,弃去上清液。每管加入50 μL 1×Binding Buffer,重悬,阴性管不加任何染料,样本管加入5 μL Annexin V-FITC和10 μL PI。轻轻地震荡溶液,放置在正常室温下,避光孵育15 min。分别加入200 μL 1× Binding Buffer,在1 h内流式细胞仪上机检测细胞凋亡情况。
1.4 统计学方法
应用 SPSS 26.0软件进行统计学分析,对数据进行正态性和方差齐性检验,符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验,检验水准:α=0.05,双侧检验。
2 结 果
2.1 多发性骨髓瘤细胞系中GDF15的表达水平
本研究根据不同的转染试剂Lipo3000 L1(7.5 μL、L2(10 μL)、L3(15 μL)以及jet PRIME P1(1 μL)、P2(2 μL)、P3(4 μL)、CK(本底)和陰性对照,分别转染了多发性骨髓瘤MM.1R。再采用qRT-PCR方法分别检测了上述6个组中GDF15的相对表达水平,结果与内参作对比,GDF15在多发性骨髓瘤细胞株MM.1R中的相对表达水平不明显。因此,将GDF15过表达和GDF15沉默对多发性骨髓瘤细胞功能的影响分别进行研究。但由于L3组的细胞状态比P3好,本研究采用L3条件(Lipo3000 15 μL)进行后续实验。见表1。
2.2 GDF15过表达对MM.1R细胞增殖能力的影响
CCK8结果显示,经过GDF15过表达组与阴性对照组的OD值进行比较,在72 h、96 h、120 h三个时间点,差异均有统计学意义[(0.611±0.060) vs (0.513±0.003),P<0.05];[(0.933±0.006) vs (0.652±0.008),P<0.01];[(1.291±0.067) vs (0.816±0.004),P<0.01],提示GDF15基因在体外可促进细胞增殖,结果见图1。
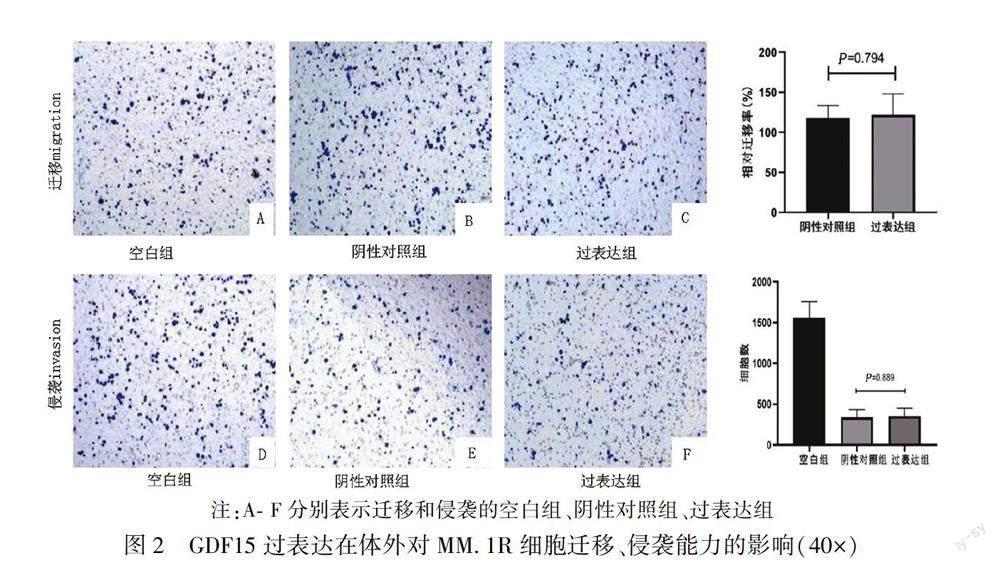
2.3 GDF15过表达对MM.1R细胞迁移、侵袭能力的影响
GDF15过表达组对MM.1R细胞的相对迁移率高于阴性对照组,但差异无统计学意义[(121.691±26.309) vs (118.012±15.490),t=0.269,P>0.05)];GDF15过表达组对MM.1R细胞的侵袭能力高于阴性对照组[(350.80±98.86) vs (338.20±96.32)],但差异无统计学意义(P>0.05)。结果见图2。
2.4 GDF15 siRNA体外对MM.1R细胞增殖的影响
通过转染3段不同的siRNA(siRNA-GDF15-45,siRNA-GDF15-741,siRNA-GDF15-533),感染MM.1R细胞后,采用qRT-PCR技术检测GDF15基因在三组的相对表达量为1.026、0.228、0.674,与阴性对照组比较,siRNA-GDF15-741组对GDF15基因的干扰效果最明显(P<0.05)。因此,本研究选择siRNA-GDF15-741 作为有效的GDF15沉默载体转染MM.1R细胞进行后续的研究。GDF15 siRNA转染MM.1R细胞后,沉默组与阴性对照组的OD值进行比较,发现在72 h和96 h两个时间点,差异均有统计学意义[(0.877±0.050) vs (0.975±0.039),P<0.05;(0.850±0.051) vs (1.017±0.010),P<0.01],提示沉默GDF15在体外干预72 h和96 h可抑制细胞增殖。见图3。
2.5 GDF15 siRNA对MM.1R细胞迁移、侵袭能力的影响
与阴性对照组相比,GDF15 siRNA组能显著抑制MM.1R细胞的迁移能力,细胞相对迁移率的差异有统计学意义[(73.574±7.264) vs (118.723±17.960),t=4.661,P<0.05];与阴性对照组相比(402.0±91.38),GDF15 siRNA组(237.4±47.33)能显著抑制MM.1R细胞的侵袭能力(F=255.403,P<0.05)。见图4。
2.6 GDF15 siRNA对MM.1R细胞周期与凋亡的情况
运用流式细胞术检测细胞周期与凋亡的情况,结果显示:48 h后,沉默组G0/G1 期细胞比例为(43.845±2.425)%,显著高于阴性对照组的(36.505±2.199)%,差异有统计学意义(F=8.152,P=0.034);沉默组S期细胞比例为(33.880±2.418)%,显著低于阴性对照组的(42.695±1.958)%,差异有统计学意义(F=13.046,P=0.017);72 h后,沉默组细胞G0/G1 期(41.185±2.538)%与阴性对照组(40.115±0.926)%比较,沉默组S期细胞(40.940±1.287)%与阴性对照组(41.095±1.322)%比较,差异均无统计学意义(F=5.974,27.244,P>0.05)。见图5。48 h后,沉默组(6.510±2.559)%的总凋亡率与阴性对照组(5.320±0.919)%比较,差异无统计学意义(F=0.808,P>0.05);72 h后,沉默组(4.875±2.580)%的总凋亡率与阴性对照组(4.075±1.449)%比较,差异无统计学意义(F=0.369,P>0.05),未见明显促进MM.1R细胞凋亡作用。见图6。
3 討 论
GDF15属于TGF-β超家族成员,是一种二聚体结构的应激反应蛋白,参与了肌动蛋白细胞骨架的重组与转移,它的生物学功能与TGF-β类似,在疾病的进展过程中发挥促进或抑制肿瘤生长的作用[6]。已有许多的研究证据表明,GDF15在多种肿瘤的增殖、迁移、侵袭、血管生成、细胞凋亡等致癌相关活动中发挥重要作用,但它在不同的肿瘤中可能执行的生物学功能不同。
GDF15是一个具有抑癌与促癌作用的双重身份基因[6]。一方面,在某些疾病中发挥促癌作用。ZHENG等人[7]研究发现,高表达GDF15可促进结直肠癌细胞转移,同时加速肿瘤细胞生长,体内研究结果也表明,沉默GDF15显著降低了来自结直肠癌细胞的异种移植瘤的发生和转移。在食管癌中GDF15表达上调,沉默GDF15后可以降低食管癌细胞的迁移和侵袭[8]。另外一方面,GDF15可发挥抑癌作用。HAN等人[9]研究发现,CXXC4可以通过上调GDF15促进胃癌细胞凋亡。在肺癌细胞中,过表达GDF15可以抑制p38-MAPK通路,导致凋亡增强[10]。在肝细胞癌的研究中,GDF15具有促进肝癌细胞凋亡和抗肿瘤的作用[11]。还有一种说法认为,GDF15在肿瘤发生发展的早期具有抑癌活性,而在肿瘤逐渐发展为恶性肿瘤时则成为肿瘤的启动子[12]。CORRE等人[13]发现MM中GDF15与骨髓浆细胞直接接触后,由骨髓间充质干细胞分泌产生,进一步研究发现GDF15可增强恶性B淋巴细胞的肿瘤形成并具有自我更新潜能。TANNO等人[14]发现血清或肿瘤微环境中的GDF15能诱导MM肿瘤起始细胞的扩增和恶性转化。可见,GDF15作为一种调节因子,它在肿瘤发生发展过程中发挥着非常重要的作用,但对于不同疾病作用机制有明显差异。
本课题组前期研究发现,GDF15在MM患者血清中处于高表达水平[5]。那么GDF15基因能否作为MM治疗的一个新型靶点,这需要进一步了解GDF15基因对MM细胞功能的影响。本研究通过体外构建GDF15的过表达和沉默质粒转染MM.1R细胞株,观察GDF15基因对MM细胞的增殖、迁移、侵袭、凋亡等细胞生物学行为的影响。研究结果显示:过表达GDF15在体外可促进MM细胞增殖,并随着时间的推移细胞增殖速度更快;沉默GDF15表达后,在体外干预72 h和96 h可抑制MM细胞增殖,并能显著抑制MM.1R细胞的迁移和侵袭能力;沉默GDF15还可以调节MM细胞周期进程,沉默GDF15 48 h后MM细胞G0/G1 期细胞比例显著高于阴性对照组,S期细胞比例显著降低,但未见明显诱导MM.1R细胞凋亡作用。结果提示GDF15基因可能通过调节MM细胞增殖、迁移、侵袭和细胞周期等方式参与MM发展进程。
但本研究的结果与CORRE等人[13]在2012年的开展的一项研究结果有所不同,他们发现在无血清培养的条件下,不同浓度的GDF15蛋白与多发性骨髓瘤细胞株MM1.S、MOLP-6共培养,GDF15对MM1.S细胞没有显著的增殖效果,但对MOLP-6细胞增殖效果显著。分析其原因,可能考虑:GDF15是骨髓基质细胞与浆细胞直接接触后产生的,它可以通过蛋白激酶B和SRY-SOX2依赖的方式增强多发性骨髓瘤细胞的致瘤潜能和自我更新能力[14],也能通过激活c-Fos调控上皮细胞-间充质转化基因,诱导肿瘤细胞的侵袭和转移[15],还能通过 RANKL-Erk1/2 信号通路促进细胞分化[16]。由此可见,它的作用机制可能是多途径、多方式的影响。此外,既往的大量研究也表明GDF15在肿瘤中扮演着促癌或抑癌的作用,结果不尽相同,这可能由于GDF15在不同的肿瘤中执行的生物学功能不同,针对不同的细胞特征也会出现不同的作用结果。本研究发现GDF15基因影响MM.1R细胞增殖、迁移和侵袭能力,并调节细胞周期。
下一步,本课题组将采用多个细胞株进一步了解GDF15基因对MM细胞功能的影响,也试图从GDF15基因的上下游蛋白去寻找调控通路(如Akt / CREB1、GDF15/PD-L1等),验证它们的相互作用,多途径揭示其更为明确的作用机制,为MM开发新的治疗靶点提供更多研究方向。
总之,GDF15基因影响多发性骨髓瘤细胞MM.1R的增殖、迁移和侵袭能力,并调节细胞周期,这可能会促进多发性骨髓瘤的进展。
参 考 文 献
[1] R?LLIG C,KNOP S, BORNHUSER M. Multiple myeloma[J]. Lancet, 2015, 385(9983):2197-2208.
[2] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016[J]. CA A Cancer J Clin, 2016, 66(1):7-30.
[3] LIU W P, LIU J M, SONG Y Q, et al. Mortality of lymphoma and myeloma in China, 2004-2017:an observational study[J]. J Hematol Oncol, 2019, 12(1):22.
[4] LODI R S, YU B, XIA L, et al. Roles and regulation of growth differentiation factor-15 in the immune and tumor microenvironment[J]. Hum Immunol, 2021, 82(12):937-944.
[5] LI R L, HU Z J, CHEN H P, et al. Association of growth differentiation factor-15 polymorphisms and growth differentiation factor-15 serum levels with susceptibility to multiple myeloma in a Chinese population[J]. Clin Lab, 2021, 67(1):55-64.
[6] KHALED Y S, ELKORD E, AMMORI B J. Macrophage inhibitory cytokine-1:a review of its pleiotropic actions in cancer[J]. Cancer Biomark, 2012, 11(5):183-190.
[7] ZHENG H T, WU Y C, GUO T A, et al. Hypoxia induces growth differentiation factor 15 to promote the metastasis of colorectal cancer via PERK-eIF2α signaling[J]. Biomed Res Int, 2020, 2020:5958272.
[8] DONG G, HUANG X Q, JIANG S Y, et al. SCAP mediated GDF15-induced invasion and EMT of esophageal cancer[J]. Front Oncol, 2020, 10:564785.
[9] HAN M J, DAI D J, YOUSAFZAI N A, et al. CXXC4 activates apoptosis through up-regulating GDF15 in gastric cancer[J]. Oncotarget, 2017, 8(61):103557-103567.
[10] CEKANOVA M, LEE S H, DONNELL R L, et al. Nonsteroidal anti-inflammatory drug-activated gene-1 expression inhibits urethane-induced pulmonary tumorigenesis in transgenic mice[J]. Cancer Prev Res (Phila), 2009, 2(5):450-458.
[11] XIAOBO ZHANG, YUE KANG, TONGXIN HUO, et al. GL-V9 induced upregulation and mitochondrial localization of NAG-1 associates with ROS generation and cell death in hepatocellular carcinoma cells[J]. Free Radic Biol Med, 2017, 112:49-59.
[12] EMMERSON P J, DUFFIN K L, CHINTHARLAPALLI S, et al. GDF15 and growth control[J]. Front Physiol, 2018, 9:1712.
[13] CORRE J, LABAT E, ESPAGNOLLE N, et al. Bioactivity and prognostic significance of growth differentiation factor GDF15 secreted by bone marrow mesenchymal stem cells in multiple myeloma[J]. Cancer Res, 2012, 72(6):1395-1406.
[14] TANNO T, LIM Y T, WANG Q J, et al. Growth differentiating factor 15 enhances the tumor-initiating and self-renewal potential of multiple myeloma cells[J]. Blood, 2014, 123(5):725-733.
[15] DING Y X, HAO K, LI Z H, et al. C-Fos separation from Lamin A/C by GDF15 promotes colon cancer invasion and metastasis in inflammatory microenvironment[J]. J Cell Physiol, 2020, 235(5):4407-4421.
[16] YUAN M Z, CHEN J M, ZENG Z Y. Knockdown of macrophage inhibitory cytokine-1 in RPMI-8226 human multiple myeloma cells inhibits osteoclastic differentiation through inhibiting the RANKL-Erk1/2 signaling pathway[J]. Mol Med Rep, 2016, 14(6):5199-5204.
(收稿日期:2022-12-07 修回日期:2023-02-09)
(編辑:梁明佩)
