黑曲霉与泡盛曲霉固态共发酵麦麸的工艺优化
2023-06-23韩亚斐周泉隋爱华尤红娟姚如永
韩亚斐 周泉 隋爱华 尤红娟 姚如永

摘要:为提高黑曲霉与泡盛曲霉固态共发酵麦麸释放酚类活性物质的能力,以培养基总酚含量为评价发酵效果的指标,应用Plackett-Burman实验设计与响应面分析法优化共发酵条件,通过光吸收法测定酚类产物的DPPH自由基清除率及总还原能力。实验结果表明,黑曲霉与泡盛曲霉固态共发酵麦麸的最佳工艺参数为:麦麸10.0 g、(NH4)2SO4含量17.0 mg/g麦麸、KH2PO4含量1.8 mg/g麦麸、含水量79.05%、黑曲霉与泡盛曲霉接种比例1∶2、接种量为1.1 mL(约1×107个孢子/mL)、发酵温度29 ℃、发酵时间6 d。此条件下,发酵产物总酚含量达到2 498.34 μg/g,比优化前提高了37.32%。发酵产物的DPPH自由基清除率、总还原力较优化前亦显著提高(P<0.05)。该工艺优化既提高麦麸释放酚类含量,又增强了产物的抗氧化能力,为麦麸的充分利用提供了实验依据。
关键词:固态共发酵;黑曲霉;泡盛曲霉;响应面法;抗氧化性
中图分类号:Q815 文献标志码:A
文章编号:1006-1037(2023)02-0011-09
doi:10.3969/j.issn.1006-1037.2023.02.03
基金项目:
青岛市中医药科技重点项目(批准号:2021-ZYYZ09)资助。
通信作者:
姚如永,男,博士,教授,主要研究方向为肿瘤微环境、微生物药学等。
麦麸作为小麦加工的主要副产品[1],含多种营养物质,但由于其难消化、机体吸收利用度差,尚未得到充分开发利用[2]。麦麸中含有丰富的天然酚类化合物,包括游离酚类(对羟基苯甲酸、没食子酸、香草酸、咖啡酸以及对香豆酸)和结合酚丁香酸、阿魏酸、肉桂酸和绿原酸等[3]。酚类物质不仅具有显著的抗氧化、抗菌、降血脂、抗突变与调节机体免疫等作用,还能抵抗环境中存在的烃、亚硝胺及真菌毒素等有害物质的诱变作用[4]。但麦麸中天然酚类化合物只有少量的游离酚和部分共轭酚可被小肠接触和吸收,生物利用度较低,如何提高麦麸中酚类物质利用度成为研究热点之一。传统强酸强碱化学提取方法难以保持提取物的生物活性,且环境污染大。谷物基质经微生物发酵后,产生的酶能切断结合酚的化学键,促进酚类物质释放,从而提高其生物利用度及生物活性[5-6],因此目前研究侧重微生物发酵。黑曲霉(Aspergillus niger)与泡盛曲霉(Aspergillus awamori)广泛应用于工业发酵,二者都具有较强的蛋白质表达与分泌能力[7-8],谷物基质经其发酵可显著提高酚类物质含量[9-10]。尽管黑曲霉和泡盛曲霉发酵均可以释放麦麸中的结合型酚酸,但大部分为液态发酵法,主要集中于单一菌种发酵,效率较低[11]。采用复合菌株协同发酵,可充分发挥微生物间的共生关系和互补性,提高发酵物质的转化率[12]。采用纳豆芽孢杆菌与嗜酸乳杆菌混合发酵麦麸,所测发酵产物活菌数明显增加,同时混合发酵产物的功能和作用均显著优于单发酵产物[13],证明复合菌株发酵具有明显优势。固态发酵相比液态发酵酚酸产量高,分解能力强,所得发酵组分具有更优异的生物活性和功能[14]。目前,微生物固态发酵麦麸释放酚类物质的相关研究报道较少[15],采用黑曲霉和泡盛曲霉固态共发酵麦麸释放酚类的研究尚未见报道。本文以麦麸为原料,通过单因素实验,分别探究麦麸添加量、(NH4)2SO4及KH2PO4含量、菌种比例、接种量、培养基含水量及发酵时间、温度等对发酵产物总酚含量的影响,以Plackett-Burman设计结合响应面分析优化混合发酵工艺,研究发酵产物的抗氧化性,为资源的再生利用、提高麦麸生产附加值提供参考。
1 材料与方法
1.1 实验菌株和试剂
黑曲霉GSTCC 60108、泡盛曲霉AF93028购自中国典型培养物菌种保藏中心(武汉)。
麦麸为市售(产地山东);马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基购自北京索莱宝科技有限公司;DPPH自由基试剂、没食子酸购自默沙克生物有限公司;2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene, BHT)由上海中秦化学试剂有限公司提供;Na2CO3、(NH4)2SO4、KH2PO4、甲醇均由上海埃彼化学试剂有限公司提供。
1.2 方法
1.2.1 孢子悬液制备 斜面培养基:称取46.0 g马铃薯葡萄糖琼脂,量取1 000.0 mL蒸馏水,121 ℃灭菌30 min。取黑曲霉与泡盛曲霉分别接种于新鲜的斜面培养基,30 ℃恒温培养4~6 d。待孢子成熟后,加入5.0 mL无菌生理盐水(含2%甘油),用无菌涂布棒轻轻平刮菌落表面,制成孢子悬液,稀释适当倍数使孢子浓度为1×107个/mL。
1.2.2 菌株单独发酵 称取已烘干麦麸5.0 g,放入250 mL锥形瓶中,加入16.0 mg (NH4)2SO4、1.0 mg KH2PO4及4.0 mL水,自然pH,摇晃均匀后密封,121 ℃灭菌30 min。冷却至室温后,分别接种1.0 mL(约1×107个孢子/mL)黑曲霉、泡盛曲霉孢子悬液,混匀后于30 ℃恒温恒湿发酵6 d。
1.2.3 固态共发酵 分别按1∶1、1∶2和2∶1的菌种比例接种1.0 mL(约1×107个孢子/mL)黑曲霉和泡盛曲霉孢子悬液于固态发酵培养基中,摇匀后30 ℃培养4~6 d,比较分析各比例及相同比例下各发酵条件的结果。
1.2.4 发酵后基质处理 分别准确称取各发酵条件的固态基质5.0 g于容器中,加入100.0 mL甲醇,50 ℃浸提30 min,提取3次。浸提液4 000 rpm/min離心15 min,旋转蒸发,浓缩液用甲醇定容至5.0 mL,得麦麸提取物,-20 ℃保存备用。
1.3 发酵工艺优化
1.3.1 单因素实验设计 以黑曲霉、泡盛曲霉为发酵菌种,设定麦麸5.0 g、(NH4)2SO4 16.0 mg/g麦麸、KH2PO4 mg/g麦麸、菌种比例1∶1、发酵时间6 d、含水量75%、发酵温度30 ℃、接种量1.0 mL(约1×107 个孢子/mL)为固定条件,分别研究麦麸添加量(2.5 g、5.0 g、7.5 g、10.0 g、15.0 g)、(NH4)2SO4含量(10.0 mg/g麦麸、13.0 mg/g麦麸、16.0 mg/g麦麸、19.0 mg/g麦麸、22.0 mg/g麦麸)、KH2PO4含量(0.6 mg/g麦麸、0.8 mg/g麦麸、1.0 mg/g麦麸、1.2 mg/g麦麸、1.4 mg/g麦麸)、菌种比例(2∶1、1∶1、1∶2)、发酵时间(3 d、4 d、5 d、6 d、7 d)、含水量(65%、70%、75%、80%、85%)、发酵温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)、接种量(0.8 mL、0.9 mL、1.0 mL、1.1 mL、1.2 mL)等因素对发酵后提取物酚类含量的影响。
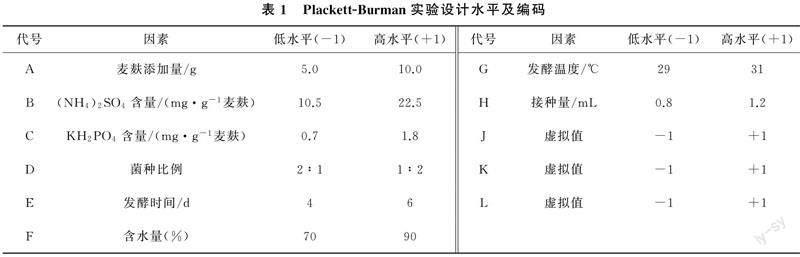
1.3.2 Plackett-Burmen实验设计 根据单因素实验结果,选取各因素最优值为Plackett-Burman实验设计中心点,优化發酵工艺。误差估计选取3个虚拟项、1个中心点。每个因素取2个水平,高水平编码为+1,低水平编码为-1。发酵产物总酚含量(μg/g)作为响应值Y,通过回归分析和数据处理,共完成13次试验(表1)。
1.3.3 最陡爬坡实验设计 根据上述实验结果,基于Design Expert 12.0.3软件分析各因素产生的影响效应值,依序排列,筛选影响总酚含量的显著因素完成最陡爬坡试验。以实验值的变化方向作为实验爬坡方向,依据实验结果确定步长,尽快逼近最大响应区域。
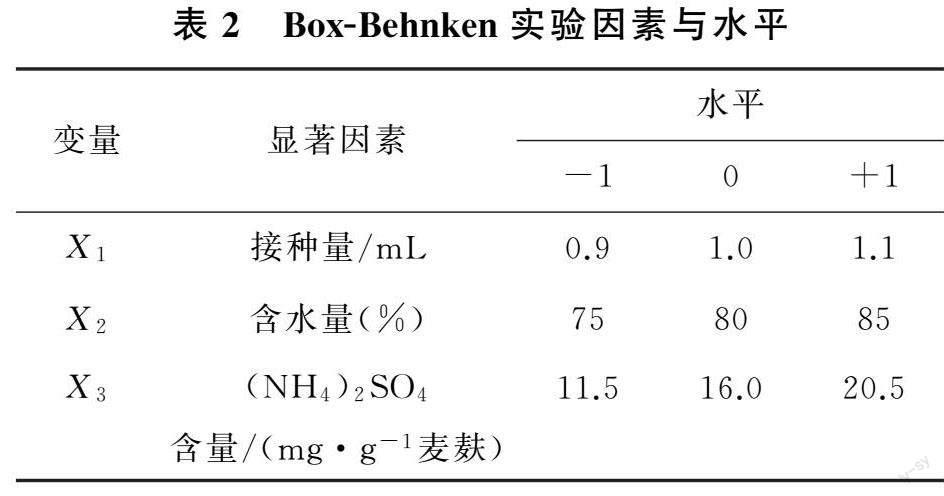
1.3.4 响应面法优化分析 基于最陡爬坡实验结果,以实验最优条件作为Box-Behnken中心组合设计的中心点,基于Design Expert 12.0.3软件完成三因素三水平的Box-Behnken实验设计(表2)。
1.4 指标测定
1.4.1 总酚含量测定 采用Folin-Ciocalteu法[16]测定麦麸提取物的总酚类物质含量。没食子酸为标准溶液,760 nm处测定吸光度制作标准曲线,回归方程为y=0.013x+0.019。准确移取麦麸提取液100.0 μL,按照Folin-Ciocalteu法完成三次平行测量,根据回归方程计算浓度值。
1.4.2 DPPH自由基清除率测定 取0.1 mL麦麸提取物,加入2.0 mL 6.25×10-5 mol/L DPPH甲醇溶液中,混匀后避光静置反应30 min,测定517 nm处的吸光度(A),此为测定组Ai;甲醇与DPPH混合溶液为对照组A0;甲醇与样品混合溶液为空白组Aj[17]。以0.1 mg/mL的BHT溶液为阳性对照。计算自由基消除率(%)=\[1-(Ai-Aj/A0)\]×100。
1.4.3 总还原能力测定 试管中加入0.1 mL麦麸提取物,同时加入2.5 mL磷酸缓冲液(0.2 mol/L, pH 6.6)和2.5 mL含量1%的铁氰化钾溶液。充分混匀后,50 ℃ 水浴20 min,加入2.5 mL 含量10%三氯乙酸,室温静置10 min。取2.5 mL反应液,依次加入2.5 mL蒸馏水与0.5 mL含量0.1%氯化铁溶液,充分混匀于室温静置10 min后,测定700 nm处的吸光度。阳性对照为0.1 mg/mL的BHT溶液[18]。
2 结果与分析
2.1 发酵工艺优化
2.1.1 单因素实验结果 测定不同发酵条件下麦麸提取物的总酚含量,以各因素总酚含量最高的条件为Plackett-Burmen实验设计的中心点(图1)。总酚含量随麦麸添加量的增加呈现先上升后下降的趋势,添加量7.5 g时总酚含量最高。(NH4)2SO4含量为16.0 mg/g麦麸、KH2PO4含量为1.2 mg/g麦麸时,产物总酚含量最高。黑曲霉和泡盛曲霉按1∶1比例发酵时,产物总酚含量最高。总酚含量随发酵时间延长呈先增加后降低趋势,发酵3~5 d期间产物中总酚含量逐渐升高,第5 d总酚含量最高(P<0.05),之后逐渐降低。培养基含水量为80%时总酚含量最高(1 988.49 μg/g)。发酵温度为30 ℃时,麦麸提取物总酚含量最高。不同混菌接种量对麦麸提取物的酚类含量有显著影响,混菌接种量为1.0 mL时总酚含量最高,显著高于其他条件(P<0.05)。因此,确定Plackett-Burmen实验设计的中心点为:麦麸7.5 g、(NH4)2SO4含量16.0 mg/g麦麸、KH2PO4含量1.2 mg/g麦麸、含水量80%、黑曲霉与泡盛曲霉接种比例1∶1、接种量为1.0 mL(约1×107个孢子/mL)、发酵温度30 ℃、发酵时间5 d。
2.1.2 Plackett-Burmen实验结果 实验(N=11)每组设置3个平行,以总酚含量为响应值(Y)。由表3、表4可知,PB实验模型的P值为0.003 3,表明该模型具有良好的显著性;接种量(H)、含水量(F)与(NH4)2SO4含量(B)对总酚含量有极显著影响(P<0.01,R2=0.981 4)。因此,后续实验选择接种量、含水量与(NH4)2SO4含量作为关键变量优化以获取最大响应值。
2.1.3 最陡爬坡实验结果 由于接种量、含水量、(NH4)2SO4含量均为显著正效应,故应提高接种量、含水量及(NH4)2SO4含量,加大步长以逼近最佳区域,其他影响因素值选取PB实验总酚产量最高的条件。由表5可知,随着接种量、含水量、(NH4)2SO4含量的增加,总酚含量先增高后降低,在路径2时达到最高(2 327.63 μg/g)。表明显著因素的最优值接近路径2实验值,即接种量1.0 mL、含水量80%、(NH4)2SO4含量16.0 mg/g麦麸,以此为Box-Behnken组合实验的中心点。
2.1.4 Box-Behnken实验和响应面设计 基于Box-Behnken实验结果建立回归模型,完成方差分析(表6、表7)。模型相關系数为R2=0.986 9,说明该模型拟合度高,能很好地预测混菌固态发酵优化的培养条件与总酚含量的关系。
2.1.5 确定最佳发酵工艺 由图2可知,该模型最大值X1=1.1,X2=79.05,X3=17.0,此条件下响应值Y为2 508.12。由此确定黑曲霉和泡盛曲霉共发酵麦麸的最优条件为接种量1.1 mL、含水量 79.05%、(NH4)2SO4含量17.0 mg/g麦麸,理论预测优化后培养基总酚含量为2 508.12 μg/g。
2.1.6 验证最佳发酵工艺 为确定实验结果可靠性,按最佳发酵工艺完成三次平行验证实验,结果平均值为2 498.34 μg/g,与理论值接近,说明所构建模型准确可靠,证明采用响应面分析法优化泡盛曲霉和黑曲霉共发酵麦麸的方案可行。以优化的最佳工艺发酵,麦麸提取物的总酚含量相比优化前提高了35.12%。
2.2 单独发酵与混合发酵总酚含量的比较
按照优化后的最佳发酵工艺配置培养基,分别于培养基接种黑曲霉、泡盛曲霉及混合菌株的孢子悬液(约1×107个孢子/mL),29 ℃发酵6 d后提取有效成分,比较各组发酵后总酚含量。由图3可知,黑曲霉与泡盛曲霉混合发酵后麦麸提取物总酚含量比其单独发酵含量明显增加(P<0.05),其中经工艺优化后混菌发酵的总酚含量(2 498.34 μg/g)最高,比混菌发酵工艺优化前提高了35.12%,比黑曲霉、泡盛曲霉单独发酵分别提高了45.76%、57.87%。这说明黑曲霉与泡盛曲霉的混合发酵有助于麦麸酚类物质的释放,进而提高总酚的提取率,经工艺优化总酚含量显著提高(P<0.05)。
2.3 抗氧化性能测定
DPPH是一种稳定的有机自由基,广泛应用于体外评价天然产物的抗氧化性,通过测定麦麸提取物对DPPH自由基的清除能力可评估其抗氧化性的强弱。由图4(a)可知,由不同菌株发酵的DPPH自由基清除能力存在差异,其中混合菌株工艺优化后发酵提取物的自由基清除率为76.27%,高于阳性对照BHT的清除率13.89%,比混菌发酵工艺优化前提高了30.07%,比黑曲霉、泡盛曲霉单独发酵分别提高了41.84%、53.64%。这表明优化工艺后混合菌株发酵可显著提高产物的DPPH自由基清除率,与麦麸提取物的酚类含量具有相关性。
本试验比较不同菌株发酵提取物对铁离子的还原力,吸光度值越大,则总还原力越强。以BHT为阳性对照,其吸光度为0.24,其他各组所测吸光度分别为0.18、0.17、0.19、0.26(图4(b))。混合菌株优化工艺后发酵提取物的总还原力,较优化前增强36.84%,较黑曲霉、泡盛曲霉单独菌株发酵结果分别增强44.44%、52.94%,有显著的统计学差异(P<0.01)。这说明混合菌株优化工艺后发酵产生的物质具有更强的还原能力,与DPPH自由基清除试验结果一致。
3 讨论
混菌固态发酵可充分利用不同菌株产生酶种类的协同作用,促使混菌间互利共栖,发酵产物更为丰富;同时借助菌种之间的共生作用,减少中间产物过大对发酵产物生成的负面影响,有助于增强混菌发酵能力,提高生产率[19]。采用枯草芽孢杆菌、地衣芽孢杆菌和酿酒酵母混合发酵麦麸,获得了产量较高且具有体外抗氧化和益生活性的阿魏酸糖酯[20],拓宽麦麸再利用思路。目前麦麸发酵释放酚类的研究主要侧重单菌株发酵或液体发酵,效率较低。泡盛曲霉以固液混合方式发酵麦麸,发酵浸提液的总酚含量为1 430.2 μg/g[21]。采用黑曲霉连续7 d固态发酵麦麸产阿魏酸等酚类物质,发酵至第3 d时麦麸中总酚含量达到2 400 μg/g,但发酵产物DPPH自由基清除率较低;随着发酵时间延长,黑曲霉又成为阿魏酸的呼吸碳源,导致总酚含量最终下降[22]。本文采用黑曲霉与泡盛曲霉混合固态发酵麦麸释放酚类活性物质,经过优化麦麸发酵总酚含量为2 498.34 μg/g,同时含有较高的自由基清除率,显著高于黑曲霉、泡盛曲霉单独发酵。黑曲霉与泡盛曲霉混合发酵不仅促使麦麸的部分束缚型酚类物质被释放,提高了酚类物质的转化率,而且共发酵所得组分具有更高的生物活性。但由于麦麸中酚类物质成分复杂,如何促进麦麸中酚类物质的完全释放还需深入研究。
4 结论
通过单因素实验和响应面分析法优化混合菌株发酵麦麸的工艺条件,综合考虑发酵相关因素,得到最佳发酵条件:麦麸10.0 g、(NH4)2SO4含量17.0 mg/g麦麸、KH2PO4含量1.8 mg/g麦麸、含水量79.05%、黑曲霉与泡盛曲霉接种比例1∶1、接种量为1.1 mL(约1×107个孢子/mL)、发酵温度29 ℃、发酵时间6 d。实验表明,黑曲霉与泡盛曲霉混合发酵麦麸,能有效促进麦麸中酚类物质的释放,显著提高发酵产物的总酚含量及抗氧化活性,为酚类物质的开发应用提供新资源。
参考文献
[1]宋硕. 小麦麸皮的综合利用研究进展[J]. 安徽农学通报, 2020, 26(16): 171-173.
[2]ZHANG L X, GAO W Y, CHEN X T, et al. The effect of bioprocessing on the phenolic acid composition and antioxidant activity of wheat bran[J]. Cereal Chemistry, 2014, 91(3): 255-261.
[3]SHARANAPPA T, CHETANA R, KUMAR G S. Evaluation of genotypic wheat bran varieties for nutraceutical compounds[J]. Journal of Food Science and Technology, 2016, 53(12):4316-4324.
[4]李光耀, 柴新想, 程伟, 等. 固态发酵技术强化麸皮酚类物质释放的研究进展[J]. 食品与发酵工业, 2022, 48(9):311-316.
[5]SONG T T, ZHANG Z F, JIN Q L, et al. Nutrient profiles, functional compositions, and antioxidant activities of seven types of grain fermented with Sanghuangporus sanghuang fungus[J]. Journal of Food Science and Technology, 2021, 58(11):4091-4101.
[6]CAIRNS T C, BARTHEL L, MEYER V. Something old, something new: Challenges and developments in Aspergillus niger biotechnology[J]. Essays in Biochemistry, 2021, 65(2): 213-224.
[7]DHULL S B, PUNIA S, KUMAR R, et al. Solid state fermentation of fenugreek (Trigonella foenum-graecum): Implications on bioactive compounds, mineral content and in vitro bioavailability[J]. Journal of Food Science and Technology, 2021, 58(5): 1927-1936.
[8]CHAI X C, HE C X, LIU Y T, et al. Degradation of wheat straw/polylactic acid composites by Aspergillus niger[J]. Polymer Composites, 2022, 43(3): 1823-1831.
[9]LEE I H, HUNG Y H, CHOU C C. Total phenolic and anthocyanin contents, as well as antioxidant activity, of black bean koji fermented by Aspergillus awamori under different culture conditions[J]. Food Chemistry, 2007, 104(3): 936-942.
[10] CAI S B, WANG O, WU W, et al. Comparative study of the effects of solid-state fermentation with three filamentous fungi on the total phenolics content (TPC), flavonoids, and antioxidant activities of subfractions from oats (Avena sativa L.)[J]. Journal of Agricultural and Food Chemistry, 2012, 60(1): 507-513.
[11] 周敏, 冷凱良, 王致鹏, 等. 产褐藻胶裂解酶菌株的筛选及发酵条件优化[J]. 青岛大学学报(自然科学版), 2019, 32(1): 37-45.
[12] 刘知非, 周婷, 胡晓磊, 等. 响应面法优化复合益生菌发酵枸杞汁的工艺研究[J]. 中国酿造, 2021, 40(4): 95-99.
[13] 牛丽亚, 黄占旺, 赵鹏. 纳豆芽孢杆菌和嗜酸乳杆菌混合发酵过程中营养物质变化的研究[J]. 粮食与饲料工业, 2009(4): 36-44.
[14] 欧仕益, 陈喜德, 符莉, 等. 利用黑曲霉发酵麦麸制备阿魏酸、肌醇和低聚糖的研究[J]. 粮食与饲料工业, 2003(5):31-32.
[15] GE X Y, SUN Z P, XIN D L, et al. Enhanced xylanase performance in the hydrolysis of lignocellulosic materials by surfactants and non-catalytic protein[J]. Applied Biochemistry and Biotechnology, 2014, 172(4): 2106-2118.
[16] CAI S B, GAO F Y, ZHANG X D, et al. Evaluation of γ-aminobutyric acid, phytate and antioxidant activity of tempeh-like fermented oats (Avena sativa L.) prepared with different filamentous fungi[J]. Journal of Food Science and Technology, 2014, 51(10): 2544-2551.
[17] LA J, KIM M J, LEE J. Evaluation of solvent effects on the DPPH reactivity for determining the antioxidant activity in oil matrix[J]. Food Science and Biotechnology, 2021, 30(3):367-375.
[18] VISWANATH V, UROOJ A, MALLESHI N G. Evaluation of antioxidant and antimicrobial properties of finger millet polyphenols (Eleusine coracana)[J]. Food Chemistry, 2009, 114(1): 340-346.
[19] 赵世光, 谢东宝, 储欣颖, 等. 混菌发酵制备茶籽多肽及其抗氧化作用[J]. 食品与工业发酵, 2022, 48(6): 147-153.
[20] 陈秋燕, 郝希然, 王园, 等. 麦麸阿魏酸糖酯微生物发酵工艺优化及体外抗氧化和益生活性评价[J]. 食品工业科技, 2021, 42(2): 138-145+160.
[21] 曹畅达, 方一铭, 黄兴, 等. 麦麸发酵条件的优化及其多酚提取物的抗氧化活性研究[J]. 工业微生物, 2022, 52(2): 25-29.
[22] 李丹青, 范娜. 黑曲霉发酵对麦麸多酚及其抗氧化活性的影响[J]. 商洛学院学报, 2016, 30(6): 48-52.
