气相色谱-质谱法测定植物性乳制品中植醇对映异构体含量
2023-06-07陈同强吴海智彭程程邱亚锋荆辉华邹子爵彭国泰李凯龙
陈同强,吴海智,梁 锋,向 俊,2,彭程程,陈 惠,邱亚锋,荆辉华,邹子爵,彭国泰,李凯龙*
(1.湖南省产商品质量检验研究院,湖南 长沙 410007;2.中南大学化学化工学院,湖南 长沙 410083;3.湖南省农业科学院植物保护研究所,湖南 长沙 410125)
植醇,又名叶绿醇(或叶黄烯醇),属于一类不饱和高级醇,广泛存在于自然界植物中,其为叶绿素的组成部分之一。叶绿素通过一定条件下水解可产生植醇[1-4],自然界中的植醇包括E构型和Z构型2 种异构体[5]。在有机化工及医药工业行业,植醇为重要的生产原料,随着现代经济的迅速发展,植醇的市场需求量处于上升趋势。植醇可作为生产护肤品的主要原料之一,能促使皮肤、毛发等变得更加有光泽,同时还具备一定的保湿作用[6]。
植物性乳制品相对于动物性乳制品的优势主要体现在两方面:一是清爽的口感,二是丰富的口味[7-9]。植物原料中脂肪含量相对偏低,如工艺合适,植物脂肪会比动物脂肪味道更加清淡,这样发酵出的植物酸乳产品也会更加清爽[10-12],同时带有植物原料的自然与清甜,无油腻感[13-15]。因动物类制品的高摄入,许多消费者开始出现肥胖、高血脂、高尿酸等疾病[16-18]。因此,低糖、低脂、高膳食纤维膳食成为热门食品发展的趋势[19-21]。消费者开始关注食品标签和营养成分含量,越来越青睐于天然产品,避免人工添加[22-23]。因此,植物性乳制品是不错的选择,而且植物性乳制品中含有特有功能成分,如膳食纤维、植物甾醇等,这些化合物均有利于身体健康[24-26]。
植醇对于内分泌有很好的辅助效果,具有刺激肝脏活力、促进血液循环、平衡内分泌、平衡神经等功效[27-30]。植物性乳制品中往往会因原料引入植醇,然而,目前关于食品中该类物质含量的检测方法报道却鲜见。李建法等[31]建立了松针软膏不皂化物中植醇含量的测定方法。本研究采用固相萃取结合气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用技术,建立植物性乳制品中植醇对映异构体含量的检测方法,并对10 种常见植物性乳制品中植醇对映异构体的含量进行测定,为植醇的检测提供技术支持,为其广泛应用提供参考依据。
1 材料与方法
1.1 材料与试剂
植物性乳制品(酸乳),购于淘宝,共10 份。
C18固相萃取小柱(500 mg,6 mL)、植醇(1 g,98.0%)、石油醚(分析纯,500 mL)、乙酸乙酯(色谱纯,4 L)、乙醚(分析纯,500 mL) 上海安谱实验科技股份有限公司;其他所用试剂均为色谱纯。
1.2 仪器与设备
7890B-5977B GC-MS仪(配备HP-5MS毛细管色谱柱(30 m×0.25 mm,0.25 μm) 美国Agilent公司。
1.3 方法
1.3.1 标准溶液的配制
植醇标准储备混合溶液(1 000 μg/mL):准确称取植醇标准品10 mg置于容量瓶中,甲醇溶解后定容至10 mL,涡旋混匀,-4 ℃冰箱中保存。
植醇标准工作混合溶液:准确移取1 000 μg/mL植醇标准储备混合溶液1.0 mL于100 mL容量瓶中,加入甲醇并定容,即得中间标准混合溶液(质量浓度10 μg/mL),再分别准确移取中间标准溶液0.05、0.10、0.20、0.40、0.50、1.00 mL于10 mL容量瓶中,甲醇定容,涡旋混匀,即得质量浓度分别为0.05、0.10、0.20、0.40、0.50、1.00 μg/mL的系列混合标准工作溶液。
1.3.2 样品前处理
准确称取试样10.0 g(精确至0.01 g)于50 mL塑料离心管,加少量水浸湿后,加入20 mL石油醚,涡旋振荡提取10 min后,以5 000 r/min、-4 ℃冷冻离心5 min,吸取上层有机层于梨形瓶中,重复上述提取过程1 次,提取液于梨形瓶中合并,35 ℃减压条件下挥发至近干。
加入5 mL乙酸乙酯溶解上述提取物,将样液全部转移至C18固相萃取柱后,静置平衡10 min,采用15 mL乙酸乙酯-乙醚混合溶液(2∶1,V/V)洗脱,收集洗脱液于塑料离心管中,加入3 g无水硫酸钠于洗脱液进行脱水。减压浓缩(温度控制在35 ℃以下)除去溶剂,挥发至近干,加入0.5 mL甲醇涡旋振荡30 s,继续减压浓缩至除尽乙酸乙酯-乙醚溶液,用甲醇定容至1.0 mL,混匀后,0.22 μm滤膜过滤,制得试样待测液,备用。
1.3.3 仪器条件
1.3.3.1 GC条件
进样口温度250 ℃;升温程序:初始温度50 ℃,保持1 min,以2 ℃/min速率升至90 ℃,再以40 ℃/min速率升至270 ℃,保持5 min;载气:高纯氦气;设置流速为1.0 mL/min;进样方式:不分流;进样体积1.0 μL。
1.3.3.2 MS条件
电离方式:电子轰击;离子源温度230 ℃;GC-MS接口温度280 ℃;监测方式:选择性离子监测;监测离子:定性离子m/z71、81、95,定量离子m/z123。
1.3.4 结果计算
式中:X为样品中植醇对映异构体含量/(mg/kg);ρ为测定液中植醇对映异构体的含量/(μg/mL);V为样品测定液的定容体积/mL;m为样品质量/g。
1.4 数据处理
采用Excel 2010软件进行数据处理及绘图。
2 结果与分析
2.1 色谱柱的选择
选用HP-1701MS(30 m×0.25 mm,0.25 μm)、HP-5MS(30 m×0.25 mm,0.25 μm)、HP-INNOWAX-MS(30 m×0.25 mm,0.25 μm)3 种常见不同极性毛细管色谱柱进行实验,结果表明,HP-5MS具有较好分离效果,而采用其他2 种色谱柱进行分析时,色谱峰拖尾现象较为严重,且目标组分与杂质分离效果较差,对结果定量存在较大的干扰。同时,柱箱的升温程序对各组分分离度也存在一定影响。最终经过多次实验摸索,参照1.3.3.1节升温程序时,实验样品中杂质峰干扰小,并且能获得较满意的分离效果。
2.2 提取方法的选择
实验室常见的提取方法主要包括3 种:索氏提取、超声提取及液-液萃取。索氏提取存在过程复杂、溶剂消耗量大、不经济等缺点;液-液萃取,对于乳制品易出现乳化现象,造成提取效率下降;而超声提取则具有简单、适合大批量样品处理且提取效率较高等特点,所以综合考虑,选择超声提取作为提取本实验样品的方法。
2.3 提取溶剂的选择
因植醇属于脂溶性化合物,实验室常见可供选择的提取试剂有乙腈、乙酸乙酯、正己烷、石油醚等。比较上述4 种常见提取溶剂对花生酸乳中植醇对映异构体的提取效率。由图1可知,相同加标水平(1.0 mg/kg)下,正己烷与石油醚提取效率相当,植醇对映异构体的加标回收率均维持在90%左右,高于其他2 种提取试剂,但考虑到石油醚经济成本较低,故选择石油醚作为植物性乳制品中植醇对映异构体的提取溶剂。
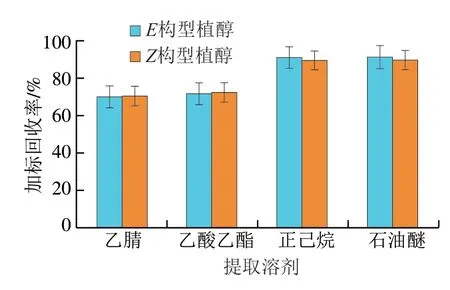
图1 不同提取溶剂对花生酸乳中植醇加标回收率的影响(n= 3)Fig. 1 Effect of different extraction solvents on spiked recoveries of phytol (n = 3)
2.3 净化方法的选择
因植物性乳制品中含有丰富的脂肪、蛋白质、糖类等化合物,属于基质复杂样品,易对目标物产生干扰,因此需对其进行净化处理。实验室常见的净化方法有弗罗里硅土固相萃取柱净化、C18固相萃取柱净化及QuEChERS净化管(内含乙二胺-N-丙基硅烷、硫酸镁等填料)净化3 种方式。通过相同水平(1.0 mg/kg)加标实验比较3 种方式的净化效果。由图2可知,样品经超声提取后的样液经C18固相萃取柱净化处理后,植醇加标回收率高于其他2 种净化方式,因此,选择C18固相萃取柱作为植物性乳制品中植醇检测的净化方法。
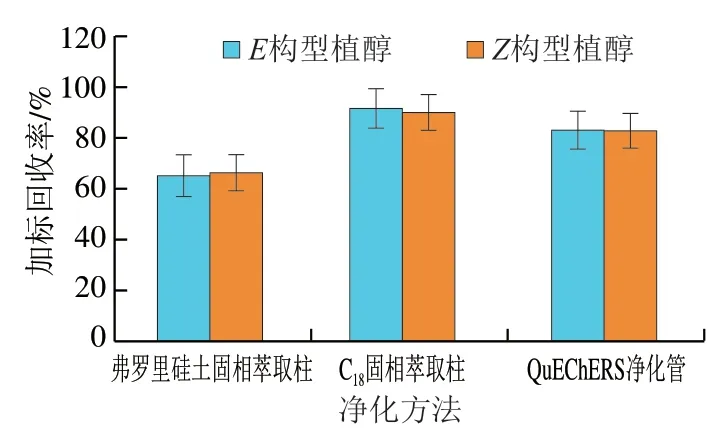
图2 不同固相萃取柱对花生酸乳中植醇加标回收率的影响(n= 3)Fig. 2 Effect of different SPE columns on spiked recoveries of phytol (n = 3)
2.4 标准谱图与线性范围
由图3可知,植醇对映异构体色谱峰型均呈现良好,二者分离效果好,且附近均无杂质峰干扰。同时,实验选取的对映异构体定量离子均为m/z123,该离子丰度较高,便于准确定量。分别以植醇对映异构体的质量浓度为横坐标(μg/mL),响应峰面积为纵坐标绘制标准曲线,在0~1.0 μg/mL范围内线性关系均良好,r均大于0.999。
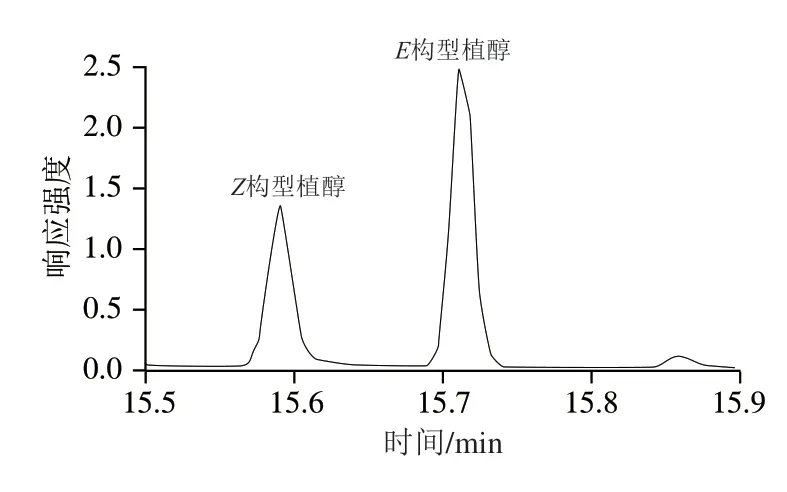
图3 植醇对映异构体标准品的选择性离子监测谱图Fig. 3 Selected ion monitoring chromatograms of phytohydrin enantiomers
2.5 方法检出限与定量限
注入一定质量浓度的植醇标准溶液1.0 μL,将3 倍信噪比作为本实验方法的检出限,经计算得E构型与Z构型植醇检出限分别为0.03、0.04 mg/kg;以10 倍信噪比作为本实验方法的定量限,经计算得E构型与Z构型植醇的定量限分别为0.09、0.10 mg/kg。
2.6 加标回收与精密度实验
称取空白样品(E构型与Z构型植醇均未检出)约10.0 g,共18 份,分别加入适量植醇标准混合溶液,每个添加水平做6 份平行,计算加标回收率,由表1可知,在不同加标水平下,E构型植醇、Z构型植醇平均加标回收率分别为78.6%~93.5%、79.5%~94.7%,二者相对标准偏差(relative standard deviation,RSD)均小于10%。

表1 植物性乳制品中植醇对映异构体加标回收率与精密度Table 1 Recoveries and precision of phytol enantiomers in spiked blank samples
2.7 植物性乳制品中植醇对映异构体含量测定
由表2可知,10 种植物性乳制品中有8 种检出植醇对映异构体,且E构型含量普遍高于Z构型,但总体含量都不高,基本上处于定量限附近。

表2 10 种植物性乳制品中植醇对映异构体的检出情况Table 2 Results of detection of phytol enantiomers in 10 plant-based dairy products
3 结 论
通过对前处理过程,如提取方法、提取溶剂及净化方式等进行适当优化,建立固相萃取-GC-MS法测定植物性乳制品中植醇对映异构体的分析方法,该方法具有灵敏、准确、重复性好等特点,为植物性乳制品中植醇对映异构体的开发与利用提供了一定技术手段。通过对市面上常见10 种植物性乳制品中植醇对映异构体进行随机检测,为植物性乳制品中植醇含量的监测及植物中植醇的开发利用提供了参考依据。
