姜荷花‘红色印象’工厂化组培育苗技术研究
2023-05-30谭健俊叶远俊刘金梅朱根发许伟兵崔晓东徐晔春
谭健俊 叶远俊 刘金梅 朱根发 许伟兵 崔晓东 徐晔春

关键词:姜荷花;外植体;丛生芽诱导;组培;规模化生产
中图分类号:S682.2 文献标识码:A
姜荷花(Curcuma alismatifolia)为姜科姜黄属多年生球根花卉,原产于泰国北部,主要观赏部位是花序顶端的不育苞片,因其形似郁金香,有“热带郁金香”的美誉,具有花型优美、颜色艳丽、观赏期长等优点[1-2]。荷兰、泰国等最早对姜荷花进行开发研究和商业种植,作为优秀的切花品种引入世界花卉市场[3-4]。中国于1999 年开始引进栽培,在台湾、广东、福建等地均有分布种植[5]。在华南地区生长的姜荷花,自然花期在6—10 月,正好填补夏秋季节盆花和切花短缺的空档[6]。近年来,随着对姜荷花品种杂交选育,以及栽培技术的改良,培育了许多适合推广的品种,如‘红色印象‘鸿运‘影子红等,优质种苗的需求日益增加[7-9]。自然条件下,姜荷花主要通过地下块茎繁殖,存在周期长、效率低、病虫害风险高等弊端,而利用植物組织培养技术,进行工厂化组培育苗,可以满足市场对种苗的需求,实现保质保量。
目前,姜荷花组培扩繁技术研究多集中于培养基种类和激素浓度的筛选。牟小翎等[10]2006 年研究发现采用姜荷花球茎萌发的小芽作外植体,在MS+NAA 0.02 mg/L 的培养基上成功诱导丛生芽,在MS+BA 1.0 mg/L+NAA 0.02 mg/L 的培养基上进行继代增殖,最终获得大量组培苗并移栽成活,实现姜荷花引种国内后首次组培扩繁。商宏莉等[11]在‘红观音姜荷花的组织培养中发现,采用剥去被膜的球茎切成小块后,接种到MS+BA2.0~3.0 mg/L+NAA 0.2~0.3 mg/L 的培养基上诱导丛生芽,增殖阶段采用花宝2 号为主的培养基和TDZ 0.5 mg/L 的组合效果最佳,增殖系数可达3.73,经过生根壮苗后移栽成活率可达95%以上。赵彦杰等[12]研究姜荷花组培快繁技术,使用消毒后的块茎切成带有1~2 个芽点的小块,接种在MS+BA 2-3 mg/L+NAA 0.2 mg/L 培养基上获得最佳丛生芽诱导效果,增殖阶段继代接种在MS+BA2 mg/L+NAA 0.2 mg/L+10%椰子水,增殖倍数可达4.4,经过生根壮苗后移栽到疏松透气的基质中成活率可达94%。在国外的组织培养报道中,多集中于姜黄属姜黄、郁金等药用植物的组培快繁,也有利用姜荷花未成熟花蕾为外植体材料诱导丛生芽的报道[13-14]。TOPPOONYANONT 等[15]使用MS+BA 10.0 mg/L+IAA 0.1 mg/L 培养基接种未成熟的花芽,利用含有高浓度6-BA 的MS 培养基诱导花芽转变成叶芽,成功获得大量丛生芽,在增殖继代阶段使用MS+TDZ 0.5 mg/L+IMA4.0 mg/L 的培养基,高浓度细胞分裂素使丛生芽延缓生长并不断分化芽点,获得大量芽簇,可使接种的1 个芽接种后增殖分枝得到30~40 个小芽簇, 最后在生根阶段MS+BA 0.3 mg/L+IAA0.1 mg/L 培养基中恢复正常生长,并移栽成苗。迄今为止,对姜荷花流行品种和姜黄属资源开展组培快繁研究较多,关于‘红色印象的快繁研究尚未开展。
在工厂化组培扩繁育苗过程中,综合成本和时间周期是重要的参考因素,实践操作要求也必须降低,如外植体消毒污染率,切分丛生芽接种的操作难度等,同时小苗生长的一致性和移栽成活率也是需要注意的问题。为此,本研究以姜荷花‘红色印象为研究对象,通过对其各个部位的外植体消毒接种,挑选作为外植体的最佳部位,增殖阶段比较分析不同浓度激素对组培苗增殖系数的影响,最后生根壮苗出瓶,对移栽不同的种植基质的成活率进行比较,最终优化完善姜荷花工厂化组培扩繁育苗技术流程,实现技术与生产实践相结合,满足市场对姜荷花‘红色印象种苗生产的需求。
1 材料与方法
1.1 材料
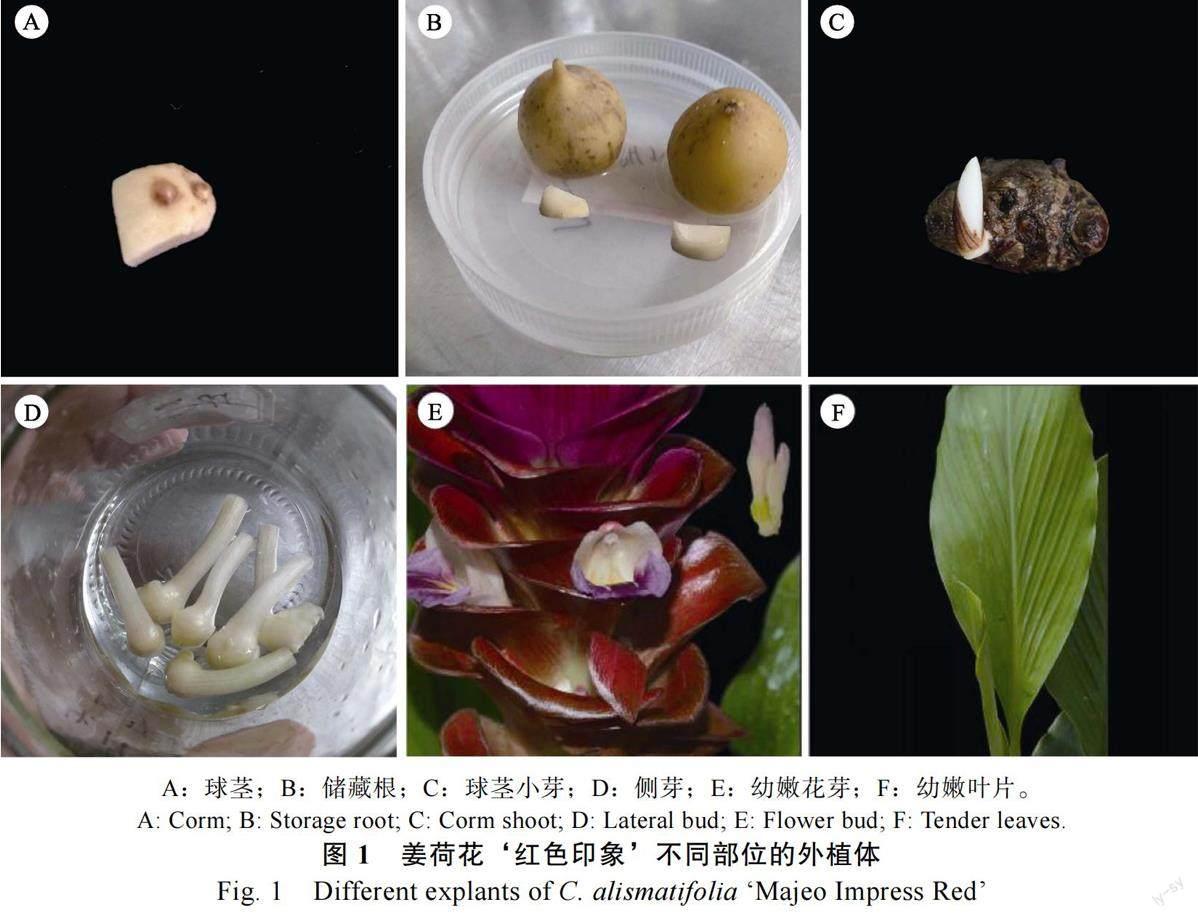
试验材料种植在广东省农业科学院白云基地环境园艺研究所大棚内,选取外观饱满、干净无损伤的姜荷花‘红色印象种球和健壮无病虫害的植株,分别取材姜荷花的球茎、储藏根、球茎小芽、侧芽、幼嫩花芽、幼嫩叶片进行消毒接种(图1)。在取材前进行适当控水保持干燥,降低外植体带菌量,其中球茎和储藏根于休眠期取材(12 月至翌年3 月),球茎小芽于萌芽初期取材(4—5 月),侧芽、幼嫩花芽、幼嫩叶片于旺盛生长期取材(6—9 月)。MS 培养基成分药品、6-BA和NAA 购自生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 不同外植体消毒处理 ①姜荷花种球球茎取回后,用洗洁精反复清洗表面,在流水下冲洗30 min,将储藏根和球茎分离,表皮清理干净后,在超净工作台上进行消毒处理,先用75%酒精消毒1 min,再加入1 滴吐温80 的0.1%升汞溶液消毒20 min,无菌水冲洗5 遍,二者均切成小块,球茎的小块需带上1~2 个芽点接种。②用沙藏法恒温箱28℃催芽获得姜荷花球茎小芽,待小芽萌发到2~4 cm 时切下,流水下冲洗30 min,消毒过程同上,切除消毒坏死伤口后直接接种在诱导培养基上。③选择姜荷花主芽开花后旁边萌发出的10 cm 以上侧芽,切下后在流水下冲洗30 min,消毒过程同上,根据芽大小切分为2~4 块带芽点的小块接种到丛生芽诱导培养基(图2A)。④选取包裹在叶鞘中的未成熟花序,在超净工作台上剥开叶鞘切下幼嫩花序,用75%酒精消毒1 min后,无菌水冲洗5 遍,在无菌条件下剥去苞片,将其中整个花芽簇切下接种。⑤选用抽出但未展开的幼嫩叶片,用75%酒精消毒30 s 后,再加入1 滴吐温80 的0.1%升汞溶液消毒8 min,无菌水冲洗5 遍,将幼叶切成0.5 cm×1 cm 左右的小块,接种在诱导培养基上。
1.2.2 丛生芽诱导培养 选用 MS 培养基进行丛生芽诱导培养,设置不同的6-BA 浓度,具体配方为MS+6-BA(0、1、3、5、10 mg/L)+NAA0.2 mg/L+蔗糖30 g/L+卡拉胶7 g/L,pH 调至5.8。采用小口径组培瓶,每瓶只接种1 个外植体(图2B),防止交叉污染,不同部位外植体不同培养基各接种30 瓶,2 周后统计污染数量。接种后每隔1 个月继代更换1 次培养基,并适当切除褐化组织和叶片,保留小芽,记录下接种后第1 个月的外植体芽启动个数。第2 个月继代到增殖培养基上,并记录丛生芽的小芽数量。姜荷花的幼嫩花芽诱导丛生芽的周期较长,第1 个月无明显的芽启动现象,因此在第2 个月时统计外植体芽启动个数,在第3 个月继代到增殖培养基上,并记录丛生芽的小芽数量。按下列公式计算污染率、芽启动率和丛生芽平均芽数:
1.2.3 丛生芽增殖培养 选用 MS 培养基进行丛生芽增殖培养,设置3 种不同6-BA 浓度,具体配方为MS+6-BA(1、3、5 mg/L)+NAA 0.1 mg/L+蔗糖30 g/L+卡拉胶7 g/L,pH 调至5.8。采用240 mL 广口组培瓶,挑选诱导培养中健康生长的丛生芽,用无菌镊子和手术刀将丛生芽叶子和根系去除,切割至带有1~2 小芽的小块,每瓶接种7 个(图2C),每种培养基接种50 个芽块,在培养室光照下恒温培养,每月继代1 次,记录继代接种后出芽个数,3 个月后转入生根壮苗培养,最终统计组培苗数量,按下列公式计算增殖系数:
1.2.4 生根壮苗培养 姜荷花生根容易,只需降低激素浓度,减少丛芽诱导,使用常规的1/2 MS的生根培养基,具体配方为1/2 MS+NAA 0.1 mg/L+蔗糖20 g/L+卡拉胶7 g/L,pH 调至5.8。采用340 mL 广口组培瓶,将增殖培养获得的丛生芽去除叶片后,挑选优质健壮的小芽,切割成单芽接种,每瓶接种7 棵,培养室室内恒温光照培养1个月(图2D),剩余丛生芽可以继代留种,作为下一轮扩繁的母瓶。
1.2.5 炼苗移栽育苗 待组培苗株高达到10 cm以上,具有3 片以上叶片时进行炼苗移栽。将达到出苗标准的组培瓶搬到大棚苗床上炼苗至少1周,清洗干净根系附近的培养基,适当修剪叶片,用多菌灵1000 倍液溶液浸泡根系10 min,种植在50 孔育苗穴盘上,注意遮阴保湿,定植后逐渐进入正常水肥管理。基质选用纯细椰糠、纯细泥炭和细椰糠∶细泥炭1∶1 混合基质,每种基质各种100 棵,每组处理3 个重复,1 个月后统计移栽成活率(图2E)。
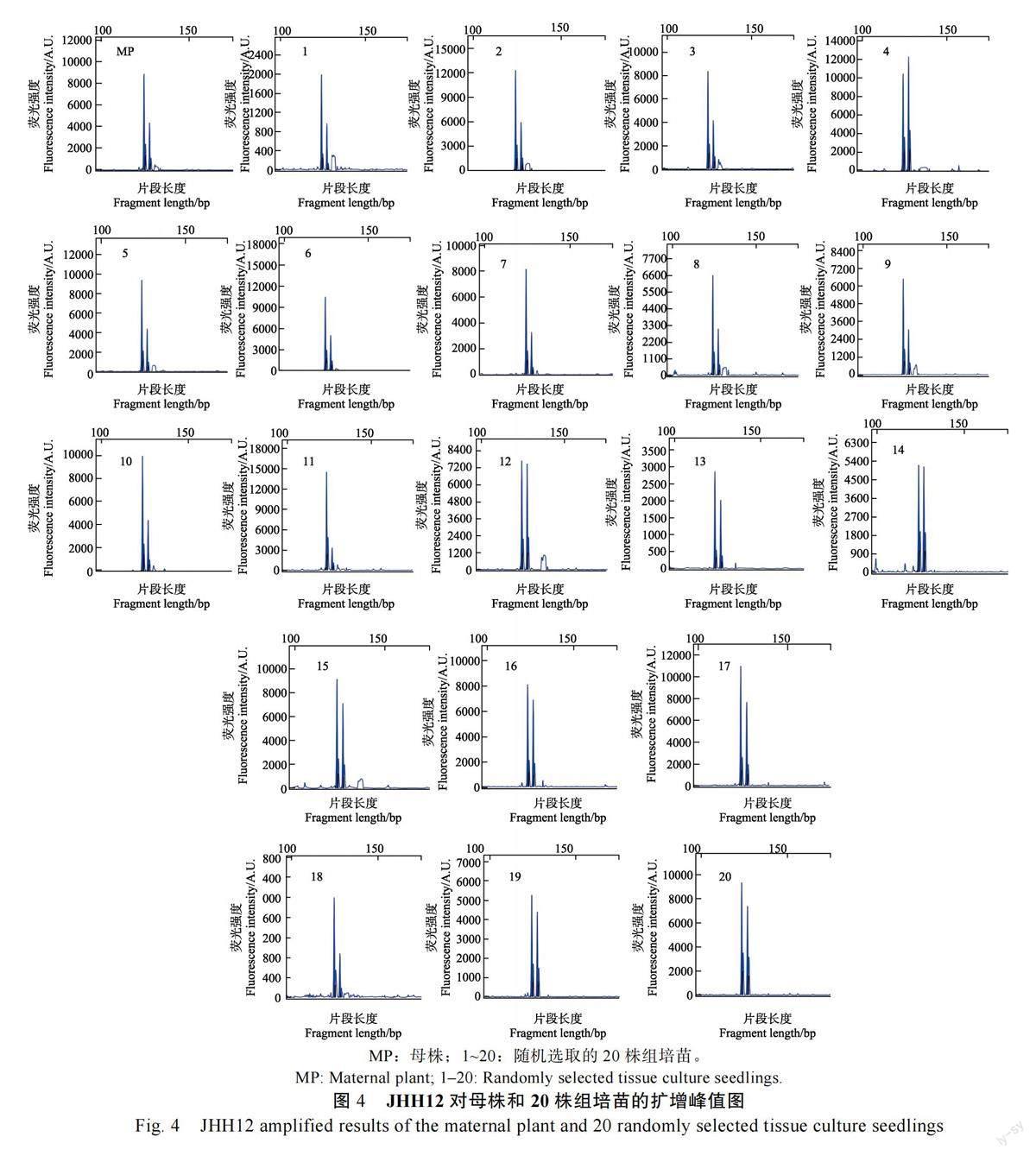
1.2.6 组培苗遗传稳定性检测 采集母株和随机选择20 棵留种扩繁第10 代的组培苗幼嫩叶片,采用北京天根公司试剂盒提取基因组DNA,利用TP-M13-SSR 分子标记技术进行遗传稳定性检测。选用课题组前期开发的EST-SSR 标记用于扩增[5],在1.5%琼脂糖电泳中检测扩增稳定性,并利用TP-M13 荧光测序技术进一步检测多态性[16]。扩增产物在ABI 3730 DNA 自动测序仪上进行检测,利用GeneMarker 1.51 对测序数据进行收集和分析。
1.3 数据处理
采用 Excel 2010 和SPSS 21.0 软件对数据进行统计分析,并利用Duncans 法进行多重比较,检验各平均值在0.05 水平上的差异显著性。
2 结果与分析
2.1 姜荷花外植体和丛生芽诱导培养基的筛选
本研究通过接种姜荷花不同部位的外植体,以不同6-BA 浓度的MS 培养基启动诱导,研究诱导姜荷花丛生芽最高效的方法,结果如表1 和表2 所示。由表1 可知,不同的外植体污染率差别较大,其中球茎和储藏根接种污染率较高,均达到50%以上,其他部位的接种污染率控制在20%以内,主要与外植体生长部位环境相关,初步表明地上部位消毒效果优于地下部位。在丛生芽诱导效果方面,储藏根和叶片均无法诱导丛生芽,只有含芽点的部位可以直接诱导丛生芽。幼嫩花芽需要高浓度的6-BA 或者效果更强的细胞分裂素诱导才能产生丛生芽,且诱导培养时间最长,不适宜用于姜荷花工厂化育苗。球茎小芽和侧芽的效果最好,丛生芽启动率达70%以上,可作为外植体诱导效果最佳的材料。
由表 2 可知,当诱导培养基中6-BA 浓度上升时,丛生芽启动率不断增加。6-BA 浓度≥3 mg/L 时,球茎小芽和侧芽的丛生芽启动率可以达到近80%。丛生芽的平均小芽数量也随着6-BA浓度的增加而增加,当诱导培养基中6-BA 浓度为10 mg/L,球茎、球茎小芽、侧芽诱导的丛生芽平均芽数最高,达到2.4~2.5。同时发现高浓度6-BA 诱导的丛生芽虽然数量多,但小芽浅绿细长,继代后小苗生长势较弱,有玻璃化趋势。幼嫩花芽的丛生芽诱导需要5 mg/L 及以上的高浓度6-BA 诱导启动,否则无法诱导花芽转变产生叶芽,继而分化获得丛生芽。结合消毒接种的操作难度,发现姜荷花诱导初代丛生芽的最佳外植体材料是球茎小芽和侧芽,最佳诱导培养基为MS+6-BA ( 3 、5 mg/L ) +NAA 0.2 mg/L+ 蔗糖30 g/L+卡拉胶7 g/L,pH 调至5.8。
2.2 姜荷花丛生芽增殖培养基筛选
由表 3 可知,当增殖培养基的6-BA 浓度增加,姜荷花丛生芽的增殖系数明显提升,其中6-BA 浓度为5 mg/L 的增殖培养基的平均增殖系数最高,达到2.54,壮苗数量也最多,为643 棵。由外植体诱导获得的初代丛生芽,在增殖培养基上不断继代,每一轮的增殖系数呈现上升趋势,外源激素在丛生芽体内累积效应明显,其中6-BA浓度为5 mg/L 的增殖培养基在第3 轮的继代培养中,增殖系数高达3.43。虽然在高浓度6-BA 的影响下丛生芽数量大幅增加,但丛生芽的整体质量不断下滑,在第3 轮6-BA 浓度为5 mg/L 的增殖培养中观察发现,部分新生的丛生芽出現伸长生长受抑制,形成被抑制的芽簇。虽然增殖系数增加,但组培苗之间生长速度变得不一致,品质也难以控制,对工厂化生产较为不利。在6-BA浓度为≤3 mg/L 的增殖培养基中未发现芽生长受抑制的现象,组培苗健壮正常生长。因此,姜荷花工厂化育苗的最佳丛生芽增殖培养基为MS+6-BA 3 mg/L+NAA 0.1 mg/L+蔗糖30 g/L+卡拉胶7 g/L,pH 调至5.8。
2.3 姜荷花生根壮苗和炼苗移栽
在增殖培养后期挑选生长健壮的单个小芽,接种在1/2 MS+NAA 0.1 mg/L+蔗糖20 g/L+卡拉胶7 g/L 的壮苗培养基上,发现组培苗生长健壮,整齐度一致,壮苗效果明显。由表4 可知,3 种基质的移栽成活率均达到90%以上,通过方差分析显示基质间的平均成活率无显著差别。不同基质间姜荷花组培苗的生长情况略有差异,细泥炭保水性强,但透气性差,出现少量组培苗根茎腐烂死亡的现象,是3 种基质中成活率最低的。细椰糠透气性强,保水保肥能力一般,成活率接近混合基质,但小苗后期生长叶缘发黄,可能与缺素症相关。细椰糠∶细泥炭1∶1 混合基质的平均成活率最高,达95.33%,小苗后期生长健壮,无不良症状,适宜作为出苗移栽的最佳基质。移栽后对小苗进行观察,表型稳定,未发现明显的表型变异。
2.4 组培苗遗传稳定性分析
使用 8 对EST-SSR 标记引物对随机选取的20株组培苗扩繁到第10 代组培苗进行遗传稳定性分析。结果(表5)显示,8 对引物全部可以稳定扩增出清晰的条带(图3),产物大小范围为100~300 bp。毛细管电泳检测结果如图4 所示,引物JHH12 在母株和20 株组培苗中均有2 个峰值,产物大小完全一致,表明组培苗未发生DNA水平的变异,与母株完全一致。
3 讨论
工厂化组培育苗的快速繁殖主要通过器官发生途径实现,可分为直接器官发生途径和间接器官发生途径[17]。前者主要是通过主芽、侧芽等作为外植体通过外源激素诱导产生不定芽,再通过人工切割操作,实现丛生芽数量的倍数增加,该途径优点是变异率低,可以保持母本优良性状,后者则是通过外源激素诱导外植体产生愈伤组织,通过继代增殖愈伤组织,最终再分化得到新植株,该途径优点是增殖系数高,外植体取材方便,只需要幼嫩叶片等作为外植体材料,但变异率高难以保持母本性状[18]。
在本研究中,姜荷花‘红色印象的幼嫩叶片和储藏根接种诱导并未观察到愈伤组织产生,可以得知姜荷花的组培快繁主要通过直接器官发生途径,属于较难诱导愈伤产生和再分化的植物之一,这与MAHADTANAPUK 等[19]对姜荷花组织培养研究结果相似。在外植体的选择上,姜荷花的球茎由于长期埋在土壤中,作为外植体消毒效果差,接种后污染率高,而且由于球茎上的芽点过于幼嫩,在消毒过程中活力容易受到影响,不适宜批量取材接种。而选择花芽作为外植体,虽然污染率低,但是取材时期受限制,只有姜荷花开花早期的5—8 月可以取材,使用花芽诱导叶芽发生需要的时间也更长,需要60~80 d。较为理想的外植体材料为球茎小芽和侧芽,诱导丛生芽的时间短,只需要30~50 d。球茎小芽取材方便,可以通过沙盘法催芽全年取材。在大规模的工厂化育苗过程中,品种的准确性至关重要。所有外植体材料中,侧芽的取材时期为母株第一次开花后,可以做到准确判断品种,防止出现取材错误,在生产中实现保质保量。通过随机选取20株扩繁第10 代的组培苗,提取DNA 进行的TP-M13-SSR 分子标记毛细管电泳检测,研究结果表明8 对EST-SSR 标记引物扩增目的片段的大小数量与母株完全一致,与母株相比均未发生DNA 水平上的变异,通过该组培技术扩繁10 代的种苗依旧保持低变异率[20-21]。
姜荷花的组培以MS 培养基为主,在许多姜黄属植物的组织培养中使用广泛[22-24],本研究中姜荷花组培苗生长生根健壮正常,叶片鲜绿,培养效果较好。姜荷花的增殖继代培养主要使用6-BA、TDZ 等细胞分裂素诱导实现丛生芽的增殖,当使用低浓度细胞分裂素,如6-BA 浓度为1~3 mg/L 的MS 培养基做增殖培养时,丛生芽正常生长,增殖系数保持在2~3 之间,组培苗生长速度一致,适合作为工厂化组培快繁的增殖培养基使用。当增殖培养基中6-BA 浓度≥5 mg/L 或使用细胞分裂素活性更强的TDZ 作增殖培养时,姜荷花的部分不定芽伸长生长受到抑制,呈现被抑制的丛生芽状态,继代到低浓度细胞分裂素的培养基上可以逐渐恢復正常生长,其增殖系数可以达到4~8。但该增殖方式不适用于工厂化组培育苗,组培苗生长速度不一致对工厂化管理和生产计划安排会造成较大麻烦。这种增殖方式适合优良新品种(系)的扩繁或者稀有品种的母瓶生产,高增殖系数可以快速获得大量组培苗母瓶或者小苗。
通过本研究获得生长整齐一致的姜荷花组培苗,同时对姜荷花组培苗的出瓶移栽育苗技术进行研究,发现姜荷花组培苗喜疏松透气的基质,生根简单,移栽成活率高,可达到90%以上成活率,其中组培苗种植基质选用细泥炭∶细椰糠1∶1 混合基质最佳[25]。单独使用其中一种基质效果低于两种混合效果,细泥炭保水性强,含有大量有机营养,但在高温高湿条件下容易滋生病原菌,加上组培苗出瓶过程容易受到机械擦伤,种植过程中观察到少量组培苗出现根茎腐烂现象,因此不适合直接使用细泥炭出苗种植。细椰糠整体pH呈酸性,不易滋生病菌,透气性强,适合作为姜荷花组培苗出瓶移栽育苗的种植基质,但椰糠矿质元素含量低,栽培过程中需要及时补充营养元素,进入后期旺盛生长阶段时养分供应不足,出现叶缘发黄现象[26]。椰糠适合用于混配基质,经过混合细泥炭等基质改良后使用效果更佳。
综上,姜荷花‘红色印象工厂化组培育苗技术的关键点在于克服外植体诱导丛生芽,丛生芽增殖扩繁,以及出瓶移栽育苗步骤。研究结果表明,姜荷花‘红色印象最佳的外植体为球茎小芽和侧芽,基本可以满足全年任何时候的外植体接种需要,最佳诱导培养基为MS+6-BA(3、5 mg/L)+NAA 0.2 mg/L+蔗糖30 g/L+卡拉胶7 g/L。增殖扩繁阶段的最佳丛生芽增殖培养基为MS+6-BA 3 mg/L+NAA 0.1 mg/L+蔗糖30 g/L+卡拉胶7 g/L,丛生芽增殖系数达到2~3,小芽生长健壮,切分操作简单。生根壮苗培养基选用1/2 MS+NAA 0.1 mg/L+蔗糖20 g/L+卡拉胶7 g/L,生根率100%,经过炼苗后出瓶移栽,组培苗种植基质宜选用细泥炭∶细椰糠1∶1 混合基质最佳,出瓶移栽成活率95%以上,经过表型观察和分子检测,扩繁多代的组培苗表型和DNA 水平上与母株相比均未发生明显变异。
