PPO处理对水曲柳合子胚子叶外植体褐化和体胚发生的影响1)
2012-07-02沈海龙李玉花
孙 倩 杨 玲 沈海龙 李玉花 黄 剑
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
水曲柳(Fraxinus mandshurica Rupr.)是木犀科白蜡树属大乔木树种,主要分布于我国东北,是著名的东北“三大硬阔”之一的优质用材树种。在水曲柳体胚发生研究中发现,利用合子胚为外植体可以诱导产生水曲柳体胚[1-3],但产生体胚过程中伴随着外植体的褐化现象,发生体胚的外植体基本上都处于褐化状态,而且褐化外植体上诱导出的体胚长势良好[4]。进一步研究证实,水曲柳体胚发生与外植体褐化的伴随关系较固定,诱导产生的褐化有利于其体胚发生[5-6]。褐化是指外植体或培养材料接种后,在组织培养过程中由于切割造成机械损伤,伤口处分泌出酚类化合物,在有氧的条件下,切面细胞中的酚类物质由多酚氧化酶催化氧化为醌,醌再通过非酶促反应产生有色物质而导致组织褐变,变成棕褐色或暗褐色,并逐渐扩散到培养基中,抑制细胞内其它酶的活性,影响细胞的正常代谢,毒害整个组织,甚至导致组织死亡;尤其是木本植物组织的外植体,褐变死亡是其培养难度较大的主要因素[7-9],因而大部分组织培养过程都需要抑制外植体的褐化。李官德等[10]的研究提到,棉花的褐化且生长缓慢的愈伤组织能分化出体胚,并再生成植株。蓝桉体胚发生的研究中发现,在培养基中添加抗氧化剂并不能显著降低外植体的褐化程度,但使用降低褐化程度的抗氧化剂则可抑制体胚的发生,同时降低了多酚的积聚[11],认为多酚的积聚在体胚发生中具有一定作用,只是这种作用尚不为人知。有研究发现,水曲柳体胚发生过程中的外植体褐化比棉花[10]和蓝桉[11]的表现更加明显,因此在由合子胚子叶为外植体诱导水曲柳体胚产生的过程中伴随着外植体的褐化,被视为一个很普遍的现象。但这种现象与绝大多数植物组织培养中外植体褐化的效应相反。因此本研究试图揭示水曲柳体胚发生中外植体褐化与体胚发生的关系,并根据已有的研究从DNA甲基化修饰、细胞程序性死亡(PCD)和生理生化检测等多个角度探索这个现象的机理和应用技术。
多酚氧化酶(polyphenol oxidase,PPO)在植物细胞中以游离态和束缚态两种形式存在[12],是褐化过程中的主要酶类。因PPO的专一性,不会对酚类以外的物质作用,性质相对柔和,能够引起植物组织的褐化,因此,设想利用在培养基中加入PPO来诱导外植体发生褐化,从而促进体胚发生。本研究通过在液体培养基中加入不同质量浓度的PPO,利用其胁迫作用促使外植体褐化,探究PPO对水曲柳体胚发生和外植体褐化及体胚发生的影响,为揭示水曲柳体胚发生过程中外植体褐化与体胚发生的关系提供依据和研究借鉴。
1 材料与方法
1.1 材料采集与处理
水曲柳(Fraxinus mandshurica Rupr.)未成熟种子和成熟种子分别于2010年7月下旬和9月下旬取自东北林业大学哈尔滨实验林场内生长良好的40~60年生水曲柳母树;各母树均为自由授粉,母树之间距离大于50 m;各母树采集相同数目种子后充分混合再取样用于试验。
未成熟外植体处理:剥除外种皮后用自来水冲洗24 h,用75%乙醇浸泡1 min后,再用2%次氯酸钠溶液消毒15 min,在超净工作台上用无菌水冲洗5次;剥取出单片子叶,并使子叶近轴面接触培养基接种。
成熟外植体处理:剥除外种皮后用自来水浸泡48 h(定时换水并用搅拌器搅拌)之后再用自来水冲洗12 h;用75%乙醇浸泡1 min后,再用10%的次氯酸钠消毒20 min,在超净工作台上用无菌水冲洗5次;在超净工作台上剥取出单片子叶,并使子叶近轴面接触培养基接种。
1.2 体胚诱导培养
体胚诱导培养基为双培养基(固体培养基+液体培养基,即用灭菌药匙在固体培养基表面挖出直径约1 cm的凹面,然后在凹面内加入0.1 mL的液体培养基)。固体和液体培养基均为MS 1/2(MS基本培养基中所有成分均减半)附加1.5 mg·L-1NAA、0.5 mg·L-1BA、70 g·L-1蔗糖、400 mg·L-1水解酪蛋白。固体培养基加7.5 g·L-1琼脂固化。培养基的pH值在高压灭菌前调至5.8。接种后用封口膜将培养皿封口,于25℃下暗培养。培养室的相对湿度为40%~60%。
1.3 PPO 处理
多酚氧化酶(PPO)处理:用液体培养基配制不同处理质量浓度的PPO溶液。其中:未成熟外植体分别用 1、15、25、50、100、150 mg·L-1的 PPO 浸泡;成熟外植体分别用 15、25、50、100、150 mg·L-1的PPO浸泡。处理方法:用过滤灭菌器(孔径0.22 μm)将PPO溶液过滤后加到固体培养基上的凹面内,每凹面内0.1 mL。以不添加PPO溶液的液体培养基为对照。每个处理质量浓度重复5次,每个重复接种10片子叶外植体。每天用显微镜观察并在培养的第5、10、30、60天时统计外植体生长、褐化情况和体胚发生情况。第10天褐化外植体的统计标准:肉眼能够观察到外植体表面1/4以上褐化,即视为外植体褐化(30 d时外植体均已基本褐化,60 d时均深度褐化)。
1.4 外植体PPO、POD和CAT的活性测定
利用前期试验确定的褐化和体胚发生均最佳的50 mg·L-1的PPO处理进行重复培养试验,对培养15 d时的外植体提取样品,用于PPO、POD和CAT酶活性测定。
PPO活性的测定:取0.25 g的试验材料及0.4 g的 PVP,冰浴研磨,并用 2.5 mL、0.1 mol·L-1、pH为6.8的柠檬酸磷酸缓冲溶液稀释,在4℃、10000 r·min-1的条件下离心15 min,取上清液用于酶活测定。在4 mL的酶活测定体系中含有:2.9 mL、pH为6.8 的柠檬酸磷酸缓冲溶液,1 mL、0.1 mol·L-1邻苯二酚及0.1 mL的酶液。测定398 nm处的OD值。
微博传播的碎片化——以“占领华尔街”为例………………………………………………………………………………………燕道成(4.31)
POD活性的测定:取0.3 g试验材料并加入5 mL、0.1 mol·L-1、pH 为 7.8 的磷酸缓冲溶液进行冰浴研磨,后置于4℃、10 000 r·min-1条件下离心20 min,取上清液用于酶活测定。在4 mL的反应体系中含有:1 mL、pH 为7.0的磷酸缓冲溶液,0.95 mL、0.2% 的愈创木粉,2 mL、0.2%H2O2及 0.05 mL酶液。在470 nm下记录OD值。
CAT活性的测定:取0.3 g试验材料并加入5 mL、0.1 mol/L、pH 为7.8 的磷酸缓冲溶液进行冰浴研磨,后置于4℃、10 000 r·min-1条件下离心 20 min,取上清液用于酶活测定。在3 mL的反应体系中含有:1 mL 0.2%的 H2O2,1.9 mL、pH 为 7.0 的磷酸缓冲溶液及0.1 mL酶液。在240 nm下记录OD值。
1.5 数据处理方法
数据均为各重复处理的平均数±标准差。标准差由每个试验的5个重复处理计算得出。采用单因子方差分析评价试验中各影响因子的作用,并在P=0.05水平上进行差异显著性检验。平均数间统计学差异用邓肯多重比较法在P=0.01或0.05显著性水平上检验。计算公式为:
外植体生长率=有生长现象的外植体个数×100/接种存活的外植体总数%;
第10天外植体褐化率=培养第10天褐化的外植体个数×100/接种存活的外植体总数%;
第10天褐化外植体体胚发生率=在培养第10天时褐化且在培养第60天时发生体胚的外植体数量×100/具有生理活性的外植体总数%;
第10天未褐化外植体体胚发生率=在培养第10天时褐化且在培养第60天时发生体胚的外植体数量×100/具有生理活性的外植体总数%;
体胚发生率=培养第60天时产生体胚的外植体个数×100/具有生理活性的外植体总数%;
第10天褐化外植体体胚比重=在培养第10天时褐化且在培养第60天时发生体胚的外植体数量×100/培养第60天时的发生体胚的外植体数量%;
第10天褐化外植体体胚比率=在培养第10天时褐化且在培养第60天时发生体胚的外植体数量×100/培养第10天时褐化的外植体数量%。
2 结果与分析
2.1 水曲柳体胚诱导培养中外植体的变化
在体胚诱导培养过程中,未成熟外植体(图1A)从接种后3 d开始略微增大,外植体颜色从切口处和边缘向内逐渐由乳白变成淡黄色,随着外植体的生长,其表面略有褐色斑(图1B),10 d以后外植体表面部分变为褐色且上面有大量的愈伤组织产生;培养20 d后,在褐化部位愈伤组织的量明显增加,在褐变部位有少量体胚产生,多为半透明状球型胚(图1C);培养30 d后,体胚数量明显增加,体胚颜色由半透明变为乳白色,此时体胚形态多为心型胚(图1D)和鱼雷型胚(图1E),及少数体胚簇(图1F)。40 d后可以观察到子叶型胚(图1G)。长体胚的外植体的褐化程度比没长体胚的外植体的深,且长有体胚的外植体都是褐化的。这些长有体胚的褐化外植体,在用镊子夹取时,能够明显地感受到该外植体具有活细胞脆性和弹性,这与一般意义上的外植体褐变致死后的松软或干硬的失活状态完全不同。
成熟外植体接种后经过12 d静止期后开始生长,第15天开始略微增大,随后外植体颜色等外观变化与未成熟外植体相似。
2.2 PPO处理对水曲柳未成熟外植体褐化与体胚发生的影响
PPO处理的水曲柳未成熟外植体从接种后3 d开始略微增大,外植体颜色从切口处和边缘向内逐渐由乳白变成淡黄色(图1H),褐变比对照早,且体胚的产生都伴有外植体的褐化。添加外源PPO对水曲柳未成熟外植体的生长影响不大(未显示数据),其中只有质量浓度为50 mg·L-1的PPO显著抑制了培养初期外植体的生长(P<0.05)。
由于培养30 d后外植体均已基本褐化,培养60 d后外植体均已深度褐化,所以取培养10 d的外植体褐化状况进行数据统计,结果见表1。除了100 mg·L-1质量浓度的处理褐化值偏低(等于对照的)外,培养基中添加PPO均促进水曲柳外植体的褐化,总体上比对照的褐化率高出13.4%。其中:PPO质量浓度为50 mg·L-1时外植体褐化率最大,高于其它处理及对照,培养第10天时其褐化率达到50%,比对照高出26.7%,差异达显著性程度(P<0.05)。相应地,培养基中添加质量浓度为50 mg·L-1PPO处理的体胚发生率也最高,高于其它处理和对照,达到40.0%,比对照高出16.7%,差异显著(P<0.05)。各PPO处理的体胚发生率虽然差异较大,有的甚至低于对照,但从培养第10天的褐化外植体中发生体胚外植体占全部发生体胚外植体的比重来看,PPO加快褐化进程的同时也明显促进体胚发生,因为所有PPO处理在第10天褐化外植体上发生的比重均高于对照,总体上高出18.3%。其中:褐化率和体胚发生率最高的50 mg·L-1PPO处理的比重达到58.3%,高出对照29.7%;第10天褐化外植体体胚比率数据也说明了50 mg·L-1PPO处理的促进效果,其培养第10天时褐化的外植体中在第60天时发生体胚的外植体数量占到了培养第10天时褐化的外植体数量的46.7%,高出对照18.1%。除了25 mg·L-1的PPO处理外,其余处理的培养第10天时褐化外植体体胚发生率均高于对照。其中:50 mg·L-1的PPO处理高于其他处理和对照,并与对照的差异达到显著性程度(P<0.05)。而各处理及对照的10 d未褐化外植体体胚发生率差异很小,未达差异显著水平(P>0.05),说明PPO处理在加快外植体褐化进程的同时对其体胚发生也具有促进作用。
2.3 PPO处理对成熟外植体褐化与体胚发生的影响
PPO处理的水曲柳成熟外植体的变化与未成熟外植体一样,但需要经过12 d左右的静止期后状态 才能发生改变。
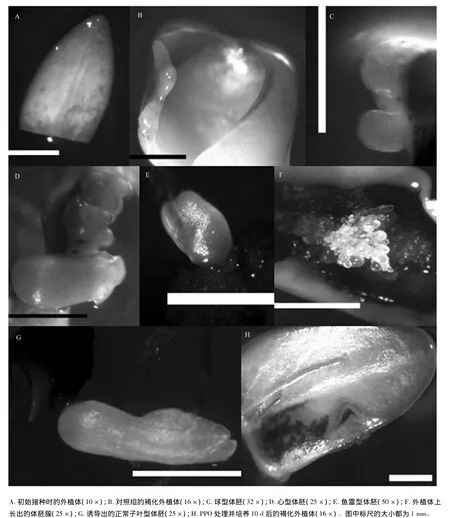
图1 PPO处理条件下水曲柳未成熟外植体和体胚发生状态
表2结果显示,添加一定质量浓度的PPO会促进水曲柳成熟外植体的生长(培养第15天),但不同质量浓度的促进效果不同。其中:50 mg·L-1的PPO处理对外植体的生长抑制作用比较明显,但差异未达显著水平(P>0.05)。添加一定质量浓度的PPO会加快水曲柳成熟外植体的褐化进程。其中:50 mg·L-1的PPO处理培养第15天时褐化率达到40.0%,与对照差异显著(P <0.05);50.0 mg·L-1的PPO处理培养第60天时体胚发生率虽然高于其他处理和对照,但差异未达显著水平(P>0.05)。
2.4 水曲柳未成熟外植体PPO、POD和CAT的活性比较
选取在褐化及体胚发生中现象最为明显的PPO质量浓度为50.0 mg·L-1处理的未成熟水曲柳外植体,与同一时间(培养第15天)培养的对照同时进行PPO、POD和CAT活性测定及比较(此时外植体的生长状态处于体胚发生前期),结果如表3。表3结果显示:在体胚发生前期,经PPO处理的外植体内的POD活性显著低于对照;CAT活性低于对照,但差异不显著;PPO活性高于对照,但差异不显著。

表1 不同质量浓度PPO处理下水曲柳未成熟外植体褐化与体胚发生状况 %
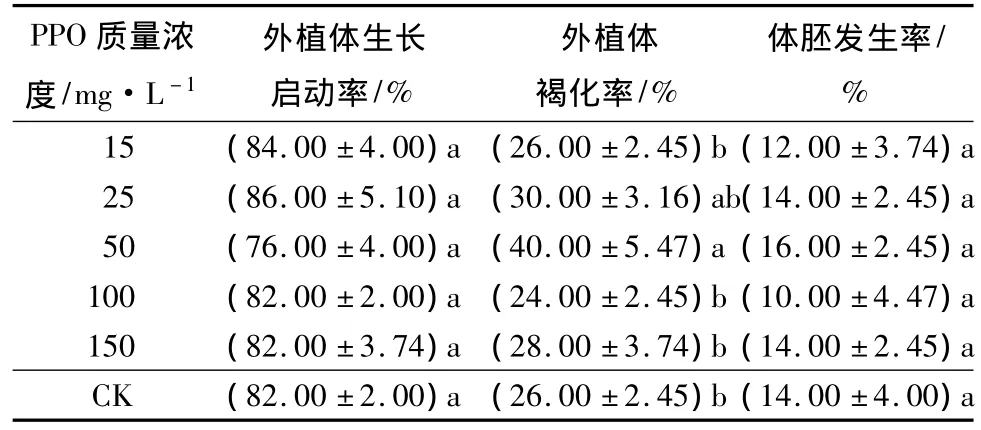
表2 PPO处理对水曲柳成熟外植体生长、褐化和体胚发生的影响
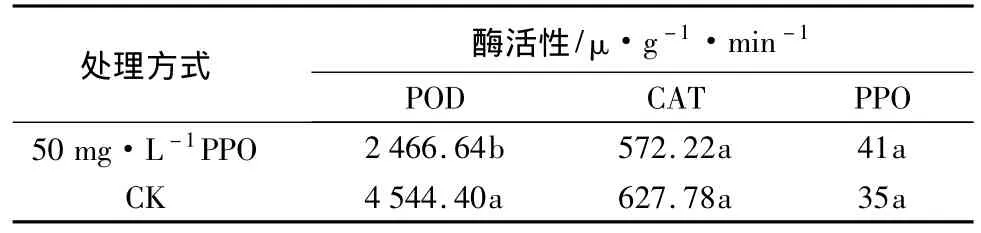
表3 体胚发生前期水曲柳未成熟外植体PPO、POD和CAT活性
3 结论与讨论
3.1 水曲柳体胚发生过程中外植体的褐化现象
水曲柳体胚发生过程中伴随着外植体的褐化现象,发生体胚的外植体基本上都处于褐化状态,而且褐化外植体上诱导出的体胚长势良好[3-4],体胚发生与外植体褐化的伴随关系较固定。诱导产生褐化有利于外植体的体胚发生[5-6]。本研究进一步证明褐化进程不一致:PPO处理的外植体褐化进程快,体胚发生率高;对照褐化进程慢,体胚发生率低。但是在培养30 d后发生体胚的外植体基本上都是褐化的,而且试验中还发现,这些发生体胚的外植体具有活细胞的脆性和弹性。试验结果与一般意义上组织培养中的褐变表现不一样:植物组织培养中所说的褐化,是指在外植体诱导初分化或再分化过程中自身组织从表面向培养基释放褐色物质,以至培养基逐渐变成褐色,外植体也随之进一步变褐而死亡的现象;褐化产物不仅使外植体、细胞、培养基褐变,而且对许多酶有抑制作用,影响培养材料的生长与分化,严重时甚至导致材料死亡[7-9]。深入解析水曲柳中这种特殊现象的产生机理,不仅可能为解析树木体胚发生机理找到新的标记和明显的切入点,也可能为解析植物组织培养中褐变现象的机理找到新的途径。因此,这种现象值得从形态解剖学、生理学、细胞生物学和分子遗传学等多种角度深入研究。
3.2 PPO处理可以促进水曲柳外植体褐化进程并提高体胚发生率
本研究结果说明:50 mg·L-1的PPO处理,可以显著促进水曲柳未成熟外植体的褐化进程(培养第10天外植体褐化率显著高于对照和其他PPO质量浓度处理),相应地显著提高了其体胚发生率(总的体胚发生率和培养10 d时褐化外植体的体胚发生率均显著高于对照和其他PPO质量浓度处理)。总体上,经PPO处理的外植体,其培养10 d时外植体的褐化率、总的体胚发生率、培养10 d褐化外植体体胚比重及比率、褐化外植体体胚发生率,均与对照有显著差异,只有培养10 d的未褐化外植体体胚发生率与对照差异不显著。对于水曲柳成熟外植体,50 mg·L-1的PPO处理也显著促进了外植体的褐化进程,虽然体胚发生率高于其他处理和对照,但差异未达显著水平。在培养基中添加不同质量浓度的5-氮胞苷的试验发现[6]:抑制外植体褐化的处理质量浓度同样抑制了体胚发生;而对外植体褐化抑制程度最低的质量浓度处理,其体胚发生率也最高;不同质量浓度对外植体褐化的作用趋势与对体胚发生率的影响趋势相同;在不同时间加入5-氮胞苷,显著抑制外植体褐化的同时也明显地抑制了体胚的发生。这与蓝桉体胚发生中“使用降低褐化程度的抗氧化剂则抑制了体胚的发生”的结果一致[11],与本研究结果的趋势相反,但都说明了同一个问题:即促进褐化则提高体胚发生率,抑制褐化则降低体胚发生率。此外,李官德等[10]的研究提到:棉花的褐化且生长缓慢的愈伤组织能分化出体胚,并再生成植株,这与本研究的结果一致:50 mg·L-1的PPO处理显著抑制了水曲柳未成熟和成熟外植体的生长,但其外植体褐化率和体胚发生率均最高。
3.3 PPO处理促进褐化进程并进而提高体胚发生率的可能机理
本研究发现,在体胚发生前期,经PPO处理的外植体内的POD活性显著低于对照,虽然差异不显著,但CAT活性低于对照,PPO活性高于对照。前期研究[5]发现,褐化的外植体中的POD酶活性均显著低于未褐化的外植体,而且只要发生愈伤组织或体胚的外植体,其POD酶活性就降低;褐化发生愈伤组织和褐化发生体胚的外植体中CAT酶活性极低。POD是植物防御中的第一道防线,POD和PPO共同氧化酚成醌,醌转变成缩合型鞣质,最后形成褐色[13]。当植物体受到机械损伤时,受伤部位会产生系统素,经过十八烷酸途径最后合成茉莉酸,再进一步合成寡聚半乳糖醛酸,通过外用诱导物的激发和活性氧的迸发作用,使H2O2产生并作为第二信使诱导防御基因合成相关防御蛋白,从而提高PPO活性;PPO再与酚类物质作用,出现外植体的褐化现象[14-17]。因此,水曲柳外植体褐化的过程可能是:当水曲柳的合子胚被切割后造成了一定的机械损伤,使得细胞产生大量的酚类等物质,伤口处分泌出酚类化合物,切面细胞中的酚类物质由外界的PPO催化,氧化为醌,醌再通过非酶促反应产生有色物质而导致组织褐变;由于加入PPO的外植体一直处在含有PPO和产物醌的胁迫中,因此细胞内的褐化进程加快、褐化程度持续加深,促进胚性细胞周围细胞发生程序化死亡,从而促进胚性细胞向体细胞胚的转化速度、提高其转化率;而由于程序化死亡,POD和CAT的酶的溢出可能受到限制,酶活性降低。然而,对于PPO处理促进外植体褐化进程并提高体胚发生率的机制,本项研究还不能提供确切的证据,需要进一步深入研究。
[1]孔冬梅,谭燕双,沈海龙.白蜡树属植物的组织培养和植株再生[J].植物生理学通讯,2003,39(6):677 -680.
[2]孔冬梅,沈海龙,冯丹丹,等.水曲柳体细胞胚与合子胚发生的细胞学研究[J].林业科学,2006,42(12):130 -133.
[3]Kong Dongmei,Preece J E,Shen Hailong.Somatic embryogenesis in immature cotyledons of Manchurian ash(Fraxinus mandshurica Rupr.)[J].Plant Cell Tiss Organ Cult,2012,108(3):485 -492.
[4]沈海龙,孔冬梅,黄剑,等.水曲柳不定芽和体胚发生中需要解决的几个关键问题[G]//季孔庶.2007中国植物生理学会全国学术会议论文摘要汇编.北京:中国林业出版社,2007:256.
[5]丛建民,沈海龙,李玉花,等.水曲柳体胚发生过程中不同状态类型外植体的生理生化状态[J].华南农业大学学报,2012,33(1):48-52.
[6]刘艳,沈海龙,丛建民.5-氮胞苷对水曲柳合子胚外植体状态及体胚发生的影响[J].东北林业大学学报,2011,39(8):25-27,32.
[7]叶梅,王伯初,段传人.植物组织培养外植体褐变的研究进展[J].生物技术通讯,2004(4):426 -428.
[8]郭艳,杨海玲.植物组织培养中的褐化现象及解决途径[J].山西农业科学,2009,37(7):14 -16,31.
[9]朱文祥,王金荣,李珺,等.植物组织培养中外植体褐变研究进展[J].安徽农业科学,2010,38(31):17399 -17401,17415.
[10]李官德,肖丽娟,罗晓丽,等.不同棉花愈伤组织状态与胚胎发生及其植株再生的关系[J].山西农业科学,2006,34(1):29-31.
[11]Pinto G,Silva S,Park Y S,et al.Factors infiuencing somatic embryogenesis induction in Eucalyptus globulus Labill.:basal medium and anti-browning agents[J].Plant Cell Tiss Organ Cult,2008,95(1):79 -88.
[12]孔俊豪,杨秀芳,涂云飞,等.冻存茶鲜叶多酚氧化酶动力学特性研究[J].保鲜与加工,2011,11(4):9 -11.
[13]Laukkanen H,Haggman H,Kontunen-Soppela1 S,et al.Tissue browning of in vitro cultures of Scots pine:Role of peroxidase and polyphenol oxidase[J].Physiologia Plantarum,1999,106(3):337-343.
[14]段晓娜,陈宗懋,任炳忠,等.植物多酚氧化酶的诱导[J].吉林师范大学学报:自然科学版,2011(2):90-95.
[15]VanDam N M,Horn M,Mares M,et al.Ontogeny constrains systemic protease inhibitor response in Nicotiana attenuata[J].J Chem Ecol,2001,27(3):547 -568.
[16]Miyoshi H,Major I T,Mary E C,et al.A Kunitz trypsin inhibitor gene family from trembling aspen(Populus reemuloides Michx.):cloning, functional expression, and induction by wounding and herbivory[J].Plant Mol Biol,2001,46(3):347 -359.
[17]Mayer A M.Polyphenol oxidases in plants and fungi:Going places?A review[J].Phytochemistry,2006,67(21):2318 -2331.
