抑制‘白花油茶’叶片外植体褐化和诱导愈伤组织的研究
2018-06-20黄国文黄超超
黄国文,黄超超,谭 毅
(湖南科技学院 化学与生物工程学院,湖南 永州 425199)
油茶Camellia oleifera,属山茶科Theaceae山茶属Camellia[1],是我国南方的木本油料树种。油茶育苗主要是培育优良无性系,但是所需的时间长,扦插很难生根,嫁接时成苗率低,因此很难在短时间内培养出优良无性系[2]。植物组织培养技术在植物脱毒和快繁、获取次级代谢产物以及利用基因工程等方面发挥着越来越重要的作用[3]。用无性系“湘林1号”和“湘林4号”油茶无菌苗的叶片、茎尖和茎段作为外植体,用IBA,KT,2,4-D和NAA四种激素[4],6-BA和NAA[5]以及6-BA(2.0 mg·L-1)和2,4-D(0.5 mg·L-1)[6]都能够容易地诱导出叶片愈伤组织,但是对于大田栽培的成熟油茶叶片,仅仅利用在培养基中加入一点激素的常规条件进行组织培养,外植体褐化现象很普遍,存活率低,甚至全部外植体因褐化而死亡。外植体的褐化可能是外植体中多酚含量高和多酚氧化酶活性高引起的[5,7]。目前,抑制植物组织培养中外植体褐化的方法有多种,如接种前用100 mg·L-1维生素C(Vc)溶液浸泡非洲菊Gerbera jamesonii外植体1 h[8],用Vc浸泡香蕉Musa nana芽[9],用柠檬酸和Na2S2O3浸泡白玉兰Magnolia denudata芽[10],在培养基中添加活性炭(Ac)[11]和抗氧化剂[12],在红豆杉Taxus chinensis愈伤组织培养基中添加葡萄糖(Glu)和果糖[13-14]等都能够抑制外植体褐化,提高外植体存活率及愈伤组织诱导率。油茶组织培养中,有低温预处理油茶叶片7 d和培养基中加入0.3 mg·L-1Ac来抑制外植体褐化[6]的报道,但主要集中在改变培养基中激素种类和浓度配方上,对组培过程中的机理缺乏充分研究,距离实际应用还有一定的距离,还不能实现工业化生产[15-16]。因此,用不同的油茶品种,不同生理状态的植株甚至不同的器官来进行组织培养,对于理解组织培养的机理和掌握油茶组培条件是很必要的。由于用油茶器官在培养基上培养无菌苗的时间长、生长慢,利用无菌苗作为外植体会延长油茶组培的时间,然而用大田栽培的油茶叶片作为外植体,节约实验费用,减少步骤,加快组培进程。
本研究以普通栽培‘白花油茶’叶片作为外植体,把‘白花油茶’嫩枝放在室内进行弱光培养,用 Vc漂洗外植体,在培养基中加入Ac和Vc防止培养时叶片外植体褐化,对激素配比、基本培养基类型、琼脂含量和组合糖等因素进行单因素实验,不同组合实验研究诱导油茶愈伤组织的最适培养条件,为再分化‘白花油茶’植株打下基础。
1 材料与方法
1.1 供试材料
2016年3-6月,在湖南科技学院油茶示范基地采集‘白花油茶’的侧枝顶部光照充足的一年生枝条,以叶片作为外植体进行培养。
1.2 试验方法
1.2.1 外植体消毒和取材方法 取室内弱光处水培1~ 2 d的一年生枝条,用剪刀剪断叶柄得到质地稍厚的20片叶左右,在自来水下冲洗30 min,用棉花轻轻地擦洗后沥干,切去叶柄和叶尖放入烧杯中带到超净工作台上。用75%酒精消毒30 s后用无菌水反复冲洗3次,再用1.0 g·L-1HgCl2处理7 min,对于颜色深绿的较老叶片,消毒时间增加到10 min,用无菌水冲洗5次,最后沥去水分,放置于无菌滤纸上。用灭菌的剪刀剪去叶片边缘并切成1.5 cm×1.5 cm大小的外植体,用于进一步的预处理和接种后培养。
1.2.2 ‘白花油茶’叶片外植体的防褐化方法
1.2.2.1 培养基中添加Vc和Ac对叶片外植体活性的效应 在特定培养基(MS培养基,含有1.0 mg·L-16-BA和1.5 mg·L-12,4-D,琼脂含量为7.0 g·L-1,蔗糖(Suc)含量为30 g·L-1,调节pH 5.8)上,分别添加0.2,0.3,0.4 g·L-1Vc,0.5,1.0,2.0 g·L-1Ac,其中以 0.3 g·L-1Vc分别与 0.5,1.0,2.0 g·L-1Ac的组合作为处理组,一组为不加Ac和Vc为对照组。将消毒沥干的外植体接种到这些培养基上培养。每组接种10瓶,每瓶接种3个外植体,定期观察和记录结果。
1.2.2.2 Vc与Ac溶液漂洗外植体的活性效应 酒精消毒后切好的叶片分成10组:对照组在无菌水中浸泡3 min,实验组分别在 0.2,0.3,0.4 g·L-1Vc溶液,1,2,3 g·L-1Ac粉末液体,0.2,0.3,0.4 g·L-1Vc与 1 g·L-1Ac粉末组合混合液中浸泡3 min。用1.0 g·L-1HgCl2处理并冲洗沥干。然后将外植体接种到含有0.3 g·L-1Vc和1 g·L-1Ac的基本培养基上。每组接种5瓶,每瓶接种3个外植体,培养箱温度在(25±2)℃。
1.2.2.3 室内弱光下水培‘白花油茶’嫩枝对外植体活性的效应 摘取带有20片叶左右且有嫩叶展开的枝条3根,枝条长度10 cm左右,插在盛自来水的烧杯中,放置在室温25℃的室内光线较暗的角落分别培养1,2,3 d。每天下午取叶片消毒,0.3 g·L-1Vc预处理的制备外植体,接种在含有0.3 g·L-1Vc和1.0 g·L-1Ac的基本培养基上进行培养。每组接种5瓶,每瓶接种3个外植体,记录外植体存活率及愈伤组织诱导情况。
1.2.3 诱导‘白花油茶’叶片外植体愈伤组织的单因素实验 取室内弱光水培2 d的枝条上的叶片切取外植体,消毒后用 0.3 g·L-1Vc 漂洗 3 min,沥干后用于接种。以 7.0 g·L-1琼脂,30 g·L-1Suc,添加 0.3 g·L-1Vc和 1.0 g·L-1Ac的MS基本培养基;1 mg·L-1的6-BA和1 mg·L-1的2,4-D为最初培养基的成分。当变动一个因素时,其它因素与最初培养基中成分一致。植物激素浓度配比为0.5,1.0,1.5,2.0 mg·L-1的6-BA和1.5 mg·L-1的2,4-D以及 1.0 mg·L-1的 6-BA 和 0.5,1.0,1.5,2.0 mg·L-1的 2,4-D;琼脂浓度为 6.0,6.5,7.0,8.0 g·L-1;基本培养基为 WPM,MS,1/2MS;糖类处理为 30 g·L-1Suc,30 g·L-1Suc,16 g·L-1Glu,30 g·L-1Glu,40 g·L-1Glu,15 g·L-1Suc + 15 g·L-1Glu,诱导愈伤组织的形成,总共21组,每组接种5瓶,每瓶接种3个外植体。观察记录外植体存活情况以及愈伤组织诱导情况。
1.2.4 组合实验优化诱导愈伤组织的条件 根据植物激素配比、培养基类型、琼脂浓度和糖类4个因素确定的适宜条件,按L9(34)正交实验方法进行不同组合实验,得出‘白花油茶’最佳愈伤组织诱导条件。综合评分为外植体成活率、愈伤组织诱导率和愈伤组织生长状况得分之和。100%成活率计3分,100%诱导率计6分;愈伤组织长势好计3分(长势一般和长势差依次减一分),愈伤组织表面疏松计2分(表面光滑致密计1分),愈伤组织的可见时间以15 d计3分,每增加1 d扣0.2分,每减少1 d加0.2分。
1.3 数据处理
在培养第 16天后观察和统计外植体存活(仍然为绿色或者产生了愈伤组织)量以及褐化死亡(排除染菌死亡)量。计算外植体的存活率和愈伤组织诱导率,公式如下:
存活率(%)=(接种外植体总数-外植体褐化数)/接种外植体总数×100
诱导率(%)= 诱导出愈伤组织的外植体数/接种外植体总数×100
2 结果与分析
2.1 抑制‘白花油茶’叶片外植体的褐化作用
2.1.1 在培养基中添加Vc和Ac对‘白花油茶’叶片外植体褐化的影响 植物组织培养过程中,外植体褐化是阻碍愈伤组织生长的最大因素,防止外植体褐化有利于诱导愈伤组织。在接种‘白花油茶’外植体的培养基中加入Ac和Vc对预防‘白花油茶’外植体褐化有一定的效果,也影响了愈伤组织诱导率(表1)。在培养基中单独添加Ac的防褐化效果普遍优于单独加入Vc的作用,两者一起加入对抑制外植体褐化的作用更强。1.0 g·L-1Ac和0.3 g·L-1Vc条件下的外植体存活率为70.0%,诱导率最高为33.33%。可能是由于Vc是一种抗氧化试剂,能够防止外植体切口流出的多酚氧化成醌类褐化切口,但是随着作用时间的增长Vc被降解,其还原态转化成氧化态,导致多酚物质的氧化从而使材料褐化。然而,Ac有吸附多酚的作用,且作用时间长,Vc和Ac两者共同作用会更好地除去叶片细胞释放的多酚物质的作用,使外植体的细胞活性加强。
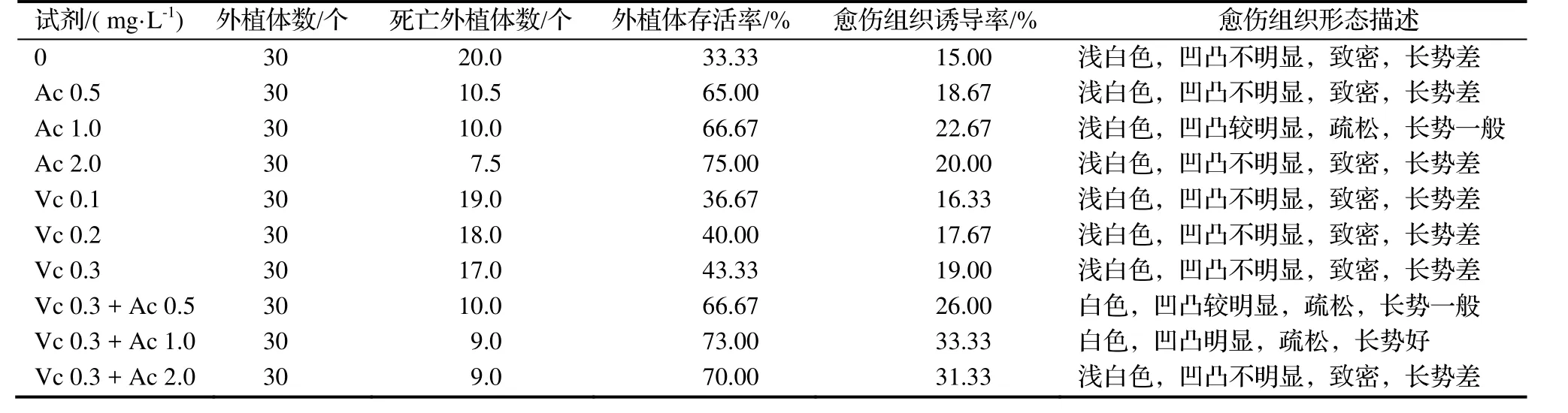
表1 培养基中添加Vc和Ac对‘白花油茶’叶片外植体褐化和愈伤组织的影响Table 1 Effect of addition of vitamin C or activated carbon or both in culture medium on browning of explant and callus
2.1.2 Vc与Ac溶液漂洗外植体对抑制外植体褐化的影响 在实验过程中,刚剪成小块的‘白花油茶’叶片四周切口颜色会很快变成浅褐色,直接影响到外植体的存活率及愈伤组织诱导率。用Vc及Ac粉末溶液漂洗剪切的外植体可以减轻外植体褐化并提高愈伤组织诱导率(表2)。实验表明,单独用Ac粉末的悬浊溶液漂洗外植体与空白组的结果相差不大,外植体存活率为67%左右,愈伤组织诱导率为30%左右,说明单独用Ac粉末溶液漂洗外植体未能够提高外植体的存活率。单独使用 Vc漂洗外植体,外植体存活率及诱导率显著提高,采用0.3 g·L-1Vc时效果最好,存活率为80.0%,诱导率为50.0%。这说明Vc溶液在前期处理外植体时可以较好地抑制酚类物质氧化,防止外植体四周切口出现褐化。
与单独使用0.3 g·L-1Vc相比,用0.3 g·L-1Vc和2.0 g·L-1Ac处理的外植体存活率从80.0%降到73.33%,诱导率从50.0%降低到48.0%。说明Ac与Vc溶液共同使用时,Ac也会对Vc产生一定的吸附作用,因而产生负面效应。因此单独使用0.3 g·L-1Vc溶液预处理外植体3 min有利于抑制酚类物质氧化。
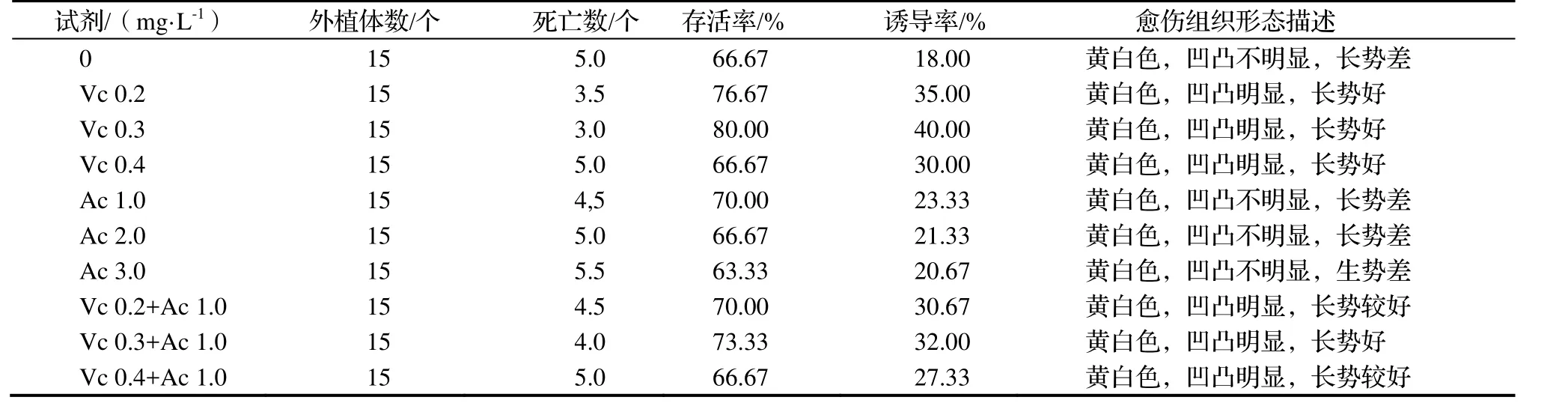
表2 Vc和Ac漂洗外植体对叶片外植体褐化和愈伤组织的影响Table 2 Effect of washing of explants with vitamine C and activated carbon on browning and callus
2.1.3 室内水培嫩枝对抑制‘白花油茶’外植体褐化的影响 室内水培枝条能够影响‘白花油茶’外植体存活率和愈伤组织诱导率(表3)。室内环境水培处理1~2 d的外植体存活率最高,达到80.0%以上,愈伤组织的诱导率也同样。说明室内水培处理后,可能使叶片表面疏松,降低叶片细胞中多酚氧化酶的活性,防止了外植体切口组织中多酚的氧化,因而提高了外植体存活率。

表3 室内水培时间对抑制叶片外植体褐化和愈伤组织的影响Table 3 Effect of indoor water culture days on browning of explant and callus
2.2 诱导‘白花油茶’叶片外植体愈伤组织的单因素实验
2.2.1 外源激素浓度对愈伤组织诱导的影响 外源植物激素配比影响‘白花油茶’外植体的愈伤组织的分化(表4)。6-BA浓度为1.0 mg·L-1,2,4-D浓度为2.0 mg·L-1时在第10天就诱导出愈伤组织,愈伤组织疏松、带有淡淡的绿色;6-BA浓度为1.0 mg·L-1,2,4-D浓度为1.5 mg·L-1时,第12天可以诱导出愈伤组织,愈伤组织诱导率最大为52.67%。2,4-D的浓度低于1.0 mg·L-1时,愈伤组织较难形成,且出现的时间长,因此,在一定范围内提高2,4-D的浓度有利于愈伤组织的形成。
2.2.2 琼脂浓度对外植体愈伤组织诱导的影响 在添加1.0 g·L-1Ac和0.3 g·L-1Vc的MS培养基中,琼脂浓度对外植体存活率及愈伤组织诱导有影响(表5)。当琼脂浓度为6.5 g·L-1时,外植体存活率最大达到83.33%,此时愈伤组织诱导率为53.67%。当琼脂浓度大于6.5 g·L-1,随着琼脂浓度的增加,愈伤组织诱导率逐渐降低,而存活率先增加后降低。说明,琼脂浓度过高可能阻碍营养物质的传递,导致愈伤组织出现较晚生长较慢;琼脂浓度过低,可能使外植体细胞活性和外植体存活率降低而且容易引起愈伤组织的玻璃化。
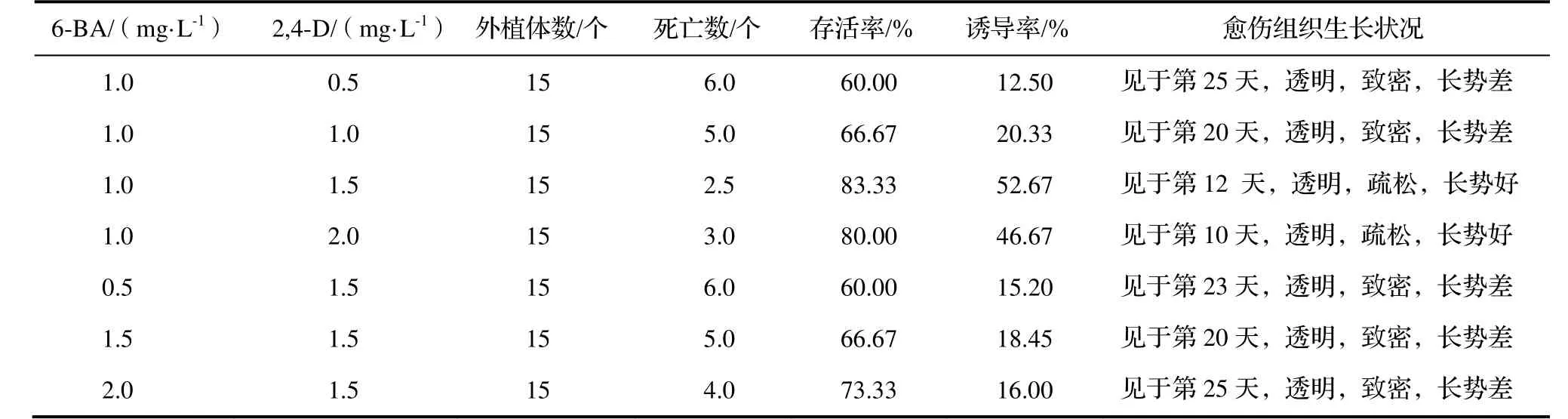
表4 外源激素对外植体愈伤组织诱导的影响Table 4 Effect of the exogenous hormones on the induction of callus of explants
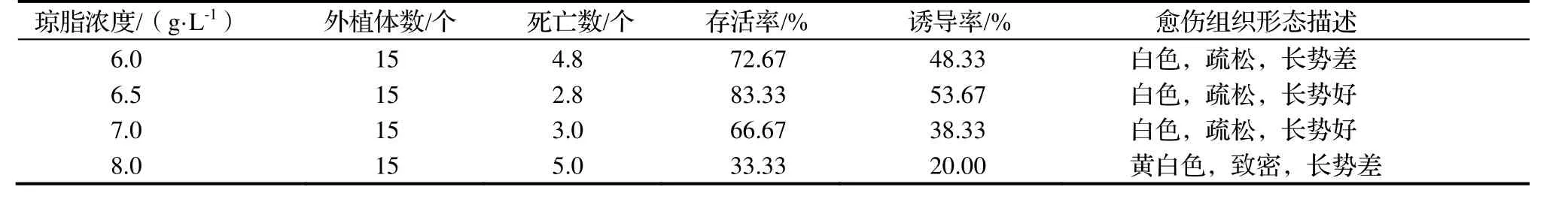
表5 琼脂浓度对‘白花油茶’外植体愈伤组织诱导的影响Table 5 Effect of agar concentration on induction of callus of explants
2.2.3 培养基种类对愈伤组织诱导的影响 培养基种类对‘白花油茶’外植体愈伤组织诱导有影响(表6)。外植体在3种培养基上的愈伤组织的诱导率从大到小的顺序依次为WPM>1/2MS>MS。在WPM培养基上,外植体存活率最高,第12天时出现愈伤组织,且愈伤组织致密、生长快。在MS培养基上,外植体第16天时出现愈伤组织,愈伤组织致密、生长较快。在1/2MS培养基上,外植体第15天时出现愈伤组织,愈伤组织疏松,生长较差。

表6 不同类型培养基对外植体愈伤组织诱导的影响Table 6 Effect of different culture media on induction of callus of explants
2.2.4 糖的种类和浓度对愈伤组织诱导的影响 培养基中糖的种类影响‘白花油茶’外植体愈伤组织的诱导形成(表7)。在含30 g·L-1Glu,40 g·L-1Glu或者15 g·L-1Suc + 15 g·L-1Glu的培养基上外植体存活率均达80%以上,外植体愈伤组织诱导率以15 g·L-1Suc + 15 g·L-1Glu最高,40 g·L-1Glu的为其次。在添加40 g·L-1Glu或者15 g·L-1Suc和15 g·L-1Glu的培养基上,分别在第9天和第8天诱导出愈伤组织。说明Glu诱导外植体分化出愈伤组织的作用优于Suc。
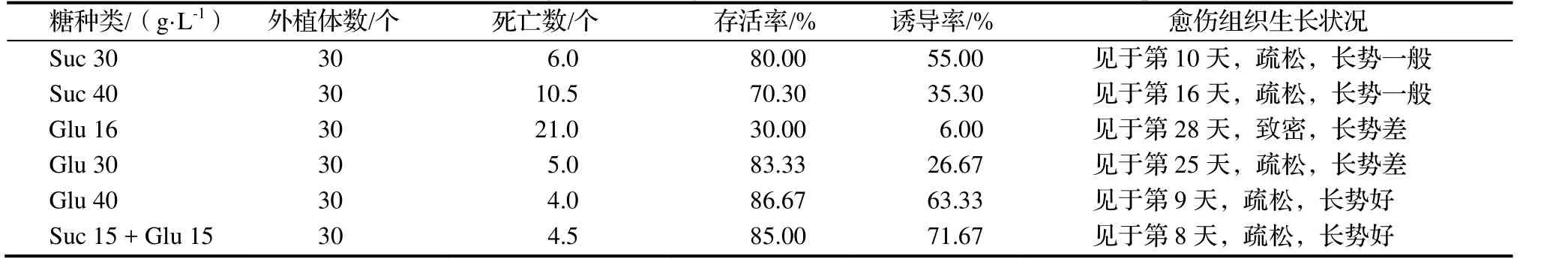
表7 单独Suc或Glu和两者对外植体愈伤组织诱导的影响Table 7 Effect of single sucrose or glucose and both on induction of callus of explants
2.3 组合实验
根据单因素实验结果,以琼脂浓度、植物激素配比和糖类型的三个较好水平与培养基类型进行组合实验设计(表8),仿照正交实验L9(34)来进行组合实验,并对各个实验结果进行综合评分和极差分析(表9和表10),以确定诱导‘白花油茶’外植体愈伤组织生长的最佳组合条件。

表8 ‘白花油茶’外植体愈伤组织诱导组合实验设计Table 8 Experiment design for induction of callus of Camellia oleifera explants
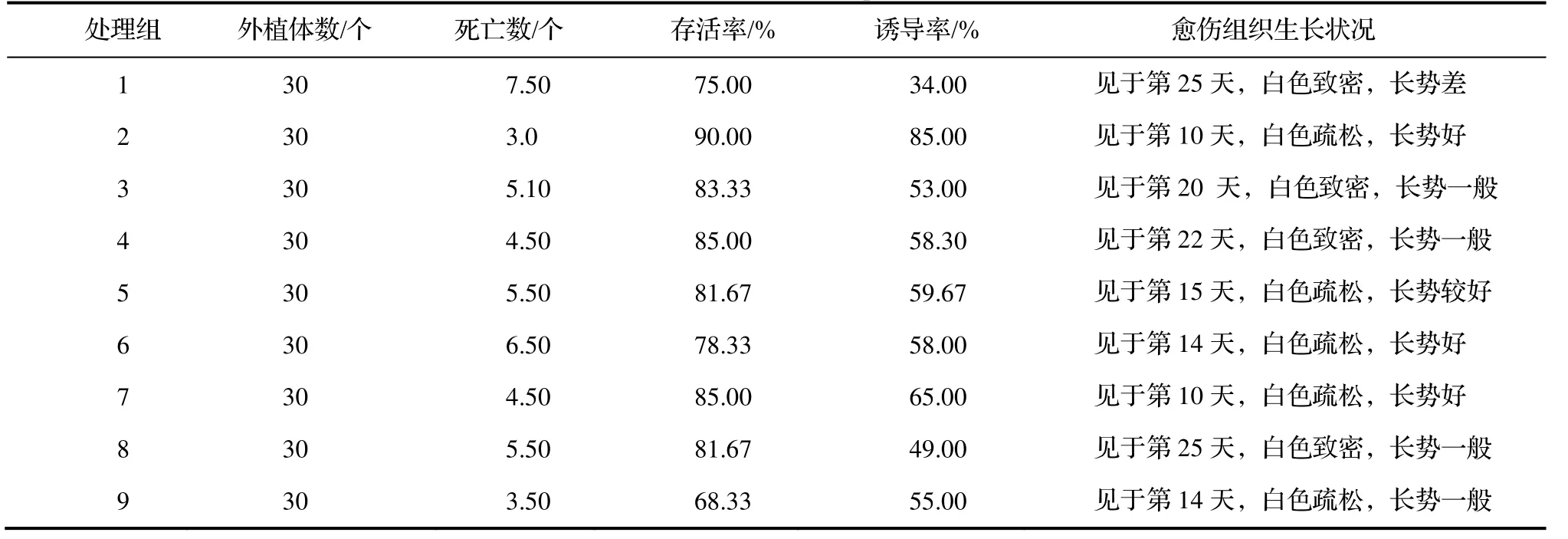
表9 ‘白花油茶’愈伤组织诱导的组合实验结果Table 9 Result of the experiment
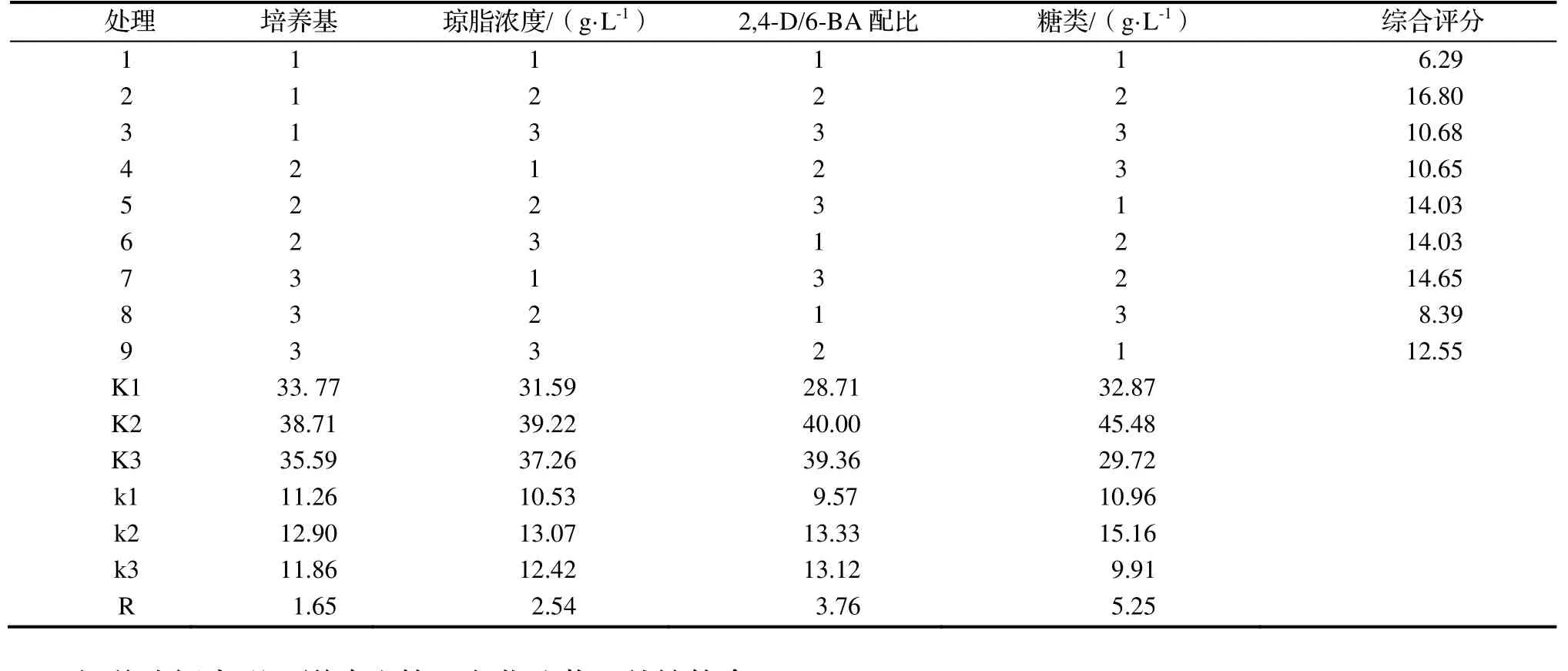
表10 ‘白花油茶’外植体愈伤组织诱导的组合实验结果分析Table 10 Analysis on experiment result
极差分析表明,影响成熟‘白花油茶’外植体愈伤组织诱导的因素大小顺序是糖类>植物激素配比>琼脂浓度>培养基。‘白花油茶’外植体愈伤组织诱导的最优培养条件为 WPM+6.5 g·L-1琼脂+15 g·L-1Suc+15 g·L-1Glu+1.5 mg·L-12,4-D+1.0 mg·L-16-BA。
经过验证,在最优培养条件下,成熟‘白花油茶’植株叶片外植体的成活率为95%以上,愈伤组织诱导率为90%左右。本培养条件下获得的愈伤组织(图1)白色透亮,质地疏松、长势好。

图1 接种第16天‘白花油茶’外植体的愈伤组织Figure 1 The callus of explant 16 days after inoculation
3 结论与讨论
‘白花油茶’组织培养过程涉及到外植体及其细胞的生理过程的变化,外植体褐化导致愈伤组织形成受阻甚至细胞死亡是‘白花油茶’组织培养中最主要问题。油茶组培苗用芽和茎等器官培养成植株,成苗系数大,用来培养优良无性系。无菌的组培苗器官作为外植体,可以免除消毒时对其的伤害,同时苗相对弱小、次生代谢产物积累少,有利于诱导愈伤组织形成。野外苗木由于受到空气中微生物的污染和次生代谢产物积累较多,组培时外植体褐化严重、愈伤组织诱导率低,但是省略培养植株的步骤,节约实验时间和成本,加快愈伤组织的培养进程。取长度为10 cm左右的嫩枝在室内弱光下水培1~2 d后的叶片作为外植体,可以提高其存活率,可能降低了其酶活力并消耗了叶内淀粉。这与水培苹果梨Pyrus pyrifolia ‘Pingguoli’组织来提高外植体存活率的结论相吻合[17],在用HgCl2灭菌消毒外植体后,用0.3 g·L-1Vc溶液漂洗外植体一定时间,能够洗去外植体切口上流出的多酚物质提高了其成活率,但用Ac悬浊液漂洗外植体的效果差;在培养基里加入1.0 g·L-1Ac和0.3 g·L-1Vc溶液可以消除组培过程中外植体产生的多酚物质的氧化作用,从而预防了外植体的褐化并提高了存活率。以糖类、激素配比、培养基种类和琼脂含量4个因素进行不同组合实验,表明影响外植体愈伤组织形成最主要的因素是糖类,其次是激素配比,可能15 g·L-1Glu + 15 g·L-1Suc的组合中Glu能够快速进入细胞,为细胞提供了快速能源物质,从而刺激了因室内弱光培养产生的叶片饥饿细胞的活性和对外界条件的反应敏感性,促进了愈伤组织的形成;激素配比虽然是愈伤组织形成不可缺少的,但是如果细胞活性小甚至失去活性这些激素也无法起作用。此外,WPM优于MS,可能是WPM中的Ca2+浓度是MS的2倍,维生素B1浓度也明显高于 MS。Ca2+能够促进细胞生长和分化,影响植物细胞的生长[18-19],也是促进愈伤组织形成的重要因素[20];维生素B1在一定程度上可以提高愈伤组织的活力。如果培养1~2 d发现外植体边缘褐化,立即剪去褐化部分,继续放在培养基中培养,这时外植体成活率几乎达100%,愈伤组织的诱导率将会达到95%左右。
本实验结果显示,‘白花油茶’叶片愈伤组织诱导的最佳条件是以水培1~2 d的‘白花油茶’枝条的叶片作为外植体,并用0.3 g·L-1Vc漂洗外植体2~3 min。优化的培养基配方为WPM + 6.5 g·L-1琼脂 + 15 g·L-1Suc +15 g·L-1Glu + 1.5 mg·L-12,4-D + 1.0 mg·L-16-BA + 1.0 g·L-1Ac + 0.3 g·L-1Vc。叶片愈伤组织诱导包括防止外植体褐化以促进外植体成活、刺激细胞对培养条件的反应活性和诱导愈伤组织形成,做好这3个方面的工作能够有效提高愈伤组织的诱导率。
[1] 林秀艳,彭秋发,吕洪飞,等. 山茶属油茶组和短柱茶组叶解剖特征及其分类学意义[J]. 植物分类学报,2008,46(2):183-193.
[2] 王瑞,陈永忠,王湘南,等. 油茶优良无性系叶片愈伤组织诱导研究[J]. 经济林研究,2009,27(2):35-39.
[3] 毕方铖,谭晓风,张智俊,等. 油茶离体培养诱导再生植株的研究[J]. 经济林研究,2004,22(2):5-9.
[4] 王瑞,陈永忠,王湘南,等. 不同外植体及植物激素对油茶愈伤组织诱导的影响[J]. 中国农学通报,2012,28(19):29-32.
[5] 蔡冬元. 油茶叶片初始诱导培养技术研究[J]. 湖南农业科学,2014,20:5-7.
[6] 刘海英. 油茶组培再生体系建立及愈伤组织诱导[D]. 武汉:华中农业大学,2011.
[7] 冯代弟,王燕,陈剑平. 植物组培褐化发生机制的研究进展[J]. 浙江农业学报,2015,27(6):1108-1116.
[8] 张素勤,邹志荣,耿广东,等. 非洲菊组织培养抑制褐变现象的研究[J]. 贵州农业科学,35(2):56-57.
[9] 何琼英,张东方,王润华. 抗坏血酸预处理阻止香蕉吸芽外植体褐变的研究初报[J]. 华南农业大学学报,1995,16(3):79-82.
[10] 周丽艳,郭振清,秦子禹,等. 白玉兰组织培养中的褐化控制[J]. 河北科技师范学院报,22(4):9-12.
[11] 徐耀华,杨春华,刘晓波,等. 扁穗牛鞭草组织培养中褐化控制技术初探[J]. 草业科学,2013,30(2):212-217.
[12] 彭思佳,丁力,刘清波,等. 抗褐化剂对荻外植体褐化和愈伤组织生长的影响[J]. 草原与草坪,2015,35(5):7-11,16.
[13] 丁世萍,严菊强,季道藩. 糖类在植物组织培养中的效应[J]. 植物学通报,1998,15(6):42-46.
[14] 盛长忠,王淑芳,王宁宁,等. 红豆杉愈伤组织培养中褐变现象的初探[J]. 南开大学学报,2001,34(4):120-122.
[15] 胡莹,杨柳青. 山茶科植物组织培养研究进展[J]. 江苏农业科学,2008(2):6-9.
[16] 葛立雯,郭维,潘正康,等. 我国山茶属植物组织培养研究文献分析[J]. 福建林业科技,2015,42(1):237-241.
[17] 陈蕾,曹后男,宗成文,等. 降低苹果梨组培过程中外植体褐化的研究[J]. 北方园艺,2008,(10):139-142.
[18] 余芳,左德远,孙大业. 愈伤组织形成过程中钙离子与激素诱导效应的关系[J]. 实验生物学报,1991,24(4):385-389.
[19] 敬碧,毛拉艾麦提·阿不都卡迪尔,王芳,等. 新疆紫草毛状根愈伤组织诱导及其生长条件研究[J]. 新疆农业学科学,2011,48(7):1205-1209.
[20] 余芳,孙大业. 钙离子与植物愈伤组织形成的关系[J]. 科学通报,1990,24(4):385-389.
