非编码RNA对肝细胞癌肿瘤微环境中免疫细胞的作用
2023-04-29杨超然李思柔刘源侯志远王元杨季红
杨超然 李思柔 刘源 侯志远 王元 杨季红
摘要:肝细胞癌(HCC)是一种常见的肝脏恶性肿瘤,具有发病率高、进展快、预后差等特点。近年来发现,非编码RNA(ncRNA)在肿瘤微环境(TME)中参与肿瘤免疫的调节,进而影响HCC的生物学行为。本文简述了ncRNA对TME中免疫细胞的调控作用,并介绍了ncRNA在HCC诊断和治疗中的潜在价值,以期为HCC提供潜在的诊断和治疗策略。
关键词:癌, 肝细胞; RNA; 肿瘤微环境; 免疫, 细胞
基金项目:河北省政府资助临床医学优秀人才培养项目(361007)
Role of non-coding RNA on immune cells in tumor microenvironment of hepatocellular carcinoma
YANG Chaoran, LI Sirou, LIU Yuan, HOU Zhiyuan, WANG Yuan, YANG Jihong. (Department of Hepatobiliary Surgery, Affiliated Hospital of Hebei University, Baoding, Hebei 071000, China)
Corresponding author:
YANG Jihong, doctoryangjh@sina.com (ORCID:0000-0001-8844-8640)
Abstract:
Hepatocellular carcinoma (HCC) is a common malignant tumor of the liver characterized by a high incidence rate, rapid progression, and poor prognosis. In recent years, it has been found that non-coding RNA (ncRNA) participates in the regulation of tumor immunity in tumor microenvironment (TME) and in turn affects the biological behavior of HCC. This article briefly describes the regulatory effect of ncRNA on immune cells in TME and introduces the potential value of ncRNA in the diagnosis and treatment of HCC, in order to provide potential diagnostic and treatment strategies for HCC.
Key words:
Carcinoma, Hepatocellular; RNA; Tumor Microenvironment; Immunity, Cellular
Research funding:Hebei Provincial Government Funded Clinical Medicine Talent Training Program (361007)
肝细胞癌(HCC)是全球范围内最常见的消化系统恶性肿瘤之一,约占原发性肝癌的90%[1],起病隐匿,早期缺乏典型的临床症状和诊断指标。外科手术仍是目前治疗HCC的最佳选择。对于无法行手术治疗的患者,辅助性化疗、放疗及靶向免疫治疗可以延长患者的生存期,但HCC患者预后以及5年生存率仍然不乐观[2]。因此,阐明HCC的发生、发展和转移机制,对于延长患者生存期至关重要。目前,非编码RNA(noncoding RNA,ncRNA)序列已经被证明参与各种细胞信号传递以及肿瘤免疫的过程。因此,本文总结了ncRNA对HCC肿瘤微环境中免疫细胞的调控作用,以期从ncRNA调控免疫细胞的角度为HCC早期诊断和治疗提供新的思路。
1 ncRNA简介
ncRNA是细胞中不具有翻译蛋白质功能的独特转录产物,根据核苷酸序列长短分为微小RNA、长链非编码RNA(lncRNA)和环状RNA(circRNA)[3]。过去几十年里,ncRNA被认为是一种“垃圾”转录产物,没有特定的生物学功能。随着深入研究,发现ncRNA不仅参与各种细胞之间信号的传递,并且参与肿瘤免疫和抗肿瘤免疫反应,进而调控肿瘤发生和发展[4]。例如,ncRNA通过调节免疫细胞活化,增殖和细胞因子分泌,从而影响肿瘤的侵袭、转移和免疫逃逸[5];又如,lncRNA HOMER3-AS1可以增加集落刺激因子-1(CSF-1)的表达和分泌,阻断CSF-1可以逆转HOMER3-AS1诱导巨噬细胞募集和M2极化[6]。因此HOMER3/Wnt/β-连环蛋白轴和CSF-1的激活,可以调控肿瘤细胞和巨噬细胞的行为,从而来驱动HCC进展。
2 ncRNA在HCC肿瘤微环境中参与免疫调控
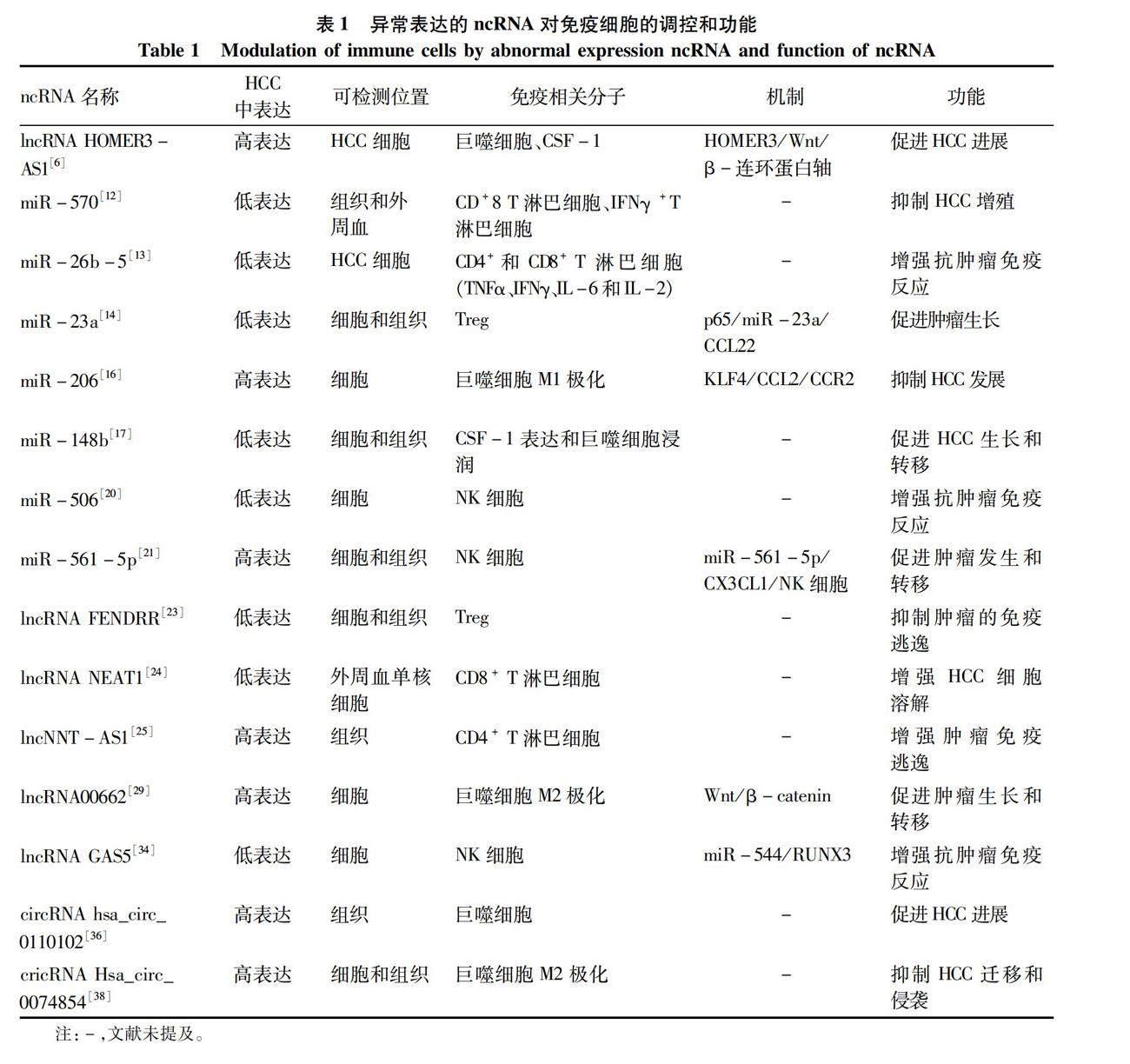
肿瘤微环境是一个包含多种细胞和非细胞成分的微型动态生态系统,肿瘤的一般生物学特征均受肿瘤微环境影响[7]。随着ncRNA对各种癌症调控机制的深入研究,许多证据[8-9]表明,肿瘤微环境中ncRNA不仅调控免疫细胞的分化、增殖和凋亡过程,而且可以通过免疫调控影响肿瘤细胞的增殖和侵袭。例如,miRNA在肿瘤微环境中可以促进基质和免疫细胞的募集区影响肿瘤的发生和发展[10]。miRNA在细胞间通讯中的活性作为肝脏疾病中的关键点,几乎参与了全部病理和生理过程。并且,大部分lncRNA和circRNA通过与之相应的miRNA海綿在肿瘤微环境中发挥调控作用。总结了多种表达异常的ncRNA对免疫细胞的调控和功能详见表1。
2.1 miRNA对免疫细胞的调控作用
2.1.1 miRNA调节T淋巴细胞参与肿瘤免疫 T淋巴细胞是针对各种病原体以及癌细胞免疫反应的核心,在转录和转录后的复杂网络中,miRNA已被证明参与T淋巴细胞的活化过程[11]。其中,CD8+T淋巴细胞可通过分泌TNFα、IFNγ等导致肿瘤细胞凋亡;CD4+T淋巴细胞可释放IL-2等多种细胞因子致使效应细胞杀伤能力增强。Lin等[12]报道,miR-570在HCC细胞(Bel-7404、Huh-7和HepG2细胞)中表达降低。相比对照组,注射miR-570模拟物的裸鼠外周血和肿瘤组织中CD8+T淋巴细胞、IFNγ的比率明显升高,并且肿瘤生长速度减慢、肿瘤质量及体积减小。表明miR-570可能通过调控CD8+T淋巴细胞的增殖和相关细胞因子的释放,从而抑制肿瘤的增殖和发展。此外,研究[13]发现,miR-26b-5在HCC中表达低于对照组,与HCC患者的不良预后相关。miR-26b-5p有助于CD4+T淋巴细胞和CD8+T淋巴细胞中TNFα、IFNγ、IL-6和IL-2的分泌。并作用于HCC中PIM-2来增强T淋巴细胞的免疫反应,从而使HCC的免疫系统重新激活来增强肿瘤免疫应答。还有研究发现,调节性T淋巴细胞(Treg)通常在免疫系统中发挥免疫抑制和耐受作用,常被肿瘤细胞拉拢以逃避免疫监视。Li等[14]报道,miR-23a在HBV相关HCC中表达降低,与C-C趋化因子配体(CCL)22的表达呈负相关。CCL22的作用是通过p65/miR-23a轴促进Treg募集。miR-23a直接靶向作用于CCL22 3′非翻译区(3′UTR),致使CCL22功能丧失,从而减弱Treg募集。同时,p65抑制剂通过与miR-23a启动子结合发挥转录抑制因子作用,致使CCL22表达和Treg的体外募集减少。因此,miR-23a抑制剂可以使CCL22上调,促进异种移植肿瘤生长,而p65抑制剂发挥的作用与miR-23a相反。由此可见,通过p65/miR-23a/CCL22轴调控Treg募集可以影响肿瘤免疫逃逸能力,从而改变肿瘤的进展。
2.1.2 miRNA诱导巨噬细胞极化参与肿瘤侵袭和转移 巨噬细胞是肿瘤微环境中起突出作用的重要免疫细胞,在肿瘤微环境中各种因素的刺激下极化为各种表型(主要是M1巨噬细胞发挥免疫活性和M2巨噬细胞促进免疫逃逸),从而影响肿瘤的生物学行为[15]。Liu等[16]发现,AKT/Ras通过诱导Kupffer细胞的M2极化和细胞毒性T淋巴细胞(CTL)的消耗,促进肝癌细胞的增殖。同时,miR-206通过靶向Kruppel样因子4(KLF4),使M1标志物(CCL2)增多,从而促进巨噬细胞M1极化。其中,miR-206诱导巨噬细胞M1极化和招募CTL的能力受KLF4/CCL2/CCR2轴的影响。由此可见,Kupffer细胞的M2极化是AKT / Ras模型小鼠HCC发展的重要因素。miR-206通过诱导Kupffer细胞的M1极化,促进CD8+ T淋巴细胞的募集,进而抑制HCC的进展。此外,巨噬细胞的浸润与肿瘤细胞的增殖和转移密切相关。Ke等[17]研究发现,miR-148b在HCC中表达降低,并且与肿瘤的复发、转移和预后不良之间存在正相关。进一步实验发现,miR-148b缺乏会导致由miR-148b-CSF1信号通路诱导的巨噬细胞浸润增加,进而促进肝癌细胞的增殖、浸润和转移,其中CSF-1受miR-148b的调控。
2.1.3 miRNA调节自然杀伤细胞(NK细胞)毒性参与抗肿瘤免疫反应 NK细胞对HCC细胞的毒性受损,可能是抗肿瘤免疫反应失败的重要原因[18]。一直以来,miRNA被认为是NK细胞发育和功能的重要调节因子,NK细胞激活后释放NK细胞毒性因子等产生类似CTL的作用,从而杀伤肿瘤细胞[19]。一项研究[20]发现,HCC患者的NK细胞中miR-506表达下调,STAT3 mRNA表达上调,与对照组相比,NK细胞作用于SMMC7721或HepG2细胞的细胞毒性显著降低。研究证明,NK细胞毒性与miR-506表达呈正相关,与STAT3 mRNA表达呈负相关。miR-506与STAT3的3′UTR靶向结合,抑制STAT3 mRNA的表达进而增强NK细胞对HCC细胞的毒性作用,从而增强抗肿瘤免疫反应,抑制肿瘤细胞的增殖。相反,过表达STAT3可以逆转该毒性作用。由此可见,miRNA可以靶向相应mRNA进而调节NK细胞,使机体抗肿瘤免疫反应增强,进一步抑制肿瘤细胞的增殖。另外一项研究[21]中发现,miR-561-5p在转移性HCC患者的组织和高转移潜力的肝癌细胞系中表达极高,并可以促进肿瘤生长和HCC肺转移。趋化因子CX3CL1(CX3C趋化因子配体1)作为miR-561-5p潜在靶标,可以激活NK细胞不同亚群,增强抗肿瘤反应,从而抑制肿瘤的进展。因此,miR-561-5p通过CX3CL1/NK细胞轴调控NK细胞的抗肿瘤免疫反应,可以进一步影响肿瘤发生和转移。
2.2 lncRNA对免疫细胞的调控作用
2.2.1 lncRNA调节T淋巴细胞功能参与肿瘤免疫免疫逃逸一直以来都是治疗癌症的绊脚石,据研究[22]表明,lncRNA通过调节肿瘤微环境中CD4+T、CD8+T淋巴细胞影响肿瘤进展以及肿瘤免疫。例如,lncRNA FENDRR在HCC组织和细胞中显著低于正常肝组织和肝细胞,沉默lncRNA FENDRR后,HCC细胞出現增殖能力增强和凋亡速率降低,但细胞中TGFβ、IL-10、VEGF、IFNγ和IL-4的表达显著增加,而lncRNA FENDRR过表达出现了相反的趋势。证明lncRNA FENDRR具有抑制免疫相关因子增殖和分泌的能力,同时也抑制HCC细胞增殖能力,促进HCC细胞凋亡[23]。进一步研究[24]发现,lncRNA FENDRR高表达可以抑制Treg的免疫抑制能力,从而抑制Treg介导的HCC免疫逃逸。此外,lncRNA NEAT1在HCC患者外周血单核细胞中表达增高,但其下调后可以抑制CD8+T淋巴细胞凋亡,并通过miR-155/Tim-3途径增强HCC细胞溶解活性。故此可见,lncRNA NEAT1沉默后通过调节miR-155/Tim-3途径可以降低CD8+T淋巴细胞凋亡率,增强肿瘤免疫,从而增强HCC细胞溶解活性,改善免疫治疗的结果。此外,Wang等[25]发现lncNNT-AS1在HCC组织中表达明显增加,免疫组化检测后表明lncNNT-AS1高表达与CD4+T淋巴细胞浸润减少相关。进一步研究发现lncNNT-AS1过表达通过激活TGFβ信号传导机制,进而损害肿瘤CD4+T淋巴细胞浸润来影响HCC的肿瘤免疫。
2.2.2 lncRNA诱导巨噬细胞极化参与肿瘤侵袭和转移 肿瘤相关的巨噬细胞一直被认为与HCC患者的生存率相关[26],M1型极化巨噬细胞对于肿瘤活性具有灭杀作用,相反,M2型极化巨噬细胞对于HCC细胞增殖、迁移等方面具有促进作用[27]。多种lncRNA被发现参与巨噬细胞极化的调节。例如,lncRNAMa301不仅与肝癌患者总体生存期密切相关,而且在M1型巨噬细胞中过表达。lncRNAMa301与caprin-1相互作用,通过Akt/erk-1途径可以抑制肝癌细胞的增殖、迁移和上皮间质转化[28]。又如,lncRNA00662在HCC中高表达,可以通过自分泌方式激活HCC细胞中的Wnt/β-catenin信号传导,影响HCC患者肿瘤的大小、侵袭和生存率;也可以通过旁分泌方式激活巨噬细胞中的Wnt /β-catenin信号传导,促进M2巨噬细胞极化,使HCC患者肿瘤的生长和转移能力增强[29]。上述研究表明lncRNA可以通过分子途径或信号传导的改变,调控肿瘤微环境中巨噬细胞极化,参与肿瘤的发生和发展。此外,巨噬细胞具有高水平的可塑性,可以在M1和M2两种极化表型之间动态转换。Ye等[30]利用脂多糖和IL-4分别诱导出RAW264.7巨噬细胞M1型和M2型进行研究,发现lncRNA cox-2在M1型巨噬细胞表达高于非极化巨噬细胞和M2型巨噬细胞。干扰lncRNA cox-2后,M1巨噬细胞抑制HCC细胞增殖、侵袭、迁移和促进细胞凋亡的能力明显下降,M2巨噬细胞促进HCC细胞增殖和抑制细胞凋亡的能力明显增强。这表明,lncRNA cox-2通过增强M1型巨噬细胞或抑制M2型巨噬细胞的极化调控肿瘤免疫逃逸,进而影响HCC细胞的增殖和肿瘤的侵袭和转移。
2.2.3 lncRNA调节NK细胞毒性参与抗肿瘤免疫反应 NK细胞具有消除病毒感染或杀伤细胞的能力,在先天性抗肿瘤免疫反应中起着关键作用[31]。与miRNA相似,lncRNA通过参与NK细胞毒性作用的调控,影响抗肿瘤免疫反应,进而影响肿瘤的生物学行为。例如,LINC00638/miR-4732-3p/ULBP1轴调控NK细胞的功能和浸润[32],MMP9与NK细胞的休眠和活化密切相关[33]。此外,Fang等[34]发现,lncRNA GAS5在HCC患者NK细胞中的表达较对照组降低,反而miR-544表达增高。活化NK细胞中敲除lncRNA GAS5后,RUNX3、INFγ分泌和NK细胞毒性明显降低,并且HepG2细胞凋亡速率降低。而lncRNA GAS5过表达后,情况则相反。继续研究发现,miR-544模拟物可以降低lncRNA GAS5过表达后产生的NK细胞对HCC细胞的杀伤作用,减弱抗肿瘤免疫反应。由此可见,lncRNA GAS5高表达可以通过miR-544/RUNX3增强 NK细胞毒性作用以及肿瘤微环境中的抗肿瘤免疫反应,进而抑制肿瘤的增长。
2.3 circRNA对免疫细胞的调控作用 免疫细胞是肿瘤微环境中最丰富的细胞成分,其与肿瘤细胞以及各种释放因子之间能量的相互作用是肿瘤发生和发展的关键[35]。最近,多种cricRNA被确定与免疫细胞相互作用,从而影响肿瘤细胞的迁移和侵袭能力。例如,circRNA hsa_circ_0110102在HCC组织中高表达,
circ_0110102靶向作用于miR-580-5p可以降低HCC细胞中过氧化物酶体增殖物活化受体α(PPARα)的表达,从而抑制CCL2分泌到肿瘤微环境中,而CCL2可以激活巨噬细胞环加氧酶-2/前列腺素E2途径增加其促炎细胞因子的释放[36]。可见hsa_circ_0110102作为miR-580-5p的海绵可以抑制巨噬细胞活化和肝癌细胞的增殖,迁移和侵袭能力。还有研究[37]发现,circUHRF1在人HCC组织中表达增高,circUHRF1可以靶向miR-449c-5p来调控TIM-3,而TIM-3增高与NK细胞比例降低和NK细胞肿瘤浸润减少密切相关。因此,circUHRF1可以调控TIM-3诱导NK细胞功能障碍来促进免疫抑制,使肿瘤细胞的增殖能力增强。由此可见,利用circRNA可以充当miRNA的海绵参与肿瘤免疫调节,进而调控肿瘤细胞的增殖和浸润。此外,Wang等[38]研究发现,cricRNA Hsa_circ_0074854在HCC组织和细胞中高表达,敲除cricRNA Hsa_circ_0074854不仅可以抑制HCC生长,而且可以抑制巨噬细胞M2极化,从而损害HCC细胞的迁移和侵袭。
3 ncRNA在HCC中诊断和治疗的潜在价值
HCC是一种恶性程度高、进展迅速、预后较差的肿瘤。因此,寻找早期有效的非侵入性诊断方法对于HCC的治疗和预后尤为重要。最近研究[39-42]发现,从癌细胞和组织释放的外泌体ncRNA几乎参加了HCC发展的所有阶段,并且在体液中表达失调,是非侵入性诊断生物标志物的潜在候选者。例如,Sun等[43]研究发现,miR-331-3p在HCV相关HCC患者早期血清中高表达,经手术治疗后表达明显下降。相反的是,miR-23b-3p在HCC早期患者血清中表达下降,經手术治疗后表达却显著升高。通过进一步比较,发现血清中miR-331-3p和miR-23b-3p表现出来敏感性和特异性均优于AFP。由此可见,血液中外泌体miRNA作为HCC早期诊断标志物比经典血清标志物AFP更具有优势。
此外,ncRNA被证明有希望成为HCC的有效治疗靶点。例如,miR-1258过表达可以与Smad2和Smad3直接结合,从而减弱TGFβ/Smad信号传导,抑制HCC细胞在体内外的迁移和侵袭[44]。lncRNA LINC01278作为miR-1258的负调节因子,LINC01278介导的HCC转移依赖于miR-1258的表达,miR-1258下调增强 LINC01278 的表达。并发现TCF-4是lncRNA LINC01278启动子的结合位点。lncRNA LINC01278低表达可减少由β-catenin和TGF-β1诱导的HCC细胞的迁移和侵袭。由此可见,通过β-catenin/TCF-4-LINC01278-miR-1258-Smad2/3轴调控HCC进展和转移,为LINC01278成为HCC潜在治疗靶点提供有力支持。
4 小結与展望
由上述可见,肿瘤微环境中ncRNA通过信号通路或分子传导机制调控免疫细胞生理功能,参与肿瘤免疫以及抗肿瘤免疫反应,从而改变肿瘤进程。因此,对于这些ncRNA的深入研究,可以为HCC早期诊断以及治疗提供新的思路。ncRNA在体液和组织外泌体中的表达失调,也让其成为非侵入性诊断生物标志物的可能。目前,尽管针对微环境中ncRNA对免疫细胞作用的研究可以为抗肿瘤治疗提供新的思路,但目前其作用机制仍然非常复杂,需要在未来进行更全面、深入的研究,以期形成新的基于ncRNA对免疫细胞调控作用的HCC治疗策略。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:杨超然、李思柔负责课题设计,资料分析,撰写论文;刘源、侯志远、王元参与收集数据,修改论文;杨季红负责拟定写作思路,指导撰写文章并最后定稿。杨超然和李思柔对本文贡献等同,同为第一作者。
参考文献:
[1]
SUNG H, FERLAY J, SIEGEL RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI: 10.3322/caac.21660.
[2]DING W, TAN YL, QIAN Y, et al. First-line targ veted therapies of advanced hepatocellular carcinoma: A Bayesian network analysis of randomized controlled trials[J]. PLoS One, 2020, 15(3): e0229492. DOI: 10.1371/journal.pone.0229492.
[3]ANASTASIADOU E, JACOB LS, SLACK FJ. Non-coding RNA networks in cancer[J]. Nat Rev Cancer, 2018, 18(1): 5-18. DOI: 10.1038/nrc.2017.99.
[4]AKBARI DILMAGHNAI N, SHOOREI H, SHARIFI G, et al. Non-coding RNAs modulate function of extracellular matrix proteins[J]. Biomed Pharmacother, 2021, 136: 111240. DOI: 10.1016/j.biopha.2021.111240.
[5]SHI TT, MORISHITA A, KOBARA H, et al. The role of long non-coding RNA and microRNA networks in hepatocellular carcinoma and its tumor microenvironment[J]. Int J Mol Sci, 2021, 22(19): 10630. DOI: 10.3390/ijms221910630.
[6]PU J, LI WC, WANG AM, et al. Long non-coding RNA HOMER3-AS1 drives hepatocellular carcinoma progression via modulating the behaviors of both tumor cells and macrophages[J]. Cell Death Dis, 2021, 12(12): 1103. DOI: 10.1038/s41419-021-04309-z.
[7]GIRALDO NA, SANCHEZ-SALAS R, PESKE JD, et al. The clinical role of the TME in solid cancer[J]. Br J Cancer, 2019, 120(1): 45-53. DOI: 10.1038/s41416-018-0327-z.
[8]PASCUT D, PRATAMA MY, VO NVT, et al. The crosstalk between tumor cells and the microenvironment in hepatocellular carcinoma: The role of exosomal microRNAs and their clinical implications[J]. Cancers, 2020, 12(4): 823. DOI: 10.3390/cancers12040823.
[9]JIA ZM, JIA JL, YAO LH, et al. Crosstalk of exosomal non-coding RNAs in the tumor microenvironment: Novel frontiers[J]. Front Immunol, 2022, 13: 900155. DOI: 10.3389/fimmu.2022.900155.
[10]XIA HM, HUANG ZY, LIU SQ, et al. Exosomal non-coding RNAs: Regulatory and therapeutic target of hepatocellular carcinoma[J]. Front Oncol, 2021, 11: 653846. DOI: 10.3389/fonc.2021.653846.
[11]DIENER C, HART M, KEHL T, et al. Quantitative and time-resolved miRNA pattern of early human T cell activation[J]. Nucleic Acids Res, 2020, 48(18): 10164-10183. DOI: 10.1093/nar/gkaa788.
[12]LIN YX, LIU S, SU L, et al. miR-570 inhibits proliferation, angiogenesis, and immune escape of hepatocellular carcinoma[J]. Cancer Biother Radiopharm, 2018, 33(6): 252-257. DOI: 10.1089/cbr.2017.2389.
[13]HAN W, LI N, LIU J, et al. microRNA-26b-5p enhances T cell responses by targeting PIM-2 in hepatocellular carcinoma[J]. Cell Signal, 2019, 59: 182-190. DOI: 10.1016/j.cellsig.2018.11.011.
[14]LI ZQ, WANG HY, ZENG QL, et al. p65/miR-23a/CCL22 axis regulated regulatory T cells recruitment in hepatitis B virus positive hepatocellular carcinoma[J]. Cancer Med, 2020, 9(2): 711-723. DOI: 10.1002/cam4.2611.
[15]WANG C, MA C, GONG LH, et al. Macrophage polarization and its role in liver disease[J]. Front Immunol, 2021, 12: 803037. DOI: 10.3389/fimmu.2021.803037.
[16]LIU NN, WANG XM, STEER CJ, et al. microRNA-206 promotes the recruitment of CD8+ T cells by driving M1 polarisation of Kupffer cells[J]. Gut, 2022, 71(8): 1642-1655. DOI: 10.1136/gutjnl-2021-324170.
[17]KE M, ZHANG Z, CONG L, et al. microRNA-148b-colony-stimulating factor-1 signaling-induced tumor-associated macrophage infiltration promotes hepatocellular carcinoma metastasis[J]. Biomed Pharmacother, 2019, 120: 109523. DOI: 10.1016/j.biopha.2019.109523.
[18]PIEIRO FERNNDEZ J, LUDDY KA, HARMON C, et al. Hepatic tumor microenvironments and effects on NK cell phenotype and function[J]. Int J Mol Sci, 2019, 20(17): 4131. DOI: 10.3390/ijms20174131.
[19]ZHANG QF, YIN WW, XIA Y, et al. Liver-infiltrating CD11b-CD27- NK subsets account for NK-cell dysfunction in patients with hepatocellular carcinoma and are associated with tumor progression[J]. Cell Mol Immunol, 2017, 14(10): 819-829. DOI: 10.1038/cmi.2016.28.
[20]SU ZX, YE XP, SHANG LM. miR-506 promotes natural killer cell cytotoxicity against human hepatocellular carcinoma cells by targeting STAT3[J]. Yonsei Med J, 2019, 60(1): 22-29. DOI: 10.3349/ymj.2019.60.1.22.
[21]CHEN EB, ZHOU ZJ, XIAO K, et al. The miR-561-5p/CX3CL1 signaling axis regulates pulmonary metastasis in hepatocellular carcinoma involving CX3CR1+ natural killer cells infiltration[J]. Theranostics, 2019, 9(16): 4779-4794. DOI: 10.7150/thno.32543.
[22]ZOU H, SHAO CX, ZHOU QY, et al. The role of lncRNAs in hepatocellular carcinoma: Opportunities as novel targets for pharmacological intervention[J]. Expert Rev Gastroenterol Hepatol, 2016, 10(3): 331-340. DOI: 10.1586/17474124.2016.1116382.
[23]YU Z, ZHAO H, FENG X, et al. Long non-coding RNA FENDRR acts as a miR-423-5p sponge to suppress the treg-mediated immune escape of hepatocellular carcinoma cells[J]. Mol Ther Nucleic Acids, 2019, 17: 516-529. DOI: 10.1016/j.omtn.2019.05.027.
[24]YAN K, FU Y, ZHU N, et al. Repression of lncRNA NEAT1 enhances the antitumor activity of CD8+T cells against hepatocellular carcinoma via regulating miR-155/Tim-3[J]. Int J Biochem Cell Biol, 2019, 110: 1-8. DOI: 10.1016/j.biocel.2019.01.019.
[25]WANG YK, YANG L, DONG XC, et al. Overexpression of NNT-AS1 activates TGF- β signaling to decrease tumor CD4 lymphocyte infiltration in hepatocellular carcinoma[J]. Biomed Res Int, 2020, 2020: 8216541. DOI: 10.1155/2020/8216541.
[26]WAN S, ZHAO E, KRYCZEK I, et al. Tumor-associated macrophages produce interleukin 6 and signal via STAT3 to promote expansion of human hepatocellular carcinoma stem cells[J]. Gastroenterology, 2014, 147(6): 1393-1404. DOI: 10.1053/j.gastro.2014.08.039.
[27]BAIG MS, ROY A, RAJPOOT S, et al. Tumor-derived exosomes in the regulation of macrophage polarization[J]. Inflamm Res, 2020, 69(5): 435-451. DOI: 10.1007/s00011-020-01318-0.
[28]LUO HL, LUO T, LIU JJ, et al. Macrophage polarization-associated lnc-Ma301 interacts with caprin-1 to inhibit hepatocellular carcinoma metastasis through the Akt/Erk1 pathway[J]. Cancer Cell Int, 2021, 21(1): 422. DOI: 10.1186/s12935-021-02133-1.
[29]TIAN XH, WU YY, YANG YT, et al. Long noncoding RNA LINC00662 promotes M2 macrophage polarization and hepatocellular carcinoma progression via activating Wnt/β-catenin signaling[J]. Mol Oncol, 2020, 14(2): 462-483. DOI: 10.1002/1878-0261.12606.
[30]YE YB, XU Y, LAI Y, et al. Long non-coding RNA cox-2 prevents immune evasion and metastasis of hepatocellular carcinoma by altering M1/M2 macrophage polarization[J]. J Cell Biochem, 2018, 119(3): 2951-2963. DOI: 10.1002/jcb.26509.
[31]SASAKI R, KANDA T, YOKOSUKA O, et al. Exosomes and hepatocellular carcinoma: From bench to bedside[J]. Int J Mol Sci, 2019, 20(6): 1406. DOI: 10.3390/ijms20061406.
[32]QI F, DU XJ, ZHAO ZY, et al. Tumor mutation burden-associated LINC00638/miR-4732-3p/ULBP1 axis promotes immune escape via PD-L1 in hepatocellular carcinoma[J]. Front Oncol, 2021, 11: 729340. DOI: 10.3389/fonc.2021.729340.
[33]ZHANG L, HU SS, CHEN JS, et al. Comprehensive analysis of the MIR4435-2HG/miR-1-3p/MMP9/miR-29-3p/DUXAP8 ceRNA network axis in hepatocellular carcinoma[J]. Discov Oncol, 2021, 12(1): 38. DOI: 10.1007/s12672-021-00436-3.
[34]FANG PP, XIANG LX, CHEN WL, et al. LncRNA GAS5 enhanced the killing effect of NK cell on liver cancer through regulating miR-544/RUNX3[J]. Innate Immun, 2019, 25(2): 99-109. DOI: 10.1177/1753425919827632.
[35]CHEN W, QUAN Y, FAN S, et al. Exosome-transmitted circular RNA hsa_circ_0051443 suppresses hepatocellular carcinoma progression[J]. Cancer Lett, 2020, 475: 119-128. DOI: 10.1016/j.canlet.2020.01.022.
[36]WANG XX, SHENG W, XU T, et al. CircRNA hsa_circ_0110102 inhibited macrophage activation and hepatocellular carcinoma progression via miR-580-5p/PPARα/CCL2 pathway[J]. Aging, 2021, 13(8): 11969-11987. DOI: 10.18632/aging.202900.
[37]ZHANG PF, GAO C, HUANG XY, et al. Cancer cell-derived exosomal circUHRF1 induces natural killer cell exhaustion and may cause resistance to anti-PD1 therapy in hepatocellular carcinoma[J]. Mol Cancer, 2020, 19(1): 110. DOI: 10.1186/s12943-020-01222-5.
[38]WANG Y, GAO RF, LI JP, et al. Downregulation of hsa_circ_0074854 suppresses the migration and invasion in hepatocellular carcinoma via interacting with HuR and via suppressing exosomes-mediated macrophage M2 polarization[J]. Int J Nanomedicine, 2021, 16: 2803-2818. DOI: 10.2147/IJN.S284560.
[39]TANG X, REN H, GUO M, et al. Review on circular RNAs and new insights into their roles in cancer[J]. Comput Struct Biotechnol J, 2021, 19: 910-928. DOI: 10.1016/j.csbj.2021.01.018.
[40]SHI Y, LIU JB, DENG J, et al. The role of ceRNA-mediated diagnosis and therapy in hepatocellular carcinoma[J]. Hereditas, 2021, 158(1): 44. DOI: 10.1186/s41065-021-00208-7.
[41]CHEN WL, XU XM. New progress in the study of markers for the early diagnosis of liver cancer[J]. China Med Herald, 2023, 20(1): 40-44. DOI: 10.20047/j.issn1673-7210.2023.01.08.
陳文亮, 徐细明. 肝癌早期诊断标志物的研究新进展[J]. 中国医药导报, 2023, 20(1): 40-44. DOI: 10.20047/j.issn1673-7210.2023.01.08.
[42]HUANG FX, LI HY, LI ZK, et al. Regulation of thymosinα1 resistance to hepatocellular carcinoma by long chain non-coding RNA LINC0110[J]. Chin J Immunol, 2022, 38(10): 1207-1211. DOI: 10.3969/j.issn.1000-484X.2022.10.010.5
黄凤霞, 李海燕, 李正堃, 等. 长链非编码RNA LINC01105调控肝癌对胸腺素α1耐药[J]. 中国免疫学杂志, 2022, 38(10): 1207-1211. DOI: 10.3969/j.issn.1000-484X.2022.10.010.5
[43]SUN QY, LI J, JIN BX, et al. Evaluation of miR-331-3p and miR-23b-3p as serum biomarkers for hepatitis C virus-related hepatocellular carcinoma at early stage[J]. Clin Res Hepatol Gastroenterol, 2020, 44(1): 21-28. DOI: 10.1016/j.clinre.2019.03.011.
[44]HUANG WJ, TIAN XP, BI SX, et al. The β-catenin/TCF-4-LINC01278-miR-1258-Smad2/3 axis promotes hepatocellular carcinoma metastasis[J]. Oncogene, 2020, 39(23): 4538-4550. DOI: 10.1038/s41388-020-1307-3.
收稿日期:
2022-07-28;录用日期:2022-09-09
本文编辑:王莹
