脱乙酰魔芋葡甘聚糖对猪肉肌原纤维蛋白结构及凝胶特性的影响
2023-02-07栗俊广张旭玥陈历水白艳红
栗俊广,张旭玥,王 昱,2,禹 晓,2,庞 杰,陈历水,白艳红,
(1.郑州轻工业大学食品与生物工程学院,河南 郑州 450000;2.河南省冷链食品质量与安全控制重点实验室,河南 郑州 450000;3.中原食品实验室 郑州轻工业大学,河南 漯河 462000;4.福建农林大学食品科学学院,福建 福州 350002;5.漯河市卫龙生物技术有限公司,漯河市食品安全与营养健康重点实验室,河南 漯河 462000)
肉制品加工中,凝胶特性是决定其感官品质的重要功能特性[1]。其中,多糖类常被当作肌肉蛋白凝胶增强剂或者脂肪代替物[2],不仅可以改善肉制品的感官品质,还可以平衡膳食营养[3]。魔芋葡甘聚糖(konjac glucomannan,KGM)是从魔芋块茎中提取的一种水溶性、非离子性、高分子质量的中性多糖[4],具有降低胆固醇、增强饱腹感、预防高血压和降血脂的功效[5]。KGM由1∶1.6的D-葡萄糖和D-甘露糖残基组成,在C-6位置约有5%~10%的乙酰基取代基。乙酰基与KGM的凝胶特性和增稠特性密切相关,没有脱除乙酰基时,KGM只能形成热可逆凝胶[6],且黏度较大,限制了其在食品加工中的应用。脱乙酰魔芋葡甘聚糖(deacetylated konjac glucomannan,DKGM)不但可以形成热不可逆凝胶[7],还能改善KGM的黏弹性。Xu Lilan等[8]研究发现,DKGM可以提高鸡肉糜的凝胶硬度,降低烹饪损失;Xu Yongxia等[9]报道DKGM可以与鱼肌球蛋白交联形成耐热复合物,从而提高凝胶强度。因此,DKGM在肉制品加工中具有广泛的应用价值。
肌原纤维蛋白(myofibrillar protein,MP)作为肌肉中最重要的蛋白质,不仅影响肉的嫩度,同时还决定着肉糜类制品的凝胶性能[10]。热诱导凝胶过程中,MP结构和化学作用力变化是决定蛋白凝胶性能(如凝胶强度、持水力)的重要因素[11]。MP在加热过程中去折叠化,引起蛋白质构象发生变化,暴露内部活性基团,活性基团间相互作用形成分子间作用力,从而使蛋白质交联形成三维网状结构,蛋白质三维网状结构的形成是蛋白质之间相互吸引,维持平衡的结果,且凝胶的形成主要依靠分子间的氢键、离子键、二硫键以及疏水相互作用[11]。多糖被认为是改善低脂重组肉制品适口性的最有效和最经济的脂肪替代品,因此,研究多糖与蛋白质之间的相互作用机制至关重要。近年来,大多数研究集中在多糖对凝胶品质的影响,而从结构和分子力的角度出发,探究DKGM对猪肉MP凝胶特性的影响机理还鲜有报道。
本实验研究不同添加量DKGM对MP凝胶强度和持水力的影响,同时利用傅里叶变换红外光谱、荧光光谱、冷场扫描电子显微镜等手段,分析DKGM对MP二级结构、微观构像、水分分布及分子间作用力的影响,为DKGM在肉制品中的应用提供一定理论指导。
1 材料与方法
1.1 材料与试剂
猪后腿肉 郑州某超市;KGM 上海源叶生物科技有限公司;所有试剂均为分析纯。
1.2 仪器与设备
Ultra-turrax T25高速分散器 德国IKA公司;AB265-S分析天平 梅特勒-托利多仪器(上海)有限公司;Avanti J-26s XPI高速冷冻离心机 美国Beckman公司;Lab-1-50冷冻干燥机 北京博医康实验仪器有限公司;FE-SEM冷场扫描电子显微镜、F-7000荧光光度计日本日立公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;TA-XT Plus质构分析仪 英国Stable Micro System公司;NM120低场核磁共振成像分析仪 上海纽迈电子科技有限公司;Vertex傅里叶变换红外光谱仪 布鲁克(北京)科技有限公司;Multiskan GO全波长酶标仪 美国赛默飞世尔科技公司;Well水浴恒温摇床 江苏省苏州威尔实验用品有限公司。
1.3 方法
1.3.1 DKGM制备
参考李晶[12]的方法并稍作修改。在蒸馏水中加入适量Na2CO3(Na2CO3与KGM质量比为0.12∶1),完全溶解后,加入KGM,使其质量浓度为4 g/100 mL。1500 r/min搅拌2 h,静置2 h,用2 倍体积的75%乙醇溶液和蒸馏水(pH值调整到7左右)交替洗涤沉淀物,室温挥干乙醇,冷冻干燥后得到DKGM。参照Du Xuezhu等[13]的方法,测得DKGM的脱乙酰度为92.87%。
1.3.2 猪肉MP提取
参照Li Junguang等[14]的方法。将新鲜猪肉绞碎后,先后分别与4 ℃、pH 7.0的提取缓冲液(含1×10-5mol/L Na2HPO4、2×10-6mol/L MgCl2、0.1 mol/L乙二醇双(2-氨基乙基醚)四乙酸)和4 ℃、0.1 mol/L NaCl洗涤液按1∶4(g/mL)混合并均质,4 ℃、3000×g离心3 次,每次15 min,得到MP。用双缩脲法测定MP质量浓度。
1.3.3 DKGM-MP混合凝胶制备
将不同添加量的DKGM(0%、0.125%、0.25%、0.5%、1%,m/m)加入到4 ℃、pH 7.0的磷酸盐缓冲液(含0.6 mol/L NaCl、5×10-5mol/L Na2HPO4/NaH2PO4)中,搅拌均匀后加入MP(质量浓度30 mg/mL),10000 r/min匀浆30 s。将混合后的样品以5 ℃/min的速率从20 ℃加热到80 ℃,80 ℃维持20 min,得到DKGM-MP混合凝胶。
1.3.4 持水力的测定
将凝胶样品放入离心管中,4 ℃、10000×g离心10 min,弃去上清液,按下式计算凝胶持水力:
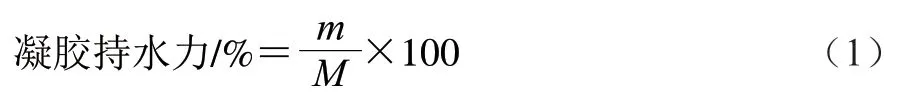
式中:m为离心后凝胶样品的质量/g;M为离心前凝胶样品的质量/g。
1.3.5 凝胶强度的测定
使用TA.XT.plus质构分析仪测定样品的凝胶强度,条件设置如下:探头为P/0.5,测试前、测试中、测试后速率分别为2、1、2 mm/s,压缩比为40%,触发力5 g。
1.3.6 水分分布测定
参照栗俊广等[15]的方法。使用低场核磁共振仪对MP凝胶中的氢质子密度进行成像扫描,结果用Osiris软件进行伪彩处理。
1.3.7 内源性荧光测定
根据Li Ke等[16]的方法并稍作修改。参数设置如下:激发波长280 nm、发射波长280~500 nm,狭缝宽度2.5 nm,扫描速率1200 nm/min。将MP悬浮液调节至0.1 mg/mL后进行扫谱并记录其内源性荧光强度。
1.3.8 活性巯基含量测定
参照Ellman[17]的方法。将MP溶液稀释至4 mg/mL,将1 mL MP溶液与4 mL pH 7.0缓冲液(含1×10-5mol/L Na2HPO4/NaH2PO4、0.6 mol/L NaCl)混合,加入100 μL 1×10-5mol/L 5,5’-二硫代双(2-硝基苯甲酸),4 ℃避光条件下继续反应1 h。在412 nm波长处测定吸光度。1.36×104作为摩尔消光系数,按下式计算MP活性巯基含量:
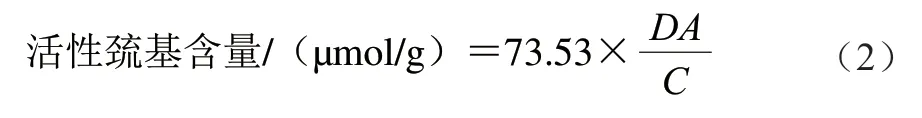
式中:D为稀释倍数;A为MP溶液在412 nm处的吸光度;C为MP质量浓度/(mg/mL)。
1.3.9 傅里叶变换红外光谱扫描
将凝胶样品冷冻干燥并通过80 目筛,将1 mg样品和100 mg干燥的KBr加入玛瑙研钵并压制成片。使用傅里叶变换红外光谱仪上在4000~500 cm-1波数范围内对样品进行扫描,分辨率为4 cm-1。使用PeakFit v.4.12软件分析蛋白质二级结构的变化。
1.3.10 凝胶分子力测定
参照王昱[18]的方法。5 种不同变性溶液:0.05 mol/L NaCl(S1)、0.6 mol/L NaCl(S2)、0.6 mol/L NaCl+1.5 mol/L尿素(S3)、0.6 mol/L NaCl+8 mol/L尿素(S4)以及0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/Lβ-巯基乙醇(S5)。将切碎的凝胶样品分别与5 种变性溶液按质量比1∶5混合,10000 r/min均质2 min,4 ℃保持1 h,10000×g离心15 min。取上清液,用Bradford法测定上清液中的蛋白质含量,计算离子键(S2和S1之差)、氢键(S3和S2之差)、疏水相互作用(S4和S3之差)和二硫键(S5和S4之差)的含量。
1.3.11 微观结构观察
参照Zhou Feibai等[19]的方法。升华时间为12 min,5 mA下溅射60 s后,在1 kV加速电压下使用冷场扫描电子显微镜观察MP凝胶结构,并在放大3000 倍下拍照。
1.4 数据处理
2 结果与分析
2.1 DKGM对MP凝胶持水力和凝胶强度的影响
如表1所示,添加DKGM后,凝胶的持水力先上升后下降,添加量为0.25%时达到最大值。研究表明,持水力与凝胶系统中的氢键含量密切相关,而持水力的小幅度增强可能是由于DKGM改善了凝胶系统中分子间的作用力[20],形成了更稳定的凝胶网络结构,使其保持水分的能力增强,但去除乙酰基的KGM水溶性减小[21],DKGM可以使MP疏水性剧烈增加,导致蛋白质过度展开或聚集,从而导致MP凝胶的持水力不会大幅度增强。样品的凝胶强度随着DKGM质量分数的增加而增大,0.25%时达到峰值后略微减小,这与Yuan Li等[21]的研究结果类似,表明DKGM可以通过促进蛋白质的聚集从而增强鱼糜的凝胶强度。凝胶系统中的蛋白质与多糖相互作用是提高凝胶变形和破裂力的原因[22],去除乙酰基的KGM不仅排除了空间位阻效应[23],同时也促进了MP的去折叠,暴露了更多的活性基团(疏水基团、活性巯基),改善了凝胶系统中多糖与蛋白质以及蛋白质间的相互作用,从而形成了更稳固的三维网络结构。

表1 DKGM添加量对MP凝胶持水力和凝胶强度的影响Table 1 Effect of DKGM addition on water-holding capacity and gel strength of MP gels
2.2 DKGM对MP凝胶水分分布的影响
如图1所示,通过低场核磁成像得到了凝胶内部的氢质子分布情况,从红到蓝依次代表水分含量的减少[24],氢质子密度与凝胶强度和持水力密切相关,对照组显示出更强的氢质子密度,且分布最均匀,这与持水力和凝胶强度的结果一致。Li Zhiyu等[25]表示,DKGM作为一种“活性填料”,可以与蛋白发生非特异性相互作用,从而减缓水的流动性,并在凝胶系统中捕获更多的水分子。

图1 不同DKGM添加量的MP凝胶水分分布Fig.1 Moisture distribution of MP gels with different amounts of DKGM added
2.3 DKGM对MP内源性荧光的影响
300~450 nm波长处的荧光光谱可以表征MP分子中疏水残基附近的微环境变化[26]。如图2所示,添加DKGM后,最大荧光发射波长红移,表明更多色氨酸残基暴露于极性环境中[27],DKGM的加入改变了蛋白的三级结构,将先前掩埋的疏水基团和结合位点暴露在外。荧光强度与最大荧光发射波长的结果相似,对照组的荧光强度最小,表明DKGM与MP之间发生了一定的相互作用,在一定程度上改变了色氨酸环境的敏感程度,改变了蛋白质的空间构像,促进了蛋白质的展开,从而影响了MP凝胶特性。
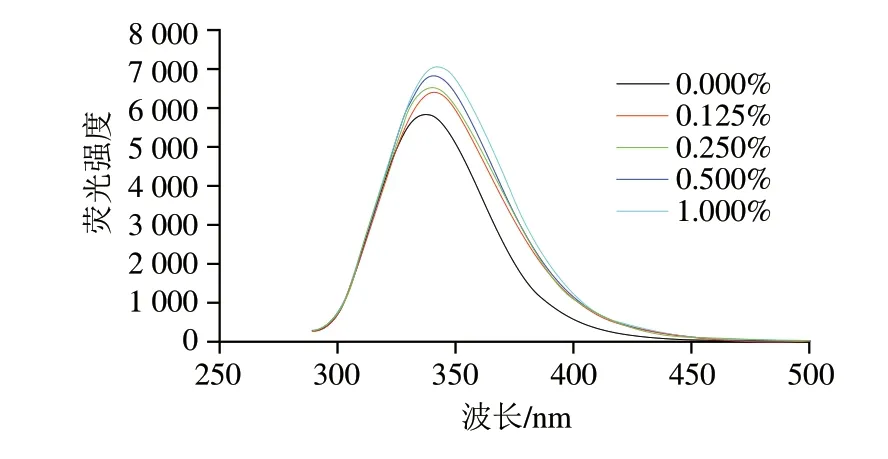
图2 不同DKGM添加量的MP荧光光谱Fig.2 Endogenous fluorescence spectra of MP with different amounts of DKGM added
2.4 DKGM对MP活性巯基含量的影响
巯基含量常用于反映蛋白质的二硫键生成情况、折叠或空间构像的改变情况[28],大多数分布在肌球蛋白头部,暴露的巯基基团是形成凝胶网络结构的先决条件,在维持蛋白质的三级和四级结构中起重要作用。由图3可知,添加DKGM后,MP的活性巯基含量显著增加(P<0.05),表明DKGM可以促进MP的去折叠,使蛋白质展开,暴露内部的活性巯基,从而在加热过程中氧化形成更多二硫键,稳定MP的凝胶网络结构。DKGM质量分数超过0.25%时,活性巯基含量呈现下降趋势,可能是由于完全展开的蛋白质更倾向于形成大的聚集体[22],从而使活性巯基重新被掩埋。
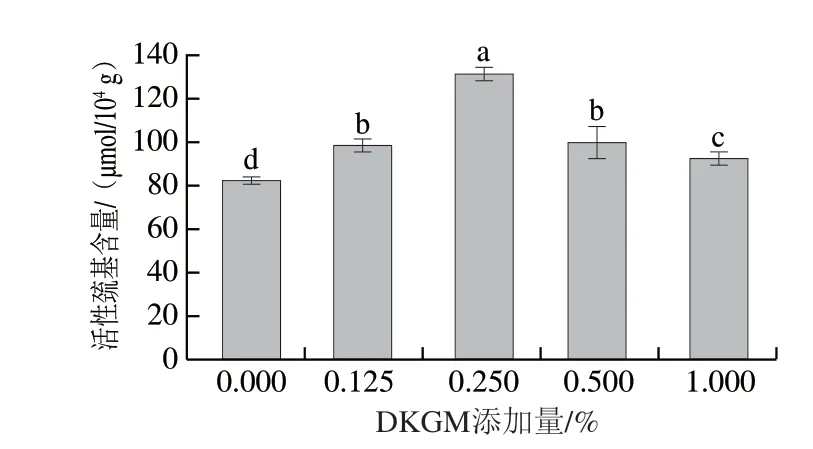
图3 不同DKGM添加量的MP活性巯基含量Fig.3 Contents of active sulfhydryl groups in MP with different amounts of DKGM added
2.5 DKGM添加量对MP凝胶二级结构的影响
由图4可知,加入DKGM后,α-螺旋相对含量显著降低(P<0.05),α-螺旋主要由分子中羟基氧和羟基氢之间形成的氢键稳定[29]。β-折叠和β-转角含量明显升高,Liu Ru等[30]研究表明更多β-折叠和β-转角可以提高凝胶的凝胶强度和储能模量。DKGM可以促进α-螺旋向β-折叠的转变,有益于凝胶的形成。这一结果也说明了DKGM可以促进α-螺旋结构的展开,诱导MP的去折叠反应,暴露更多疏水基团和活性巯基,从而影响其分子间作用力,形成更密集的三维网络结构,这与三级结构的结果相呼应。

图4 不同DKGM添加量的MP凝胶二级结构Fig.4 Secondary structure composition of MP gels with different amounts of DKGM added
2.6 DKGM对MP凝胶分子力的影响
蛋白质分子间的作用力对凝胶网络的形成十分重要,其中包括离子键、氢键、疏水相互作用以及二硫键的作用。Xu Yongxia等[9]表明疏水相互作用是形成凝胶的主要驱动力,而氢键会对稳定的凝胶网络结构产生不利影响。如图5所示,疏水相互作用和二硫键是MP凝胶中的主要作用力,DKGM的添加不会影响凝胶系统中离子键的相对含量,而氢键的相对含量减小。α-螺旋由氢键稳定,DKGM的加入加速了α-螺旋向β-折叠的转变,因此破坏了凝胶系统中的氢键。添加DKGM后疏水相互作用相对含量显著提高(P<0.05)。这是由于乙酰基的去除增加了DKGM的疏水性,促使MP中疏水基团的暴露,从而促进MP热诱导凝胶过程中蛋白质的展开,导致蛋白质-蛋白质间以及蛋白质和DKGM间的疏水相互作用增强[8],而过量的DKGM可能会导致MP表面疏水性剧烈增加从而导致蛋白质重新聚集,在加热过程中疏水相互作用减小。二硫键的结果与活性巯基的结果相呼应,MP的去折叠化使活性巯基暴露,导致加热过程中氧化形成了更多二硫键,二硫键和疏水相互作用的共同作用使MP形成了更好的凝胶网络结构。
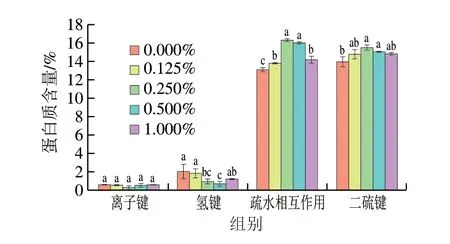
图5 不同DKGM添加量的MP凝胶分子力Fig.5 Molecular forces of MP gels with different amounts of DKGM added
2.7 DKGM对MP凝胶微观结构的影响
如图6所示,所有样品都具有三维网状结构,表明凝胶具有弹性行为。图中黑色孔径代表水分通道[31]。放大3000 倍后,对照组的孔径较大,且孔径分布不均匀;添加DKGM后,凝胶的三维网状结构更加致密且均匀。且添加量为0.25%时,凝胶壁厚增加,DKGM均匀分布在三维网状结构中。添加量达到0.5%时,虽然网状结构更加致密,但断裂较多,壁厚减小;添加量达到1%时,网状结构大片断裂,水分通道再次增大,凝胶的持水能力与水分通道的分布有关,水分通道越小,结构断裂越少则持水力越好[32],这与持水力的结果一致。加热过程中,蛋白质展开并发生相互作用,从而形成三维网状结构,这一结果说明DKGM促进了蛋白质的展开,从而促进了蛋白质分子间以及蛋白质和DKGM之间的相互交联,且DKGM可以充当“基质”填充在三维网状结构中,但DKGM添加量过多时,DKGM会破坏原有的三维网状结构,且可能由于蛋白质过度展开从而导致其更倾向于重新聚集,对凝胶网状结构造成负面影响。
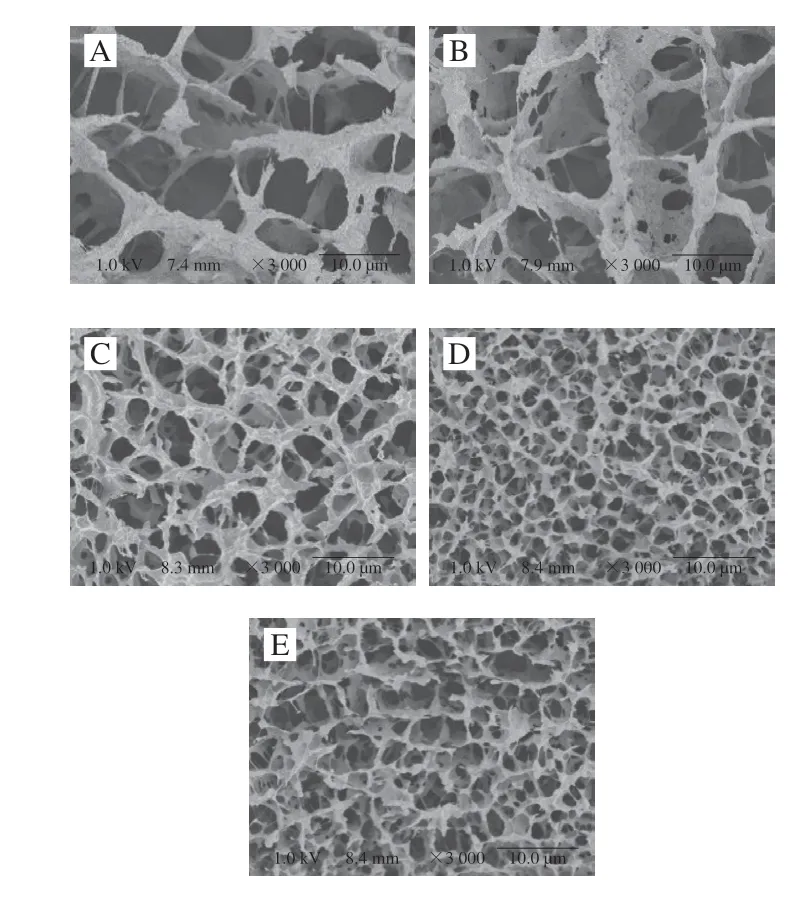
图6 不同DKGM添加量的MP凝胶的冷场电镜扫描图Fig.6 Cold-field scanning electron micrographs of MP gels with different amounts of DKGM added
3 结论
研究不同添加量DKGM对MP凝胶强度和持水力的影响,同时利用傅里叶变换红外光谱、荧光光谱、冷场扫描电子显微镜等手段,分析DKGM对MP二级结构、微观构像、水分分布及分子间作用力的影响。结果表明,DKGM可以通过改善MP的结构特性影响分子间作用力,从而增强其凝胶强度和持水力,且在质量分数为0.25%时效果最佳;DKGM的添加可以加速MP的去折叠,导致疏水基团的暴露和活性巯基的增加;二级结构结果显示,DKGM可以诱导加热过程中更多α-螺旋向β-折叠的转变;分子力结果显示,添加DKGM后MP凝胶中氢键的相对含量减少,二硫键和疏水相互作用的相对含量增加;DKGM通过改善MP的结构特性使MP凝胶水分通道减小,形成了更加致密的凝胶网络结构,但DKGM添加量过大时,MP原有的网状结构被破坏,且蛋白的过度变性可能致使其重新聚集,导致凝胶强度和持水力下降。
