冻融及加热过程鲢鱼鱼糜制品中晚期糖化终末产物的形成机制
2023-02-07廖梓康吴金鸿汪少芸黄轶群王发祥刘永乐李向红
李 婷,廖梓康,李 珍,吴金鸿,汪少芸,黄轶群,王发祥,刘永乐,李向红,
(1.长沙理工大学食品与生物工程学院,湖南 长沙 410114;2.湖南省水生资源食品加工工程技术研究中心,湖南 长沙 410114;3.上海交通大学农业与生物学院,上海 200240;4.福州大学生物科学与工程学院,福建 福州 350108)
晚期糖化终末产物(advanced glycation endproducts,AGEs)是在非酶促条件下,由蛋白质、氨基酸等物质的游离氨基与还原糖的活性羰基经过缩合、重排、裂解、氧化修饰等途径形成的一系列结构复杂的共价加成物[1],可与人体多种组织细胞结合,增加多种慢性疾病的发病概率,危害人类健康[2]。食源性AGEs主要通过美拉德反应形成,还可以通过还原糖的自氧化、脂质过氧化和多元醇降解等途径生成[3-5]。食品的热加工过程会促使脂质和蛋白质发生氧化降解,产生大量活性氧自由基,诱导形成更活跃的α-二羰基化合物,如乙二醛(glyoxal,GO)和丙酮醛(methylglyoxal,MGO)等,可与赖氨酸和精氨酸残基直接反应生成AGEs[6]。
鲢鱼(又称白鲢)价格低廉,产量大,养殖产量在2020年达381.29万 t,占全国淡水鱼产量的12.34%,是我国冷冻鱼糜加工的主要淡水鱼品种[7]。鱼糜制品是以冷冻鱼糜为主要原料加工得到的水产制品,口感细嫩,营养丰富,深受消费者喜爱[8]。由于我国目前的冷链系统并不完善,在贮运、销售或消费过程中,冻藏环境会产生较大的温度波动,导致冻结食品的多次解冻和再冻结[9]。鱼糜制品含有丰富的蛋白质和少量的脂质,且需经过斩拌、加热等工序;原料的冻融和热加工过程会引起脂肪氧化及蛋白质降解[10],极有可能促进AGEs的形成,但目前国内外鲜有关于冻融及加工工序中鱼糜制品的脂肪氧化和蛋白质降解与AGEs产生规律的报道。
因此,本研究将鲢鱼鱼糜在不同冻藏温度下(-20、-60 ℃)进行多次冻融循环(6 次)后,测定热加工过程中(45 ℃、30 min和45 ℃、30 min+90 ℃、20 min)鱼糜制品脂肪氧化、蛋白质降解、内源性荧光、α-二羰基化合物及AGEs的变化情况,分析冻融循环及加热过程对鱼糜制品中脂肪氧化、蛋白质降解和AGEs形成的影响,探讨脂肪氧化、蛋白质降解与AGEs形成的相关性,以期获得冻融循环和热加工鱼糜制品中AGEs形成机制,为优化原料冻藏条件及鱼糜制品加工方法以降低AGEs的产生提供一定理论依据。
1 材料与方法
1.1 材料与试剂
鲢鱼购于湖南省长沙市高云市场,每尾质量(2.5±0.5)kg。
木瓜蛋白酶(10 U/mg) 美国Sigma公司;羧甲基赖氨酸(Nε-carboxylmethyl-lysine,CML)、D4-CML加拿大Toronto Research Chemicals有限公司;混合型强阳离子交换固相萃取柱(CNW Poly-Sery MCX SPE)中国安谱实验科技有限公司。
1.2 仪器与设备
T10型手持式均质机 德国IKA公司;LD5-10型离心机 北京京立离心机有限公司;DYCZ-25D型电泳仪北京六一生物科技有限公司;ZB-20型斩拌机 山东诸城华钢机械有限公司;EVOQ GC-TQ气相色谱-质谱联用仪 德国布鲁克公司;F-7100型荧光分光光度仪日本日立有限公司;LC-20AT高效液相色谱仪 日本岛津有限公司;液相色谱-质谱联用仪(2695 HPLC系统)美国Waters公司;Qtrap 4500 MS系统 新加坡AB SCIEX公司。
1.3 方法
1.3.1 鱼糜制品的制备
新鲜的鲢鱼取背部白肉,用冰水清洗3 次后沥干表面水分。鱼肉中加入质量分数2.5%的食盐,在斩拌机中斩拌6 min,期间加入冰水以降低鱼糜温度。将制备好的水分质量分数为(82.04±0.11)%的鲢鱼鱼糜分别在-20 ℃和-60 ℃冷冻9 h,然后在4 ℃解冻15 h,为1 次冻融循环。鱼糜经过0、3、6 次冻融循环(0-FT、3-FT、6-FT)后,分别加入质量分数9%的木薯淀粉,充分混合,为未加热鱼糜制品,于45 ℃加热30 min,为一段加热鱼糜制品;在45 ℃加热30 min后继续在90 ℃加热20 min,为二段加热鱼糜制品。
1.3.2 挥发性脂肪氧化产物的测定
鱼糜制品的脂肪氧化基于顶空固相微萃取-气相色谱-质谱联用技术进行检测[11]。在3.00 g样品中加入7 mL饱和NaCl溶液,均质30 s,取7.00 g混合物及100 μL内标2,4,6-三甲基吡啶(0.01 mg/mL)于20 mL顶空气相瓶中。
气相色谱条件:DB-5MS色谱柱(30 m×0.25 mm,0.25 μm);升温程序:色谱柱初温40 ℃,保持4 min,以5 ℃/min升温至90 ℃,再以10 ℃/min升温至230 ℃,保持10 min;柱温40 ℃,进样口温度250 ℃,压力51.3 MPa,总流量17.3 mL/min。以1 mL/min氦气的恒定流速流动,不分流进样。
质谱条件:电子电离源;电离电压70 eV;离子源温度200 ℃;接口温度250 ℃;全扫描模式;扫描速率769 u/s;质量扫描范围33~500 u。
1.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
取1.00 g样品于10 mL的2 mg/mL SDS溶液中均质,室温下放置30 min,6000 r/min离心10 min,取0.5 mL上清液,与等体积2 倍还原样品缓冲液混合,沸水浴5 min后以10000 r/min离心3 min。随后分别配制浓缩胶和分离胶,将其灌入电泳装置。加样后在浓缩胶电流恒定15 mA,分离胶电流恒定25 mA的模式下进行电泳。
1.3.4 游离赖氨酸含量的测定
取2.00 g样品,加入10 mL 0.01 mol/L盐酸,均质30 s后低温下超声30 min,定容至50 mL,加入等体积的80 mg/mL磺基水杨酸溶液,于4 ℃静置12 h,混匀后以6000 r/min离心10 min,取2 mL上清液以11000 r/min再次离心10 min,上清液过0.22 μm滤膜后用全自动氨基酸分析仪进行检测分析。用外标法计算样品中赖氨酸的含量。
1.3.5 内源性荧光的测定
在1.00 g样品中加入10 mL 0.02 mol/L磷酸缓冲盐溶液(0.6 mol/L NaCl,pH 6.5)后均质,6000 r/min离心10 min,使用荧光分光光度计对上清液进行光谱扫描,激发波长290 nm,发射波长310~500 nm,狭缝宽度5 nm。
1.3.6 二羰基化合物的测定
实验参考Li Lin等[3]的方法。在2.00 g样品中加入10 mL 0.6 mol/L的高氯酸溶液,均质后于4 ℃静置15 min,8000 r/min离心10 min。取1 mL上清液,加入0.2 mL 0.25 mg/mL的邻苯二胺溶液,在60 ℃避光加热3 h,冷却后过0.22 μm的滤膜,上机。使用Capcell PAK C18AQ色谱柱(4.6 mm×250 mm),洗脱液分别为0.15%(V/V)的乙酸溶液(溶剂A)和乙腈(溶剂B)。梯度洗脱程序:0~1.0 min,92% A,8% B;1.0~10.0 min,92%~60% A,8%~40% B;10.0~12.0 m i n,60%~52% A,40%~48% B;12.0~13.0 min,52%~40% A,48%~60% B;13.0~15.5 min,40%~20% A,60%~80% B;15.5~20.5 min,20%~96% A,80%~8% B;20.5~25.0 min,92% A,8% B。流速0.8 mL/min,柱温25 ℃,样品进样量20 μL,检测波长313 nm。
1.3.7 AGEs的提取检测
1.3.7.1 CML的提取检测
实验按照Niu Lihong等[1]的方法略有改动。称取0.20 g样品,加入2 mL硼酸缓冲液(0.2 mol/L,pH 9.2)和0.4 mL硼氢化钠溶液(2 mol/L),充分混匀后于4 ℃还原8 h;加入4 mL氯仿-甲醇溶液(1∶2,V/V),充分混匀后在4500 r/min离心10 min。除去液体,加入4 mL 6 mol/L盐酸,于110 ℃酸解24 h;酸解完的样品加水定容至10 mL,取2 mL溶液于烧杯中,加入200 μL 0.002 mg/mLD4-CML内标,于50 ℃进行真空干燥。干燥后的样品复溶于4 mL水中,取2 mL溶液进行过MCX固相萃取小柱,洗脱液于60 ℃水浴氮吹,干燥后复溶于2 mL甲醇-水溶液(4∶1,V/V),经0.22 μm滤膜过滤后收集待测。使用2695 HPLC系统和Qtrap 4500串联质谱系统在电喷雾离子源正电离模式下进行分析检测。HPLC系统中使用Atlantis亲水相互作用液相色谱硅胶柱(HILIC,150 mm×2.1 mm,3 μm)对样品中的CML进行分离。
1.3.7.2 荧光AGEs的提取检测
实验参考Verzijl等[12]的方法并有所改动。将样品冻干后研磨成粉末状,取0.015 g冻干粉,加1 mL 2.5 U/mL的木瓜蛋白酶溶液,在55 ℃条件下振荡4 h,11000 r/min离心15 min,上清液过0.45 μm滤膜进行荧光分析。激发波长365 nm;发射波长380~600 nm;狭缝宽度5 nm。
1.4 数据处理
2 结果与分析
2.1 冻融循环和热加工过程中鱼糜制品的脂肪氧化
脂肪氧化是造成鱼肉不良气味的主要原因,壬醛、1-辛烯-3-醇的含量可反映水产品脂肪氧化的程度[13]。醛类化合物属于次级脂肪氧化产物,由不饱和脂肪酸中的氢过氧化物β-裂解产生,壬醛是油酸在血红蛋白的催化下氧化降解而形成[14]。如图1所示,冻融循环温度对鱼糜制品中壬醛含量无显著影响(P>0.05)。冻融循环对一段加热鱼糜制品中壬醛的含量无明显影响,但随着冻融次数增加,未加热和二段加热的鱼糜制品中壬醛含量增加,且在6 次冻融循环后达到最大值(P<0.05)。在未加热样品中,经过6 次冻融后,壬醛含量从(206.05±0.68)ng/g增加至(244.01±32.17)ng/g(-20 ℃)和(237.47±19.69)ng/g(-60 ℃),壬醛含量的增加,说明冻融循环加剧了鱼糜制品中不饱和脂肪酸的过氧化。加工工序对未冻融循环处理的样品中壬醛的含量无明显影响,在Li Dongping等[15]的研究中也发现了类似的情况。但在加热处理过的鱼糜制品中,壬醛含量先降低后增加,在-20 ℃经过6 次冻融循环后的样品中,一段加热后,壬醛含量从先(244.01±32.18)ng/g降低至(212.28±14.68)ng/g,二段加热后又增加至(259.58±3.05)ng/g。壬醛含量的降低表明其降解或消失速率大于形成速率,生成的壬醛可能与氨基酸、肽进一步反应,从而导致其含量降低[14]。

图1 冻融循环及热加工过程中鱼糜制品的挥发性脂肪氧化产物含量变化Fig.1 Changes in contents of volatile fat oxidation products in surimi during freeze-thaw cycles and thermal processing
醇类化合物由脂肪酸二级氢过氧化物的降解或羰基化合物还原而形成,1-辛烯-3-醇是花生四烯酸在12-脂氧合酶的氧化催化下作用形成[15]。如图1所示,经过6 次冻融循环后,1-辛烯-3-醇含量显著增加(P<0.05),但冻融循环温度对鱼糜制品中1-辛烯-3-醇含量无显著影响(P>0.05)。经过不同次数的冻融循环的二段加热样品中,-20 ℃和-60 ℃冻融的鱼糜制品中1-辛烯-3-醇的含量分别增加了43.01 ng/g(3 次)、94.53 ng/g(6 次)和49.87 ng/g(3 次)、99.63 ng/g(6 次)。任兴晨[16]对带鱼鱼糜制品进行贮藏时发现,1-辛烯-3-醇的含量随着贮藏的时间延长而增加,并在第12天达到最大值。在未进行冻融的样品中,热处理对鱼糜制品中的1-辛烯-3-醇的含量没有影响,但在进行3 次和6 次冻融循环后,加工工序对其含量影响显著(P<0.05)。与未加热样品相比,6 次冻融后的二段加热后的样品中1-辛烯-3-醇的含量分别增加了58.65 ng/g(—20 ℃)和85.61 ng/g(—60 ℃),可能是在前期的冻融循环中,虽然1-辛烯-3-醇含量较低,但随着脂肪氧化程度的增加,1-辛烯-3-醇的前体物质花生四烯酸的含量增加,在加热后进一步氧化产生了更多的1-辛烯-3-醇。
2.2 冻融循环和热加工过程中鱼糜制品的蛋白质降解
鲢鱼肌肉蛋白质中肌原纤维蛋白(主要由肌球蛋白和肌动蛋白组成)占总数的60%~70%[17]。如图2所示,样品中蛋白质的分子质量在10~200 kDa之间,各样品均以肌球蛋白重链(200 kDa)和肌动蛋白(40~50 kDa)为主。冻融温度对鱼糜制品的蛋白质分子质量没有明显影响。随着冻融次数增加,不同条带之间的变化均不显著,可能是因为鱼肉的主要蛋白为盐溶性的肌原纤维蛋白,而样品提取时用的SDS溶液没有高效地将其提取出来,导致总蛋白在冻融中的变化趋势不够显著。Jiang Qingqing等[18]在对金枪鱼进行冻融循环时发现,即使冻融到第8次,样品的总蛋白质组成也没有明显差异,但随着冻融循环次数的增加,水溶性蛋白和肌原纤维蛋白的SDS-PAGE图谱存在显著差异。随着加工工序增加,肌球蛋白重链逐渐变淡,新增了分子质量为150、120 kDa及30 kDa的蛋白,70~85 kDa的条带明显加深,说明在加热过程中,鱼糜制品中肌球蛋白逐渐降解成小分子蛋白。而肌动蛋白在加热过程中无明显变化,说明肌动蛋白在加热时较为稳定,鱼糜制品分段加热过程中的温度对其影响不大,这与陈跃文等[19]的研究一致。
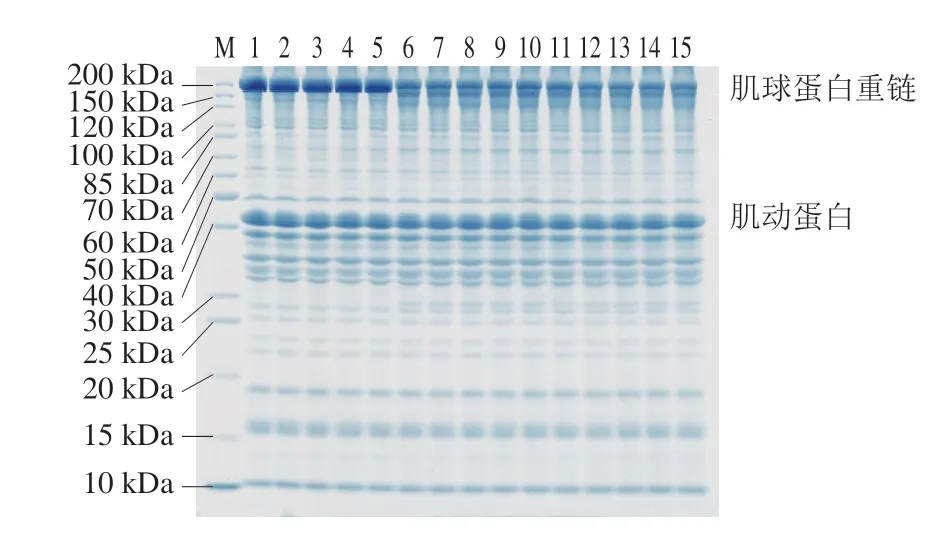
图2 冻融循环及热加工过程中鱼糜制品的SDS-PAGE图Fig.2 SDS-PAGE patterns of proteins in surimi during freeze-thaw cycles and thermal processing
游离氨基酸含量可反映蛋白质降解情况,其中,赖氨酸是CML的重要前体之一,其侧链中的2 个伯氨基是氨基酸中最具糖基化反应活性的结构[20],赖氨酸含量与样品中CML的生成密切相关。由图3可知,随着冻融循环次数增加,未加热和加热处理后的鱼糜制品中游离赖氨酸的含量均增加,在第6次冻融循环后达到最大值,在-20 ℃和-60 ℃冻融6 次后,未加热鱼糜制品中赖氨酸含量从(29.86 ± 0.61)mg/100 g分别增加到(31.49±0.71)mg/100 g和(31.09±0.61)mg/100 g。刘秀英等[21]也发现随着4 ℃贮藏时间的延长,马面鱼肉中赖氨酸含量逐渐增加,在第7天后达到最大值。而随着加工工序的增加,鱼糜制品中赖氨酸的含量先增加后略微降低。Zhu Zongshuai等[22]对炖鸡进行加工时也发现,随着煎炸时间的延长,赖氨酸含量逐渐增加,但经过进一步的煮沸和高温杀菌后,赖氨酸含量均降低,可能是煎炸促进了美拉德反应,进一步的煮沸和高温处理导致蛋白质热降解,赖氨酸逐渐暴露和释放,此过程中赖氨酸可能与二羰基结合形成AGEs,导致其含量的降低。

图3 冻融循环及热加工过程中鱼糜制品的赖氨酸含量变化Fig.3 Changes in lysine content in surimi during freeze-thaw cycles and thermal processing
2.3 冻融循环和热加工过程中鱼糜制品的内源性荧光强度变化
内源性荧光强度可以反映蛋白质三级结构的变化[23]。如图4所示,冻融循环温度对内源性荧光物质含量无显著影响(P>0.05)。随着冻融循环次数增加,鱼糜制品的内源性荧光强度逐渐增加(P<0.05)。除了色氨酸残基的变化,蛋白质与蛋白质、蛋白质与脂质以及蛋白质与水的相互作用也会导致蛋白质构象的变化,从而导致内源性荧光的增加[24-25]。Karoui等[26]对鲷鱼鱼肉进行内源性荧光测定时也发现冻融循环增加,荧光强度随之增加。在同一冻融循环条件下,内源性荧光强度随着加工工序增加显著降低(P<0.05)。在未经过冻融循环的样品中,一段加热和二段加热分别使鱼糜制品中内源性荧光的强度降低了1895.67和3989.97。加热过程会导致鱼肉蛋白质的变性聚集,破坏其内部结构,蛋白质构象发生变化,导致内源荧光强度下降[27]。

图4 冻融循环及热加工过程中鱼糜制品的内源性荧光强度变化Fig.4 Changes in endogenous fluorescence of surimi during freezethaw cycles and thermal processing
2.4 冻融循环和热加工过程中鱼糜制品的α-二羰基化合物含量变化
GO和MGO是典型的α-二羰基化合物,也是重要的AGEs前体物质[28],其含量变化如图5所示。冻融循环温度对鱼糜制品中α-二羰基化合物含量无显著影响(P>0.05)。冻融循环次数增加,鱼糜制品中GO、MGO的含量均有所降低,在未加热样品中未表现出显著性(P>0.05),但在6 次冻融循环后的一段加热和二段加热样品表现出显著性(P<0.05)。经过6 次冻融后,二段加热样品GO的含量分别降低了31.57%(-20 ℃)和27.27%(-60 ℃),MGO的含量分别降低了22.49%(-20 ℃)和22.64%(-60 ℃)。α-二羰基化合物可由美拉德反应、糖类的自氧化、脂肪氧化和微生物发酵等多种途径形成,而鱼糜制品中富含不饱和脂肪酸,主要通过脂肪氧化途径形成α-二羰基化合物[6]。在冻融过程中,脂肪氧化在不断发生,形成了许多小分子物质,还未生成GO和MGO,与此同时,鱼肉中原本含有的GO和MGO也在不断发生进一步反应,造成冻融期间其含量降低[29]。如图5所示,GO和MGO经过不同加工工序后均有不同程度的增加,GO和MGO的含量在一段加热后均略微增加,较低的加热温度使其增加较为缓慢,在二段加热后显著增加(P<0.05)。在-20 ℃下进行不同冻融循环的样品中,与未加热相比,一段加热使GO和MGO含量增加了0.01~0.04 μg/g和0.03~0.05 μg/g,二段加热使GO和MGO含量增加了0.10~0.24 μg/g和0.08~0.14 μg/g;-60 ℃冻融的样品趋势与-20 ℃一致,一段加热使GO和MGO含量增加了0.01~0.03 μg/g和0.02~0.04 μg/g,二段加热使GO和MGO含量增加了0.07~0.24 μg/g和0.07~0.14 μg/g。Maasen等[6]对223 种不同类型食物中的二羰基化合物含量进行研究,发现煎、炸等高温处理方式比煮、蒸等较为温和的加工方式会产生更多的二羰基化合物,且处理时间越长,其含量越高。

图5 冻融循环及热加工过程中鱼糜制品的α-二羰基化合物含量变化Fig.5 Changes in contents of α-dicarbonyl compounds in surimi during freeze-thaw cycles and thermal processing
2.5 冻融循环和热加工过程中鱼糜制品的AGEs含量变化
2.5.1 冻融循环和热加工过程中鱼糜制品的CML含量变化
目前,在已发现的20多种AGEs中,CML被广泛用作代表性物质进行研究[30]。如图6所示,冻融循环温度对鱼糜制品中CML的含量无显著影响(P>0.05)。在未加热样品中,冻融循环对CML含量无明显影响(P>0.05),但在加热的样品中,经过6 次冻融循环后,CML含量显著增加(P<0.05)。与未冻融样品相比,一段加热和二段加热的样品经过6 次冻融循环后CML的含量增加了0.22 mg/kg(-20 ℃)、0.49 mg/kg(-60 ℃)和0.31 mg/kg(-20 ℃)、0.69 mg/kg(-60 ℃)。加工工序显著促进了鱼糜制品中CML含量的增加(P<0.05)。样品在冻融循环中发生脂质氧化和蛋白质降解,这些变化(如肽键的断裂和氨基酸残基的暴露)有助于在加热过程中产生CML,导致在二段加热后CML含量迅速增加[31]。Yu Ligang等[32]发现生猪肉冻藏时间从0 d增加至120 d后,热加工制成的肉丸中的CML含量从13.26 mg/kg蛋白显著增加到43.30 mg/kg蛋白。

图6 冻融循环及热加工过程中鱼糜制品的CML含量变化Fig.6 Changes in CML content of surimi during freeze-thaw cycles and thermal processing
2.5.2 冻融循环和热加工过程中鱼糜制品的荧光AGEs含量变化
具有荧光吸收特性的AGEs被统称为荧光AGEs,如戊糖素和交联素等,其含有较多的杂环结构[33]。如图7所示,随着冻融循环次数增加,荧光AGEs含量增加(P<0.05),在第6次冻融循环后达到最大值,冻融循环温度对鱼糜制品中荧光AGEs的含量无显著影响(P>0.05),与CML的变化趋势一致。与未冻融样品相比,在-20 ℃和-60 ℃冻融6 次后,未加热、一段加热、二段加热的样品中的荧光AGEs含量分别增加了95.97(-20 ℃)、88.60(-60 ℃)、67.33(-20 ℃)、41.13(-60 ℃)、121.83 AU(-20 ℃)和63.10 AU(-60 ℃)。在不同冻融循环次数的样品中,加工工序增加,荧光AGEs的含量也显著增加(P<0.05)。在第0天未加热样品中,一段加热和二段加热分别使荧光AGEs含量增加了17.03%和62.99%。加热的时间和温度会显著增加鱼糜制品中的蛋白质降解和脂肪氧化程度,促进样品中荧光AGEs的形成。Wu Runlin等[34]在对草鱼块进行油炸处理时发现,油炸后的样品中荧光AGEs含量显著增加,且油炸时间越长,其含量越高。

图7 冻融循环及热加工过程中鱼糜制品的荧光AGEs含量变化Fig.7 Changes in fluorescent AGEs content in surimi during freezethaw cycles and thermal processing
2.6 鱼糜制品中脂肪氧化、蛋白质降解与AGEs的相关性分析和AGEs形成机制分析
鱼糜制品在经过不同冻融循环和加工工序后脂肪氧化和蛋白质降解与AGEs之间的相关性尚不明确,因此,对各指标之间进行Pearson相关性分析,相关系数及显著性水平见表1。结果显示,壬醛、1-辛烯-3-醇与冻融循环呈极显著正相关(P<0.01),GO与冻融循环呈显著负相关(P<0.05),说明脂肪氧化与冻融循环次数之间存在很强的相关性。1-辛烯-3-醇、赖氨酸与热加工过程呈显著正相关(P<0.05),内源性荧光物质与热加工过程呈极显著负相关(P<0.01),GO、MGO、CML、荧光AGEs与热加工过程呈极显著正相关(P<0.01),说明脂肪氧化、蛋白质降解以及AGEs的形成与热加工过程存在很强的相关性。根据相关性结果可以发现,与冻融循环次数相比,热加工过程是影响AGEs及其前体物质形成的主要因素。CML和荧光AGEs均与1-辛烯-3-醇、MGO呈极显著正相关(P<0.01),与赖氨酸、GO呈显著正相关(P<0.05),与内源性荧光呈极显著负相关(P<0.01),荧光AGEs与壬醛呈显著正相关(P<0.05)。

表1 冻融循环及热加工过程中鱼糜制品脂肪氧化、蛋白质降解、α-二羰基化合物及AGEs之间的相关性Table 1 Pearson’s correlation between lipid oxidation,protein degradation, α-dicarbonyl compounds and AGEs in surimi during freezethaw cycles and thermal processing
脂质氧化产生多种氧化产物,其中的二羰基化合物可直接与氨基酸结合生成AGEs;蛋白质降解导致肌原纤维蛋白重链的展开、产生小分子肽和活性氨基基团,赖氨酸可直接与二羰基化合物结合形成AGEs;蛋白的结构的变化还可能暴露AGEs的一些特异性结合位点[35]。鱼糜制品的原料在冻融循环过程中冰晶的重结晶会导致细胞破裂释放脂质氧化酶和血红素铁等催化剂,且冰晶消失产生的孔隙使原料和与氧气接触面积增大,促进脂肪氧化[36];此外,冰晶的重结晶导致鱼肉蛋白纤维断裂,在内源酶和微生物的作用下,结合脂肪氧化进一步促进蛋白质降解。因此,原料的冻融循环为鱼糜制品中AGEs的形成提供二羰基化合物和活性氨基等前体物质。在加工过程中,鱼糜制品中少量的还原糖可以与蛋白质的活性氨基通过美拉德反应途径[1]产生AGEs,产生的席夫碱和Amadori产物可以分别通过Namiki途径[37]和Amadori重排[38]产生二羰基化合物;温度的增加进一步促进了脂肪氧化和蛋白质降解,可以通过Acetol途径[39]产生AGEs,与此同时,原料冻融期间产生的AGEs前体物质也通过加热迅速反应,通过多种途径在鱼糜制品中形成AGEs。
3 结论
鱼糜制品经过6 次冻融后,壬醛、1-辛烯-3-醇、内源性荧光、赖氨酸、CML和荧光AGEs含量显著增加(P<0.05),GO、MGO含量显著降低(P<0.05),蛋白质分子质量无明显变化;加热后,1-辛烯-3-醇、GO、MGO、CML和荧光AGEs含量显著增加(P<0.05),色氨酸含量显著降低(P<0.05),赖氨酸含量先增加后降低,肌球蛋白重链逐渐降解。统计分析结果显示CML和荧光AGEs均与1-辛烯-3-醇、MGO呈极显著正相关(P<0.01),与内源性荧光呈极显著负相关(P<0.01),与赖氨酸、GO呈显著正相关(P<0.05),荧光AGEs与壬醛呈显著正相关(P<0.05)。因此,原料的冻融循环为鱼糜制品中AGEs的形成提供大量前体物质。在加工过程中,鱼糜制品中的少量的还原糖也可通过美拉德反应途径产生AGEs,温度的升高进一步促进了脂肪氧化和蛋白质降解,与此同时,原料冻融期间产生的AGEs前体物质也通过加热迅速反应,通过多种途径在鱼糜制品中形成AGEs,影响其食用安全性,本研究为优化鱼糜冻藏条件及鱼糜制品加工方法以降低AGEs的产生提供理论依据。
