右美托咪定对横纹肌溶解致急性肾损伤肾组织中MyD88和TRAF6蛋白的影响
2023-01-14赵文琪夏洪莲范修颖张月顺
赵文琪 张 震 夏洪莲 范修颖 张月顺▲
1.牡丹江医学院附属红旗医院麻醉科,黑龙江牡丹江 157000;2.南京明基医院麻醉科,江苏南京 210000
横纹肌溶解症(rhabdomyolysis,RM)本身作为一种临床综合征,是由物理、化学和生物等多种因素的共同作用,导致肌肉细胞破裂,肌红蛋白、电解质和酶类被释放到血液中,造成不同性质和程度的肌肉损伤,随后各种实验室和临床检查异常[1-2]。其最重要的并发症之一是急性肾损伤(acute kidney injury,AKI),病死率高达8%,急性小管坏死和大量炎性细胞浸润是RM诱导的AKI的主要病理特征[3]。研究表明,AKI的发生与TLR/MyD88/NF-κB通路紧密关联[4-5]。但目前关于RM致AKI的具体作用机制尚少,基于此,本研究建立肌内注射甘油致大鼠AKI模型,并测定MyD88和TRAF6在大鼠肾脏组织中的表达。在大鼠肌内注射甘油前,给予右美托咪定(dexmedetomidine,DEX),观察其对AKI的保护作用,以期为RM致AKI的临床预防和治疗提供思路。
1 材料和方法
1.1 试剂及仪器
盐酸右美托咪定(佑必妥,扬子江药业集团有限公司,国药准字H20183219,规格:2 ml∶0.2 mg);髓样细胞分化因子 88(MyD88)和肿瘤坏死因子受体相关因子 6(TRAF6)兔抗鼠多克隆抗体(美国Santa公司);HRP标记的山羊二抗(北京中杉金桥);ECL化学发光试剂盒(南京恩晶生物科技有限公司);ELISA试剂盒(上海碧云天生物科技有限公司)。
1.2 实验动物与分组
SPF级健康雄性SD大鼠共45只,10周龄,体重200~220 g。随机分为CN组、AKI组和DEX组,每组各15只。饲养环境温度保持在22℃~26℃,喂食1周后开始实验。本研究已得到牡丹江医学院实验动物伦理委员会批准(IACUC-20210104-2)。
1.3 动物模型的建立
每组大鼠禁食禁水24 h。除CN组外,其他各组肌内注射50%甘油,剂量为10 ml/kg,建立RM致AKI的大鼠模型。大鼠后腿肿胀僵硬,无法自由活动是成功用药的标志。CN组大鼠在相同部位注射相同剂量的生理盐水。DEX组中,造模前30 min腹腔注射30 μg/kg的DEX,在CN组和AKI组,同期腹腔注射相同剂量的生理盐水。
1.4 取材及标本处理
所有大鼠在造模后24 h选择2%戊巴比妥钠进行麻醉,取下腔静脉血。静置15 min,3000 r/min高速离心,取上清液,冷冻于-20℃的冰箱内。采血后,迅速摘除肾脏。将4%的多聚甲醛溶液注入左肾,固定24 h;右肾储存在-80℃的超低温冰箱里。
1.4.1 血清生化检测 取冻存大鼠血清,使用ELISA试剂盒按试剂说明书检测大鼠血清肌酐(creatinine,Cr)、血 尿 素 氮(blood urea nitrogen,BUN)、肌酸激酶(creatine kinase,CK)浓度水平。
1.4.2 肾组织病理学观察 取冻存肾组织进行石蜡包埋切片。进行HE染色,光学显微镜下(200×)观察各组大鼠肾组织病理学变化。
1.4.3 Western blot法检测肾组织中的MyD88和TRAF6的表达 冻存肾组织提取蛋白进行蛋白定量。对等量的蛋白质进行取样,电泳转移到PVDF膜上,稀释的一抗将其密封,在4°C的摇床中孵化过夜。TBST清洗细胞膜,在与二抗孵化后,TBST再次洗膜,ECL显色发光显影,仪器观察结果并保存图像。
1.5 统计学方法
采用SPSS 26.0统计学软件进行数据处理,计量资料用均数±标准差(±s)表示,两两比较采用t检验,多组比较采用单因素方差分析(one-way ANOVA),以P< 0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清BUN、Cr、CK比较
AKI和DEX组BUN、Cr、CK浓度均高于CN组,差异有统计学意义(P< 0.05);DEX组BUN、Cr、CK水平低于AKI组,差异有统计学意义(P< 0.05),见表1。

表1 各组大鼠血清BUN、Cr、CK比较(x ± s)
2.2 肾脏组织病理学变化
大体观:CN组大鼠双肾表面光滑,形态饱满,呈暗红色,形状类似于蚕豆,弹性良好,色泽正常;AKI组和DEX大鼠双肾体积略有增大,充血水肿,颜色呈紫红色,质脆易出血。DEX组好于AKI组,但与CN组比较双肾肿大,颜色仍较暗。见图1。

图1 各组大鼠肾脏大体观
HE染色显示,CN组大鼠肾脏结构完整。甘油肌内注射后大鼠的病理变化主要发生在肾小管,镜下显示肾小管含有蛋白管型,空泡变性的现象,以及间质的炎性反应。DEX组和AKI组比较,损伤程度有所下降,但是与CN组比较仍然损伤明显。见图2。

图2 各组大鼠肾组织病理学变化(HE,200×)
2.3 各组大鼠肾组织MyD88、TRAF6蛋白水平比较
AKI组和DEX组MyD88、TRAF6蛋白水平高于CN组,差异有统计学意义(P< 0.05);DEX组MyD88、TRAF6蛋白水平低于AKI组,差异有统计学意义(P< 0.05),见图3。
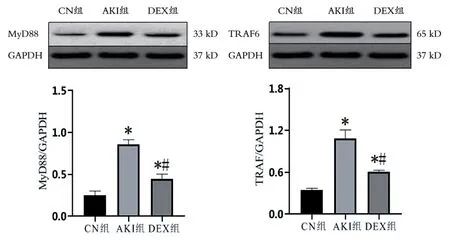
图3 各组大鼠肾组织MyD88及TRAF6的表达
3 讨论
RM的特征是广泛的骨骼肌纤维破坏及其内容物释放到血液中,通过肾小球滤出并促进AKI的发展,其与RM高病死率和发病率相关[6-7]。其典型三联征包括肌痛、乏力和深色尿[8]。本研究旨在评估DEX对大鼠的甘油诱导的RM致AKI的肾保护功效及可能机制。结果显示肾损伤大鼠血清BUN、Cr显著增加,同时伴随着血清学RM相关生物标志物CK活性的增加,证明甘油注射造模成功。研究证实,Mb/CK比值是RM致AKI的预测因子,Mb/CK比值>0.2时,RM致AKI的发生风险显著增加[9]。本研究未对血清Mb值进行检测,此为本研究的局限性之一。
RM致AKI的发病机制尚不完全清楚,研究表明炎症反应与RM致AKI的发生和发展有关[10]。TLR信号通路介导的炎症反应是AKI的重要致病因素[11]。在TLR信号通路传导过程中,MyD88及TRAF6参与其中,与细胞内信号传导途径以及其他多种生物过程有关[12-14]。本研究采用Western blot法测定各组大鼠组织中MyD88及TRAF6的表达,发现肌肉甘油注射后其在肾组织表达显著增加,提示MyD88及TRAF6与RM引起的AKI有关。
DEX作为干预药物,其常用于临床麻醉中,是一种对心脏、肾、脑器官的再灌注损伤有保护作用的镇静药[15]。研究表明,DEX能减少炎症因子的产生,从而减少器官缺血再灌注损伤[16]。但其在RM诱导的AKI中的作用及其对TLR/MyD88/TRAF6信号通路的影响尚无报道。Chen等[17]研究的干预方法,在大鼠后腿肌注甘油前,腹腔注射DEX 30μg/kg,显示经DEX干预后,大鼠一般状态较好,相比AKI组肾脏功能明显好转;电镜下观察大鼠肾脏的病理变化,DEX组和AKI组比较,损伤程度有所下降;与AKI模型组比较,MyD88和TRAF6的表达也显著减少,这表明DEX可通过抑制炎症反应减少肾损伤,且可能通过作用于MyD88 和 TRAF6靶点,阻断 TLR 炎症通路。本研究由于条件有限,未对大鼠肾小球滤过率及尿量进行具体监测,为本研究的局限性之二。
综上所述,甘油肌内注射的大鼠肾脏组织中表达了MyD88和TRAF6,提示二者都参与了RM致AKI,炎症反应在损伤中起着重要作用;DEX的干预降低了肾组织中TRAF6和MyD88的表达,表明DEX通过降低TRAF6和MyD88的表达来抑制炎症反应,这可能是DEX减轻RM致AKI的一个重要的保护机制。
