转化生长因子β1 在血小板促进甲状腺未分化癌侵袭迁移中的作用
2023-01-02蒋玉娥钟兆铭高艳章孙瑞梅孙传政
蒋玉娥 ,钟兆铭 ,高艳章 ,王 伟 ,孙瑞梅 ,孙传政
(1)昆明医科大学第三附属医院/云南省肿瘤医院检验科;2)头颈外二科,昆明 云南 650118;3)昆明医科大学第一附属医院肿瘤内科,昆明 云南 650032)
甲状腺未分化癌(anaplastic thyroid carcinoma,ATC)高度恶性,发病率占全部甲状腺癌的1%~3%,但其致死率却占全部甲状腺癌的35%~50%,研究发现ATC 高死亡率与确诊时近50%的远处转移发生率关系密切[1-2],因此,探究ATC 高侵袭转移的机制,为ATC 的靶向治疗提供更多新方案尤为关键。早在19 世纪临床专家就发现,肿瘤患者血小板(platelet,PLT)增多与肿瘤转移有关[3-4]。最近一项包含17 285 例患者、中位随访超过5 a 的临床研究发现,每日服用阿司匹林(抗PLT 聚集药物)的患者其肿瘤远处转移发生率显著降低[5];笔者前期临床回顾性研究也发现,一些ATC 患者外周血血小板计数增多与其更差的预后密切相关[1],本研究拟利用人ATC 细胞为研究对象,探索PLT 促进ATC 细胞迁移及侵袭能力的潜在机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞株实验所用ATC 细胞系(ARO、FRO、SW579)来自美国模式培养物集存库(ATCC),昆明医科大学第三附属医院肿瘤研究所有冻存品备用。所有细胞系均在37 ℃、5% CO2的细胞培养箱中进行培养,ARO 和FRO 细胞系在含5%胎牛血清(FBS)的1640 培养基中培养,SW579 在含10% FBS 的DMEM 培养基中培养。
1.1.2 主要试剂及来源抗体(fibronectin、snail、a-catenin、GAPDH)购于Cell signal technology,Ecadherin 抗体购于 Abcam 公司,细胞因 子TGFβ1 购于Peprotech 公司。PCR 引物购于生工生物,PCR 的mix 购于Invitrogen 公司。使用的qPCR 设备来自罗氏公司。
1.2 实验方法
1.2.1 PLT 提取抽取健康志愿者外周静脉血5 mL 于抗凝管中(包括ACD 液),静置30 min,室温200 g 离心20 min,上清液即为富含PLT 的血浆。吸出上清置于EP 管中,室温800 g 离心20 min,弃上清管底沉淀为PLT。轻轻沿管壁加入PLT 洗涤液1 mL,重复1 次。Tyrode 缓冲液(包括5 mM 葡萄糖和新鲜3% BSA)重悬PLT。提取的PLT 尽快用于实验以防其失活。将PLT 与ATC 细胞按照10∶1 的比例加入无血清培养基中进行共培养。
1.2.2 划痕实验单细胞层、低血清(1%胎牛血清)体系培养。一次性10 µL Tip 头尖端在培养皿中划3~5 道平行线,于0、6、12、24 h 随机取5 个不同视野观察划痕愈合并照相。
1.2.3 Transwell 迁移实验将8 µm 孔径的小室放入24 孔板中,ATC 细胞加入上层腔室(无血清培养基),下层为含10%胎牛血清培养基。10 h后取出培养小室,PBS 洗涤小室预冷甲醇固定细胞20 min 后,小心用棉签擦拭去除室内贴附细胞,0.5%结晶紫室温染色5 min 计数。
1.2.4 酶联免疫吸附实验(ELISA)首先包被抗体4 ℃孵育过夜,然后加入100 µL 待测细胞培养上清进行孵育,室温2 h。随后加入TGFβ1 检测抗体进行孵育,室温2 h。紧接着加入100 µL辣根过氧化物酶(HRP)标记溶液进行孵育,室温避光20 min。再加入100 µL 底物液进行孵育,室温避光20 min,孵育结束后加入50 µL 终止液。将孔板放入酶标仪中,波长设置为450 nm 和570 nm,测定完毕后保存光密度值(OD 值)。纵坐标为OD 值,横坐标为浓度进行作图,计算相应样品的浓度。
1.2.5 实时定量荧光聚合酶链反应(Real-time PCR)用TRIZOL 法抽提ATC 细胞总RNA,逆转录合成为cDNA,设计合成磷酸甘油醛脱氢酶(GAPDH)及TGFβ1 引物,△Ct 法计算目的基因表达差异。Real-time PCR 体系(共10 µL)组成:1 µL cDNA、1 µL 2.5 µmol 上下游引物、3 µL ddH2O、5 µL SYBR qPCR SuperMix。引物序 列:GAPDH Sense 5′-CTCCTCCTGTTCGACAGTCA GC-3′,Anti-sense 5′-CCCAATACGACCAAA TCCGTT-3′;TGFβ1 Sense 5′-GGCCAGATCCT GTCCAAGC-3′,Anti-sense 5′-GTGGGTTTCC ACCATTAGCAC-3′配置完毕后即可上机,按说明书步骤设置程序:95 ℃预变性5 min 95 ℃变性15 s;60 ℃退火与延伸 30 s;95 ℃ 15 s;60 ℃1 min;95 ℃ 3 min.结果判定:目的基因的相对表达量(relative expression)=2-△Ct。△Ct=目的基因Ct 值的均数-内参基因的Ct 值。
1.2.6 蛋白质免疫印迹杂交(Western blot)首先提取总蛋白,用BCA 蛋白质测定法检测蛋白质浓度。随后配置9%的 SDS-PAGE 凝胶,将蛋白样品按照每孔30 µg 进行上样,电泳完毕后进行转膜,用250 mA 电流于冰上转膜2.5 h。用5%脱脂牛奶进行封闭,室温1 h,封闭完成后1×TBST 洗3 次,每次洗5 min,然后孵育一抗[fibronectin(1∶1 000)、snail(1∶1 000)、a-catenin(1∶2 000)、GAPDH(1∶4 000)、E-cadherin(1∶1 000)],4 ℃过夜,一抗孵育完毕后用1×TBST洗3 次,每次洗10 min,然后孵育二抗,室温1 h,二抗孵育完毕后用1×TBST 洗3 次,每次洗10 min。最后,用化学发光底物试剂盒(ECL)进行发光成像。Image J 软件进行灰度分析。
1.3 统计学处理
SPSS 19.0 软件包统计分析实验数据。均值比较采用t检验,P< 0.05 认为差异有统计学意义。
2 结果
2.1 PLT 诱导ATC 细胞发生EMT
为了研究PLT 对ATC 细胞形态变化及功能的影响,用从健康人外周静脉血提取的PLT 与ATC细胞(FRO、SW579)共培养48 h,加入10 倍数量的PLT 后,在显微镜下观察ATC 细胞的形态,结果发现ATC 细胞发生了EMT 样变化,见图1A。进一步通过Western Blot 实验检测EMT 相关蛋白的表达,发现PLT 可诱导ATC 细胞表达更多的间叶标记蛋白(fibronectin 和snail),证实PLT 可诱导ATC 细胞发生EMT。
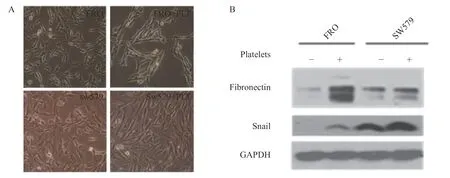
图1 PLT 诱导ATC 细胞发生EMTFig. 1 Platelets induce epithelial mesenchymal transition in ATC cells
2.2 与ATC 细胞共培养促进PLT 分泌TGFβ1
将PLT 与ATC 细 胞(ARO、FRO 或SW579)共培养36 h,Real-time PCR 检测共培养液中TGFβ1 mRNA 未见显著增高(ARO 细胞甚至降低)(P< 0.01),而Elisa 检测发 现共培 养液中TGFβ1 蛋白水平显著升高(P< 0.001)(FRO 细胞最显著),提示TGFβ1 蛋白可能主要来源于PLT释放,而非PLT 合成,见图2。

图2 PLT 与ATC 细胞共培养后TGFβ1 的表达情况Fig. 2 Expression of TGFβ1 after co-culture PLT and ATC cells
2.3 TGFβ1 促进ATC 细胞的迁移能力
为探索TGFβ1 对ATC 细胞的影响,将SW579 细胞与PLT 共培养8 h,或在ATC 细胞中直接加入rhTGFβ1(1 ng/mL)8 h 后,Transwell 迁移实验显示,PLT 或rhTGFβ1 可使穿过小室的ATC 细胞显 著增加(P< 0.001),提 示PLT 或rhTGFβ1 能显著增强SW579 细胞的迁移能力(P< 0.001),见图3A。同样,划痕实验也证实rhTGFβ1 可显著增强SW579 细胞的迁移能力(P< 0.01),见图3B。
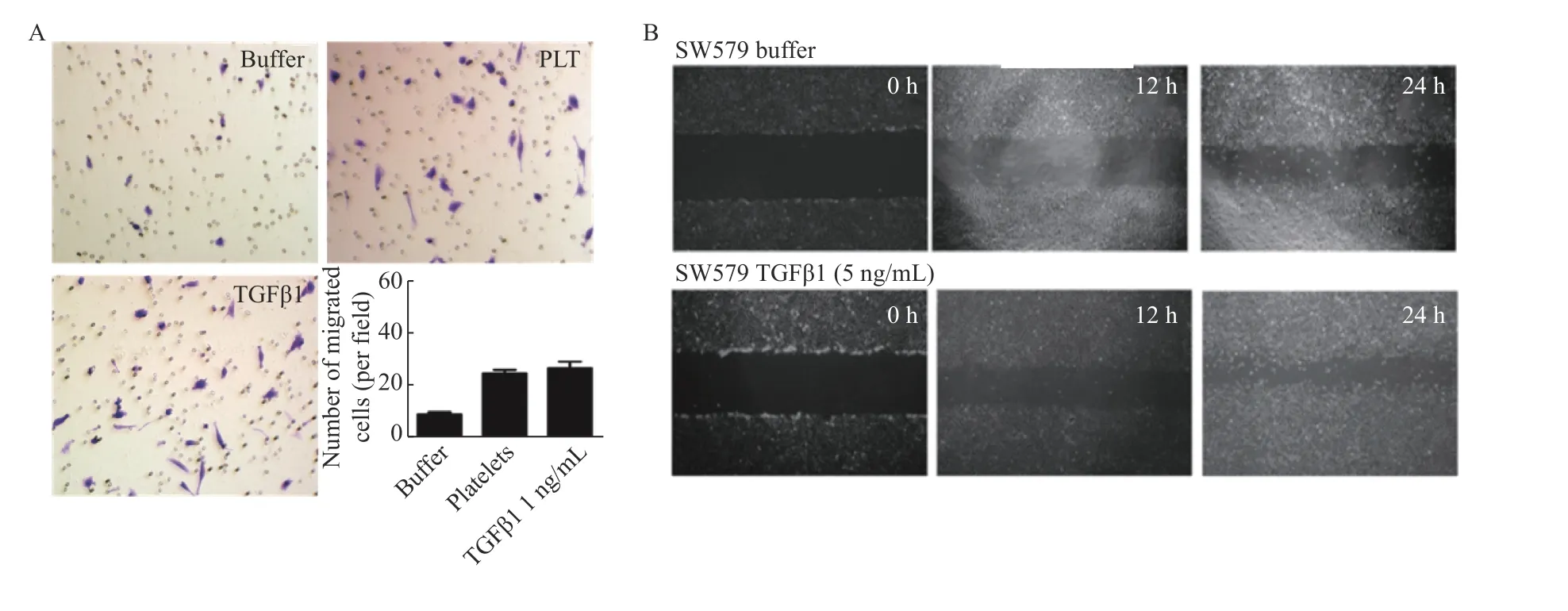
图3 rhTGFβ1 促进SW579 细胞迁移能力增强Fig. 3 rhTGFβ1 promotes the migratory ability of SW579 cells
2.4 PLT 通过TGFβ1 促进ATC 细胞发生EMT
用PLT 或rhTGFβ1 处理SW579 细胞发现,间叶标记物fibronectin 增高而上皮标记物αcatenin 下降,见图4A,提示PLT 可能通过分泌TGFβ1 促进ATC 细胞发生EMT;为了检测PLT是否分泌其他常见细胞因子促进EMT 发生,用CSF1、IL-11 和TGFβ1 分别处理ARO 细胞发现,只有TGFβ1 诱导间叶标记物fibronectin 上调和上皮标记物E-cadherin 下调,见图4B,提示PLT 可能通过释放TGFβ1 诱导ATC 细胞发生EMT 最终促进其迁移能力。

图4 PLT 通过TGF β1 促进ATC 细胞发生EMTFig. 4 Platelets promote epithelial-mesenchymal transition in ATC cells through TGFβ1
3 讨论
ATC 恶性程度极高,近年来,尽管手术设备和技巧不断提高,放疗设备、方案不断创新,化疗联用方案、靶向治疗及免疫治疗不断推陈出新,但ATC 确诊后中位生存期一直在3~9 个月,1 a生存率不足20%;其高度恶性和极差的预后与其高侵袭转移能力密切相关[1-2]。另一方面,恶性肿瘤患者常出现特鲁索综合征,即肿瘤患者血栓形成增多和血液呈高凝的状态[6]。历史和最近的研究不断表明,PLT 增多与神经系统肿瘤、呼吸系统肿瘤、消化系统肿瘤以及妇科肿瘤患者更差的预后密切相关[3,4,6-8]。笔者在前期临床研究也发现,ATC 患者外周血PLT 增多与临床更差的预后相关[1],提示PLT 可能会促进ATC 细胞的转移潜力,然而其机制远不清楚。
在其他的实体肿瘤中研究发现,PLT 可通过多种机制促进肿瘤的侵袭与转移。比如,肿瘤细胞进入外周血后可诱导PLT 聚集并包裹肿瘤细胞,使循环肿瘤细胞免受NK 细胞和TNFα 诱导的细胞死亡;进一步的分子水平研究发现,肿瘤细胞可通过粘附分子p-选择素、GPIIb-IIIa(αIIbβ3整合素)以及C 型凝集素样受体(CLEC)-2 与肿瘤细胞来源的Podoplanin(平足蛋白)相互作用活化PLT,导致PLT 颗粒释放高浓度细胞因子,如ATP、PDGF、TGFβ1,协助肿瘤细胞粘附和外渗,最终促进肿瘤转移[3,7,9-12];类似研究也证实,阻断TGFβ1 或其受体显著降低乳腺癌肺转移[13-15],提示TGFβ1 可能与PLT 促进恶性肿瘤进展密切相关。为探索TGFβ1 是否在PLT 促进ATC 恶性进展中发挥作用,采用PLT 与ATC 细胞共培 养36 h,Real-time PCR 检 测TGFβ1 mRNA 未见显著增高,而Elisa 检测TGFβ1 蛋白水平显著升高,同时还发现TGFβ1、PLT 显著增强ATC 的迁移能力(图2、图3),因此笔者推测PLT 可能通过释放TGFβ1 最终促进ATC 的迁移和侵袭能力。
用PLT 处理ATC 细胞后采用Western blot 实验测定EMT 相关标记物发现,间叶标记物(fibronectin、snail)增高,提示PLT 可能诱导ATC细胞EMT 发生;同样采用TGFβ1 刺激SW579细胞发现,上皮标记物α-catenin 表达下降而间叶标记物fibronectin 增高。为检测PLT 是否也通过其常分泌的细胞因子促进ATC 细胞发生EMT,用CSF1、IL-11 处理ARO 细胞发现,二者均不能诱导上皮标记物E-cadherin 下调和间叶标记物fibronectin 上调,同时ATC 细胞经与PLT 共培养48 h 后,ATC 细胞形态朝间叶组织方向转化。所以,笔者认为ATC 细胞通过刺激PLT 释放TGFβ1,后者诱导ATC 细胞发生EMT 进而促进其侵袭和迁移能力。
综上所述,本研究提示,PLT 活化后可通过分泌TGFβ1 促进ATC 细胞发生EMT 进而促进ATC 细胞侵袭和迁移能力,提示TGFβ1 可能成为ATC 患者靶向治疗的潜在靶点,但上述研究结果仍需要包括体内实验在内的进一步证实。
