miR-582-5p 调控Notch1 减轻心肌缺血再灌注损伤的研究
2023-01-02钱佃伦王文杰冯科翔白向锋
王 峰 ,杨 伟 ,钱佃伦 ,梅 松 ,王文杰 ,冯科翔 ,白向锋
(1)昆明医科大学实验动物学部,云南 昆明 650500;2)昆明医科大学第一附属医院麻醉科;3)心脏外科,云南 昆明 650032)
急性的心肌梗死是一种危害人类健康的缺血性心肌疾病,急性心肌梗死是由冠状动脉的缺血和缺氧造成的,可导致心力衰竭、猝死等其他不良症状[1-2]。如今临床上多使用再灌注治疗的方法,因为其能促进血流迅速回流到心肌缺血区[3],虽然再灌注可以改善心肌功能,限制梗塞范围,很大程度的降低了死亡率,但是再灌注会对心肌带来其他的损伤,目前心肌缺血再灌注损伤的主要特征为心肌细胞死亡、微血管破坏及炎症等[4],此外还会导致心律失常和心肌梗死[5]。就目前针对心肌缺血再灌注损伤的有效干预方式很少,且治疗方法效果甚微,因此急需探讨心肌缺血再灌注损伤后病理过程中的分子机制,从而为临床治疗找到新的方向和靶点。
1 材料与方法
1.1 实验材料
1.1.1 动物、分组及细胞10 只SPF 级雌性C57小鼠(体重18~22 g)购买于昆明医科大学实验动物学部,所有实验方法和操作都得到昆明医科大学动物伦理委员会的批准(kmmu20220575)。实验小鼠可以自由的选择食物和水,同时通风良好,将10 只小鼠随机性分为2 组,分别为假手术组和心肌缺血再灌注组,假手术组为打开胸腔不结扎左冠状动脉,心肌缺血再灌注组为打开胸腔用6-0 缝合线结扎冠状动脉制造心肌缺血再灌注模型。小鼠心肌细胞(HL-1)购买于赛百慷生物技术股份有限公司(上海)。
1.1.2 实验试剂CCK-8 细胞活力检测试剂盒购自兰杰柯科技有限公司(Biosharp),胎牛血清(FBS)和高糖基础培养基(DMEM/High Glucose 1X)购自以色列生物科技公司(BI),双抗(PS)和0.25%胰蛋白酶(TP)购自赛默飞世尔科技公司(Gibco),无水乙醇、氯仿、异丙醇购自天津飞船有限公司,逆转录试剂盒(Bester qPCR RT Kit gDNA Remover)和qPCR 扩增试剂盒(Bester Sybr Green qPCR Master Mix)购自上海星汉生物科技有限公司(DBI),Notch1 和β-actin 抗体购自万类生物。
1.1.3 实验仪器呼吸机(小动物使用)购自上海赞德医疗器械有限公司,高速低温离心机、酶标仪和荧光定量PCR 仪购自美国伯乐公司(Bio-Rad),雪花制冰机购自常熟雪科有限公司,超净工作台购自苏州冯氏有限公司,细胞恒温培养箱购自赛默飞世尔科技公司(Thermo)。
1.2 实验方法
1.2.1 HL-1 细胞培养HL-1 细胞放置于25 cm3的细胞培养瓶中培养,在配置好的 89% DMEM 高糖、10% FBS 和 1% PS(双抗)的完全培养基中生长,将HL-1 细胞悬液加入到含完全培养基的细胞培养瓶中,并置于37 ℃恒温培养箱中培养。
1.2.2 OGD 模型构建将原先HL-1 细胞的完全培养基(89% DMEM 高糖+10% FBS+1% PS)更换为DMEM 的无糖培养基并放于恒温培养箱内以5% O2、95%N2的条件进行培养12 h,而后把DMEM 无糖培养基再更换为原先使用的完全培养基,继续培养2 h 后收集细胞。
1.2.3 miR-582-5p 的 Mimics 和 Inhibitor 转染将HL-1 细胞接种至6 孔板中,根据转染试剂说明 书(ribo FECTTMCP)将miR-582-5p 的Mimics、mimics NC、Inhibitor 和inhibitor NC 转染至6 孔板中,在37 ℃的细胞培养箱中培养至48 h 收集细胞。
1.2.4 CCK-8 实验将HL-1 细胞接种到 96 孔板上。根据分组对每孔进行miR-582-5pmimics和Inhibitor 的转染,保持每孔总体积一样,转染48 h 后使用倒置显微镜来观察细胞状态,随后用电脑拍照保存。在显微镜拍照后,往每孔加入10 µL 的CCK-8 检测试剂,置于 37 ℃细胞恒温培养箱中继续孵育4 h,使用酶标仪检测450 nm处的OD 值,导出数据分析细胞活力。
1.2.5 MIR 小鼠模型构建在手术开始前对手术室进行紫外线杀菌30 min 以上,整个手术过程保持在无菌环境下。10 只SPF 级小鼠在术前均禁食24 h,给予正常的饮水,在手术前对随机分组的小鼠进行称重、编号和标记。模型制作参考董鑫法[6],使用0.5%戊巴比妥钠对小鼠进行麻醉(浓度为50 mg/kg),将呼吸机和心电图机与小鼠连接上,使用推子将小鼠胸部位毛发剔除,碘伏消毒。从胸部左边依次打开皮肤、各层肌肉组织,钝性分离3 和4 肋间的肌肉组织,将心脏充分暴露出来同时打开心包,从左心耳下方位置使用缝合线从冠状动脉左前降支(left anterior decending branch,LAD)下方穿出,然后收缩手术结,将会看到心脏缺血部位开始发白,此外心电图上ST段显著抬高,表明MRI 小鼠模型构建成功。45 min后解除结扎线恢复血供2 h,待心前区重新变为红色表明再灌注成功。
1.2.6 qPCR 实验取小鼠的心脏缺血部位和对照组同样部位心脏组织,用qPCR 方法验证了miR-582-5p 和Notch1 的表达。从Pubmed 中获取miR-582-5p、Notch1 及内参U6、GAPDH 的核酸序列,利用Primer Premier 5 软件设计并合成,具体序列,见表1。对收集的小鼠心脏组织利用Trizol 进行裂解,按照试剂盒说明书Rnaiso plus提取小鼠心脏组织的总RNA。使用酶标仪进行总RNA 浓度和纯度的测量,根据试剂说明书Bester qPCR RT Kit gDNA Remover 进行逆转录操作,并根据试剂说明书Bester Sybr Green qPCR Master Mix(95 ℃/10 s,58 ℃/30 s,72 ℃/30 s,共40 次循环)进行荧光定量PCR 反应,最后根据公式2-△△CT来计算相对表达量。
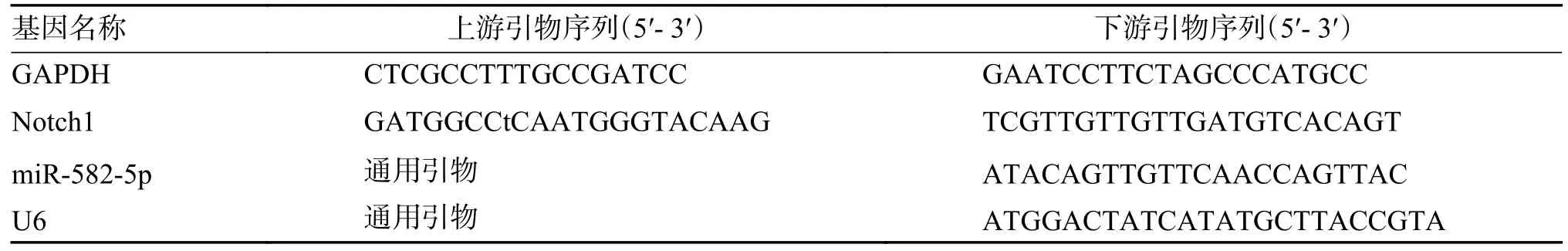
表1 引物序列Tab.1 Primer sequence
1.2.7 Western blot 实验加入RIPA 裂解液与蛋白酶抑制剂鸡尾酒片混合后,匀浆、超声提取样品总蛋白。BCA 法定量蛋白后,加入上样缓冲液,煮沸变性。取60 µg 总蛋白上样,PAGE 胶分离后15 V,30 min 将蛋白转印到PVDF 膜。将PVDF 于5%脱脂牛奶中封闭2 h。弃去牛奶,加入TBST 稀释好的一抗(Notch1:1∶1 000;βactin:1∶5 000)4 ℃过夜。TBST 漂洗后孵育二抗(goat-anti-rabbit,1∶2 000)室温轻摇2 h。TBST漂洗后HRP-ECL 法发光,使用Geldoc 凝胶成像分析仪,BIO-RAD 采集图片,Image J 测量灰度,β-actin 为内参。
1.3 统计学处理
使用IBM SPSS Statistics 21 软件进行统计处理,2 组之间分析比较使用独立样本t检验,3 组及以上分析比较使用单因素方差分析,P< 0.05表示差异有统计学意义。
2 结果
2.1 MIR 后心肌组织中和OGD 后心肌细胞中miR-582-5p 上调和Notch1 下调
使用qPCR 对miR-582-5p 和Notch1 在心肌缺血再灌注小鼠和HL-1 细胞OGD 模型中的表达量进行检测,与对照组相比,发现miR-582-5p在小鼠缺血心脏组织和OGD 细胞中都明显异常升高,见图1A、图1B;而Notch1 却明显表达下降,见图1C、图1D。
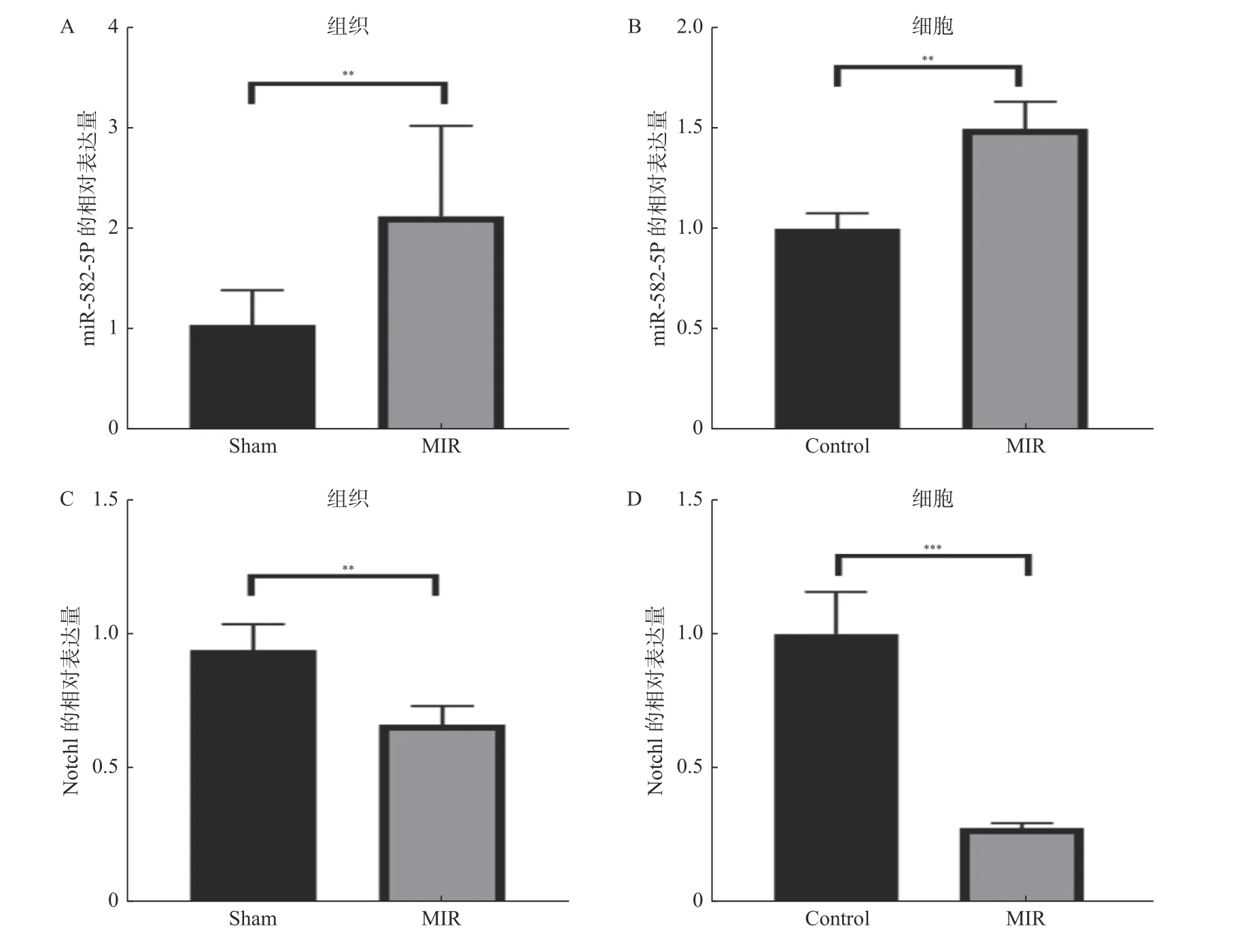
图1 miR-582-5p 和Notch1 在心肌缺血再灌注小鼠心脏组织和HL-1 细胞OGD 模型中的表达Fig. 1 Expression of miR-582-5p and Notch 1 in cardiac tissue and HL-1 cell OGD model of myocardial ischemia-reperfusion mice
2.2 miR-582-5p 可调控Notch1 的表达
通过TargetScan 网站(https://www.targetscan.org/vert_72/)对miR-582-5p 与Notch1 的靶向结合位点进行预测,结果显示miR-582-5p 与Notch1 可以靶向结合,结合位点共有7 对碱基,见图2A。在HL-1 细胞中转染miR-582-5p 的Inhibitor 和Mimics,与NC 组相比,结果表示Inhibitor 能够显著降低miR-582-5p 在HL-1 细胞中的表达水平,Mimics 能明显提高miR-582-5p 在HL-1 细胞中的表达,见图2B。于是同时用PCR 和WB检测了Notch1 的表达水平,与NC 组相比,miR-582-5p 的Inhibitor 转染后,Notch1 的表达明显上调,Mimics 转染后,Notch1 的表达却明显降低,见图2C、图2D 和图2E,发现无论是在mRNA水平还是蛋白水平,Notch1 都受到了影响。
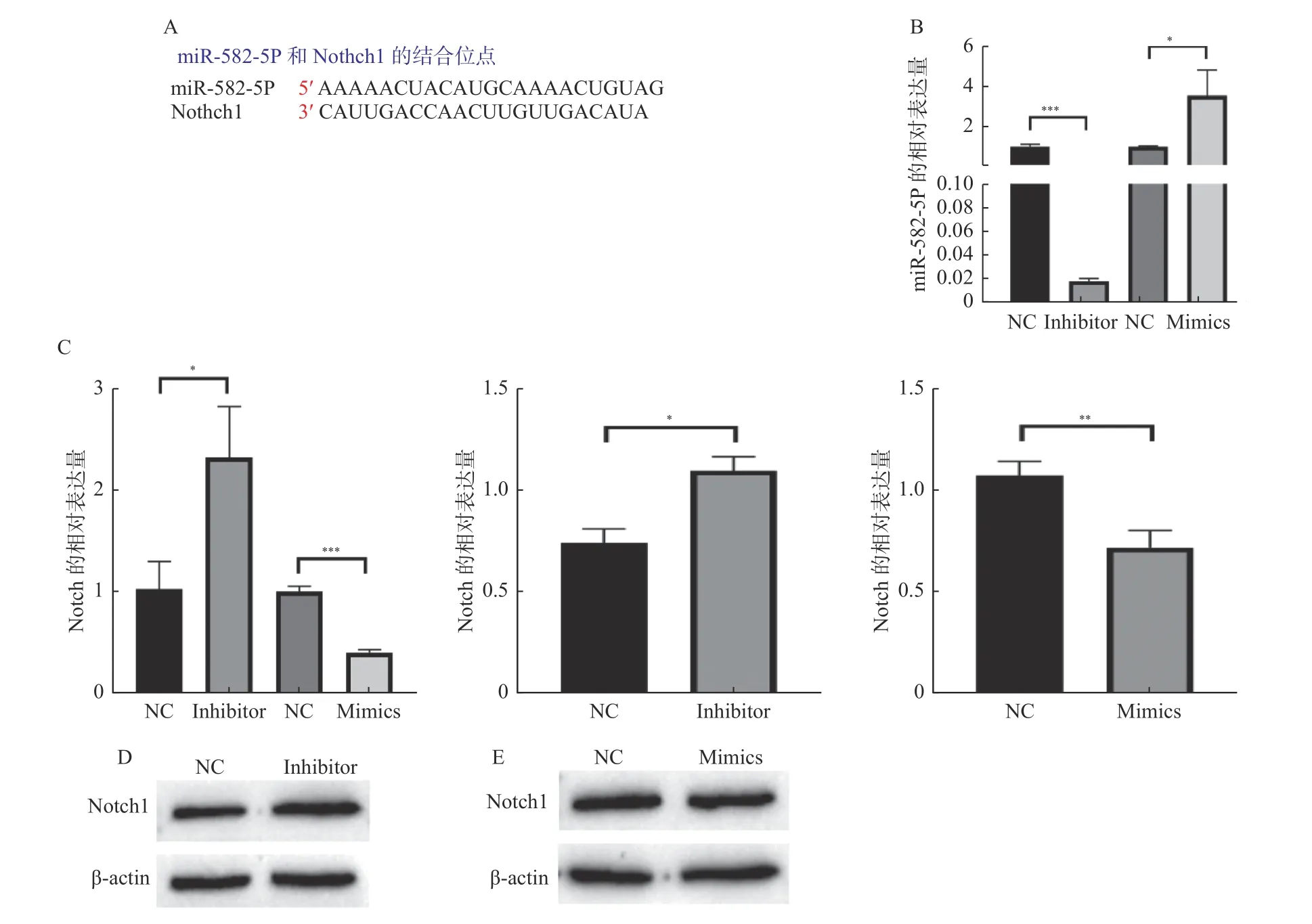
图2 miR-582-5p 可靶向Notch1 并调控其表达Fig. 2 miR-582-5p targets Notch 1 and regulates its expression
2.3 上调Notch1 可保护心肌细胞
使用CCK-8 检测了转染miR-582-5p 的Inhibitor 和Mimics 后的HL-1 细胞活力,结果显示与NC 组相比,转染Inhibitor 后细胞活力明显升高,此外转染Mimics 后细胞活力有大幅的下降,见图3A;同样在HL-1 细胞OGD 模型后复氧转染Inhibitor 和Mimics 检测细胞活力,得到了与其一致的结果,见图3B。这表明miR-582-5p 被抑制后,Notch1 表达上调后对心肌细胞产生了保护作用。
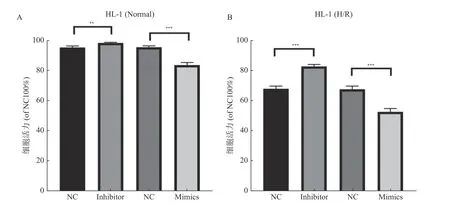
图3 HL-1 细胞活力的检测Fig. 3 Detection of HL-1 cell viability
3 讨论
心肌缺血再灌注损伤具有非常复杂的病理生理机制,在心脏病上带来的负担由来已久,同样影响深远[7]。目前,有许多研究发现在病理损伤、组织损伤或者生理刺激下都存在miRNA 的异常表达[8-9],越来越多的报道证实miRNA 参与了这些疾病的发生发展[10],当然在心肌缺血再灌注损伤损伤中miRNA 也发挥了重要的调节作用[11-12]。此外,诸多研究表明miR-582-5p 在肿瘤发生发展[13]、新生儿缺血缺氧性脑病[14]和缺血性脑卒中[15]担任着重要角色,但是miR-582-5p 在心肌缺血再灌注损伤中的作用研究却很少,这就需要去探究其在心肌缺血再灌注中发挥的作用。本研究发现miR-582-5p 在小鼠心肌缺血再灌注损伤后,表达升高,并且在小鼠HL-1 细胞OGD 模型复氧后表达也异常升高。此外,在降低其在HL-1 细胞中的表达后发现,无论是正常HL-1 细胞还是HR 后的HL-1 细胞,细胞活力都明显提高,这表明其对心肌缺血再灌注损伤有潜在的危害。
Notch1 是异二聚体跨膜受体Notch 家族中的一员,具有调节细胞分化、增殖、凋亡和发育的功能[16-18]。目前,许多研究表明激活Notch1 可以减轻MIR 带来的氧化应激和自噬等[19-20],从而改善心肌缺血再灌注损伤并且保护心肌细胞[20]。本研究发现miR-582-5p 可以调控Notch1 的表达,在miR-582-5p 被抑制后,Notch1 的表达显著升高,有趣的是HL-1 细胞的活力因此明显提高,这表明Notch1 可以有效的保护心肌细胞从而来对抗缺血缺氧造成的损伤。
本研究初步证实了miR-582-5p 介导Notch1在心肌缺血再灌注损伤中对心肌细胞的保护作用,结果表明miR-582-5p 表达的抑制可以有效的提高心肌细胞的活力,这是通过调控Notch1 来实现的。本研究从microRNA 水平揭示了心肌缺血再灌注损伤的分子机制,找到了其可能调控的下游分子,提示了miR-582-5p 和Notch1 在治疗心肌缺血再灌注损伤中的潜在价值。
