姜黄素对肺癌细胞TFPI-2基因去甲基化作用研究*
2022-12-18梁莹吴西雅肖祖克
梁莹,吴西雅,肖祖克
江西省人民医院,江西 南昌 330000
肺癌系呼吸道恶性肿瘤,发病率及死亡率均处于第1位,现已成为全球主要健康问题[1]。据相关研究报道显示,肺癌每年新发病例超210万,且死亡人数超180万[2],而1/3新发病例和2/5死亡病例均来自中国,且近几年来发病率有上升趋势[3]。目前,肺癌治疗以放化疗手段为主,虽可较好改善患者生存质量,但5年生存期仍较低。随着基因组时代及分子生物学的发展,表观遗传学已成为癌症研究的新热点,其调控机制包括DNA甲基化、非编码RNA表达及组蛋白修饰等,其中DNA甲基化与肿瘤发生、进展密切相关[4]。经癌症基因组图谱(the cancer genome atlas,TCGA)数据库筛选肺癌基因发现,组织因子途径抑制物-2(tissue factor pathway inhibitor-2,TFPI-2)启动子区异常甲基化可导致TFPI-2表达下降,促进肺癌细胞生长、浸润及转移[5-6]。而启动子异常甲基化于肿瘤早期或癌前便已出现,可较好预测肿瘤发生,具有较高特异性,基于此机制研发的靶向药物5-氮杂-2′-脱氧胞苷(5-Aza-2′-deoxycytidine,5-Aza-CdR)经美国食品药品监督管理局(food and drug administration,FDA)批准上市且推荐用于骨髓异常增生类疾病治疗。近年来研究发现,5-Aza-CdR在结肠癌[7]、口腔鳞状细胞癌[8]、胰腺癌[9]及肺癌[10]等实体瘤治疗中亦可发挥作用,但同样也发现5-Aza-CdR具有不良反应,可引起严重的胃肠道反应及骨髓抑制等。研究表明,从莪术、姜黄等中草药中提取出来的姜黄素可通过抑制肿瘤细胞增殖、血管生成、转移及抗炎等多途径发挥抗肿瘤作用,且可调控DNA甲基化,但相关机制尚未阐明[11-13]。基于此,本文以TFPI-2及DNA甲基转移酶1(DNA methyltransferase 1,DNMT1)、DNMT3a、DNMT3b等为切入点探讨姜黄素对TFPI-2基因甲基化的作用。
1 材料
1.1 细胞人肺腺癌A549细胞株,由中国科学院上海细胞生物学研究所提供,货号:ZQ0003。
1.2 药物与试剂姜黄素(美国Sigma公司,批号:C1386-10G);DMEM培养基(美国Thermo fisher scientific公司,货号:11966025);MagicPure®Cell-Free DNA Kit II(含Magnetic Stand) DNA提取试剂盒、MagicPure®Simple Viral DNA/RNA Kit(含Magnetic Stand)RNA提取试剂盒、PerfectStart®Taq DNA Polymerase(含2.5 mM dNTPs)扩增试剂盒(北京全式金生物技术有限公司,货号:EC211、EC311、AP401);引物合成委托美国Invitrogen公司完成。
1.3 仪器Applied Biosystems Veriti型PCR仪(美国Thermo fisher scientific公司);Ts2型倒置相差显微镜(日本NIKON公司);MDF-382E(N)型-86 ℃超低温冰箱(日本SANYO公司);3-18KS型低温高速离心机(德国Sigma公司,离心半径:16 cm);Gel Dox XR型凝胶成像系统(美国BIO-RAD公司);SW-CJ-2F型超净工作台(苏州净化设备有限公司)。
2 方法
2.1 细胞培养、分组及干预将含细胞的冻存管投入37 ℃水温箱中迅速解冻,自主晃动待其完全融化后转移细胞悬液至含10%胎牛血清的DMEM培养基中,混匀后1 000 r·min-1离心5 min,弃上清后将其接种于细胞培养瓶中,置于37 ℃、5%CO2培养箱中培养,待80%~90%细胞贴壁生长时,弃除旧培养液,采用PBS缓冲液冲洗细胞,并用0.25%胰酶消化后进行观察,当发现细胞质浓缩、圆润时添加 2 mL 培养基。将贴壁细胞作离心处理后,将1个培养瓶中的白色沉淀细胞均匀接种至3个新的培养瓶中并放于37 ℃、5%CO2培养箱中传代培养,取长势良好的对数生长期细胞,于37 ℃、5%CO2培养箱中培养24 h后,将细胞分别设置为姜黄素低剂量组、姜黄素中剂量组、姜黄素高剂量组及空白对照组。空白对照组细胞采用30 mL完全培养液进行培养,姜黄素各剂量组分别采用30 mL含20 μmol·L-1、40 μmol·L-1及80 μmol·L-1的培养液进行培养,24 h后弃除培养液,用PBS缓冲液冲洗细胞,收集处理后的A549细胞以待进一步实验。
2.2 MTT法检测A549细胞的增殖情况将2.1项下处理后的A549细胞依次加入96孔板内,细胞密度为4×104mL,每孔接种200 μL,设置3个复孔,置于37 ℃、5%CO2培养箱中继续培养24 h,加入10 μL MTT试剂,培养4 h后每孔加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO)培养15 min,使用振荡器震荡10 min使其充分混匀,采用酶标仪检测各孔490 nm处光密度(optical density,OD)值,计算细胞抑制率。实验重复进行3次,取平均值。
细胞抑制率=(OD空白对照组-OD处理组)/OD空白对照组×100%
2.3 RT-PCR检测TFPI-2、DNMT1、DNMT3a、DNMT3b的mRNA表达水平使用RNA提取试剂盒将2.1项下处理后的A549细胞总RNA提取出来,以1 μg RNA为模板,使用逆转录试剂逆转录合成cDNA,采取相应引物进行扩增。反应循环条件:95 ℃预变性5 min后,每周期:95 ℃变性30 s,55 ℃退火20 s,72 ℃延伸20 s,共计循环40周期。对特异性曲线进行分析,以目的基因与内参基因的OD值分析TFPI-2、DNMT1、DNMT3a、DNMT3b的mRNA相对表达情况,以2-△△Ct表示,实验重复进行3次,取均值。引物序列见表1。

表1 RT-PCR引物序列
2.4 甲基化特异性PCR(methylation-specific PCR,MSP)法检测TFPI-2基因甲基化状态使用DNA提取试剂盒提取2.1项下处理后的A549细胞中的DNA,以2 μg DNA为模板,使用重亚硫酸盐处理,按说明书规范操作进行DNA纯化,而后进行甲基化特异性扩增。反应体系:PCR buffer 2.0 μL,上、下游引物各0.2 μL,dNTP Mixture(2.5 mmol·L-1)1.6 μL,Taq酶0.1 μL,DNA模板2 μL,三蒸水 13.9 μL,共20 μL。反应循环条件:95 ℃ 预变性 5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸 45 s,共计35个循环。取5 μL扩增产物行琼脂糖凝胶电泳,采用溴化乙锭染色,并用凝胶成像系统拍照并分析。以人类胎盘组织DNA经甲基化酶SssI转化后产物作为甲基化的阳性对照,健康人淋巴细胞DNA作为阴性对照,双蒸水作为空白对照。引物序列见表2。

表2 MSP引物序列
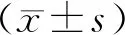
3 结果
3.1 姜黄素对A549细胞增殖情况的影响随姜黄素浓度升高、干预时间延长,A549细胞OD值呈下降趋势,于浓度40 μmol·L-1且处理细胞48 h时OD值为最低,与空白对照组比较,差异有统计学意义(P<0.05)。细胞抑制率结果显示:各剂量姜黄素处理细胞12 h、24 h及48 h后均可抑制细胞增殖。见表3、图1。
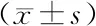
表3 姜黄素对A549细胞增殖情况的影响
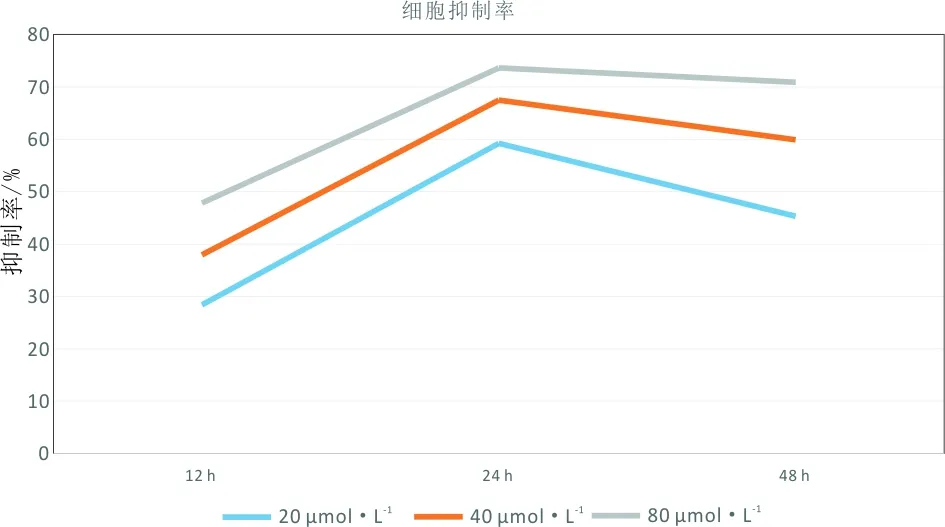
图1 各组A549细胞抑制率变化
3.2 姜黄素对TFPI-2mRNA、DNMT1mRNA、DNMT3amRNA、DNMT3bmRNA相对表达情况的影响与空白对照组比较,姜黄素各剂量组TFPI-2mRNA相对表达水平升高,DNMT1、DNMT3a、DNMT3b的mRNA相对表达水平降低,差异均具有统计学意义(P<0.05)。见表4。
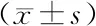
表4 姜黄素对TFPI-2 mRNA、DNMT1 mRNA、DNMT3a mRNA、DNMT3b mRNA相对表达情况的影响
3.3 姜黄素对TFPI-2甲基化的影响空白对照组未显示甲基化及去甲基化产物,阴性对照组仅显示去甲基化产物,阳性对照组仅显示甲基化产物,姜黄素各剂量组除显示甲基化产物外,亦可见去甲基化产物,尤以姜黄素中剂量组去甲基化产物条带最为明显。见图2。

注:m:甲基化产物;u:去甲基化产物;0:空白对照组;1:阴性对照组;2:阳性对照组;3:姜黄素低剂量组;4:姜黄素中剂量组;5:姜黄素高剂量组
4 讨论
TFPI-2已被证实为一类抑癌基因,可通过以下机制抑制肿瘤生长、浸润及转移[14]:①TFPI-2通过抑制MMPs在内的蛋白酶活性阻断ECM重塑,进而维持ECM结构完整性;②上调Fas-α、TNF-α表达使Caspase-3、Caspase-9凋亡通路活性增强,进而诱使细胞凋亡发挥抗肿瘤效果;③拮抗组织因子阻断血管生成。当肺癌发生后,TFPI-2基因启动子区的CpG岛(鸟嘌呤和胞嘧啶的富集区)甲基化使TFPI-2基因表达下降或者缺失,进而引起肿瘤浸润及转移。姜黄素是从中药姜黄、莪术等中药中提取出来的一类酸性多酚类物质,具有广泛药理作用,譬如抗凝、降脂、抗炎、抗肿瘤等,且有研究发现,姜黄素可通过抑制DNMT1甲基转移酶导致多种基因低甲基化[15]。He等[16]研究证实,姜黄素可抑制非小细胞肺癌中DNMT1、DNMT3a、DNMT3b等甲基转移酶的活性。此外,研究表明,5-Aza-CdR可通过与DNA甲基转移酶共价结合使其活性受到抑制,进而使TFPI-2基因异常甲基化得以逆转[17]。基于此,本研究探讨姜黄素是否可通过抑制DNMT1、DNMT3a、DNMT3b等甲基转移酶活性来抑制TFPI-2基因甲基化,进而抑制A549细胞增殖。结果显示:经不同浓度姜黄素处理后,A549细胞OD值均有所下降,可见姜黄素可对A549细胞增殖产生抑制作用,且与浓度、时间有一定依赖性,其中浓度40 μmol·L-1的姜黄素处理细胞48 h时抑制率最高,可见姜黄素对A549细胞的增殖抑制作用与浓度不呈线性依赖,这与陈馨等[18]认为姜黄素浓度在40~60 μmol·L-1时可发挥良好去甲基化效应有一定类似。
DNA甲基化主要由DNMT催化,目前已知的DNMT包括DNMT1、DNMT3a、DNMT3b,其中DNMT1可参与新合成单链DNA甲基化,并将甲基化信息传递给子代细胞,DNMT3a、DNMT3b则负责胚胎时期的DNA甲基化。已有研究证实,DNMT在细胞周期G0/G1期表达异常,可沉默抑癌基因,使阻断信号消除,促进肿瘤发生、进展。因此,寻找一种可抑制DNMT活性的药物逆转抑癌基因沉默,可能为治疗肺癌的新兴靶点。而姜黄素已被证实可激活NRF2、WIF-1、PTEN等抑癌基因启动子区DNA去甲基化过程[19]。现深入探讨姜黄素对影响肺癌TFPI-2基因甲基化的DNMT1、DNMT3a、DNMT3b的作用,结果显示,与空白对照组比较,不同剂量姜黄素组TFPI-2mRNA相对表达水平均升高,而DNMT1、DNMT3a、DNMT3b等甲基转移酶的mRNA相对表达水平则下降,提示不同浓度姜黄素处理均可通过抑制DNMT1、DNMT3a、DNMT3b等甲基转移酶活性(主要为DNMT1)促进肺癌细胞TFPI-2基因表达,逆转TFPI-2基因的DNA甲基化,且从TFPI-2基因甲基化状态亦可准确反映姜黄素对肺癌细胞去甲基化作用。肖海励等[20]研究认为,DNMT1、DNMT3a、DNMT3b等具备活性的DNA甲基转移酶可参与DNA甲基化并维持过程,且在正常细胞中呈现共同表达的形式,进一步佐证本研究的正确性。研究发现,DNMT可升高癌细胞ROS水平引发线粒体和核DNA损伤发挥抗癌作用,且可通过P53-P21/GADD45A-cyclin/细胞周期蛋白依赖性激酶(cyclin-dependent kinases,CDK)-Rb/E2F-DNMT1轴介导去甲基化作用。而姜黄素与DNMT巯基共价结合使得转移位点减少,从而对甲基化转移及修饰产生阻碍,进而取得去甲基化作用[21-25]。Cao等[26]研究表明,赖氨酸特异性去甲基化酶2(histone lysine specific demethylase 2,LSD2)可通过调节TFPI-2表达促进小细胞肺癌增殖。
综上所述,姜黄素可通过抑制DNMT1、DNMT3a、DNMT3b等甲基转移酶活性来抑制TFPI-2基因甲基化,进而抑制A549细胞增殖,且浓度为 40 μmol·L-1时抑制效果最佳。该研究为后续肺癌临床治疗方案制定提供参考,但尚有以下不足,即体外肿瘤状态与体内有所差异,因而姜黄素去甲基化作用还有待更多研究支持。且姜黄素生物利用度低,稳定性差,机体代谢迅速等缺点可影响临床应用,应着眼研究稳定性更高的姜黄素系列衍生物的去甲基化作用,以使姜黄素成为肺癌治疗的可靠靶向药物。
