SIX4和miR-103a-3p在胆囊癌组织中的表达及其对胆囊癌细胞增殖和侵袭的影响
2022-10-31陈超李俊霖朱朝庚
陈超,李俊霖,朱朝庚
(1.永州市中心医院 肝胆外科,湖南 永州 425100;2.湖南中医药大学第一附属医院 肝胆外科,湖南长沙 410021)
胆囊癌作为胆囊上皮恶性肿瘤,约占全部胆道肿瘤的2/3,与其他消化道肿瘤相比,胆囊癌起病隐匿,但早期已通过淋巴结、血液扩散转移,危害严重[1]。多数胆囊癌患者在发现时已至晚期,因此尽早发现与胆囊癌有关的因子,对于治疗具有重要意义。微小RNA(microRNA,miRNA)作为过度保守的短链非编码RNA,在肿瘤中通过靶向目标基因的转录或翻译,进而调控癌症发展[2]。研究显示,miR-103a-3p在不同癌细胞中的作用不同,在前列腺癌中抑制癌症进展,而在结直肠癌中促进癌症进展[3-4]。目前有关miR-103a-3p在胆囊癌中的作用尚未见相关研究。SIX同源盒蛋白4(SIX homeobox 4,SIX4)的表达异常参与了肿瘤的发生、发展过程,增强多种类型肿瘤的增殖、侵袭和转移,同时SIX4亦是多种miRNA的靶基因[5-7],但SIX4 在胆囊癌中的功能尚不清楚。本研究旨在了解胆囊癌组织中miR-103a-3p、SIX4的表达情况,观察过表达miR-103a-3p对胆囊癌细胞SIX4表达及癌细胞增殖、侵袭的影响,初步探讨其机制,以期为胆囊癌的靶向治疗提供一定参考。
1 材料和方法
1.1 研究对象
组织:胆囊癌组织及癌旁组织(距离癌组织>2 cm)取自永州市中心医院2019 年10 月至2021 年9 月32 例接受手术治疗的胆囊癌患者,患者术前均未接受化疗等抗肿瘤治疗。从癌症体细胞突变目录(COSMIC)数据库(https://cancer.sanger.ac.uk/cosmic)中下载胆囊癌组织样本数据,包括样本的基本信息和病理数据。
细胞:胆囊癌细胞系GBC-SD购自北纳生物(产品编号:BNCC341817)。
1.2 试剂与仪器
引物由上海生工生物工程科技有限公司合成;SIX4 野生型(wild type,WT)、SIX4 突变型(mutant,MUT)、mimic NC、miR-103a-3p mimic、Lipofectamine®2000 试剂盒、pc DNA3.1 质粒、pc DNA3.1-SIX4 质粒均购自广州锐博生物公司;CCK-8试剂盒购自碧云天生物科技有限公司(货号:C0037);双荧光素酶报告基因检测试剂盒、一抗兔源SIX4、增殖细胞核相关抗原Ki-67、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、基质金属蛋白酶(matrix metalloproteinases,MMP)2、MMP9 以及内参GAPDH、二抗羊抗兔,均购自英国Abcam公司(货号分别为:ab228530、ab176713、ab16667、ab92552、ab92536、ab76003、ab9485、ab6721)。
实时荧光定量PCR(qRT-PCR)仪,美国Applied公司(型号:7500);蛋白凝胶成像系统,上海天能科技有限公司(型号:Tanon 5200);酶标仪,深圳汇松生物科技发展有限公司(型号:MB-530)。
1.3 实验方法
1.3.1 qRT-PCR检测组织中SIX4 mRNA、miR-103a-3p水平:胆囊癌组织以及对应癌旁组织分别取30 mg,冰上研磨充分,添加1 mL Trizol,提取组织中总RNA,分光光度计检测RNA浓度和纯度。RNA进行逆转录,qRT-PCR仪检测组织中SIX4、miR-103a-3p以及对应内参β-actin、U6。引物序列:SIX4 F:5’-TCTCGGGGTGATCGACAAGAA-3’,R:5’-CCC TTTGTTCATTCGTTCCTGG-3’;β-actin F:5’-CCTG GCACCCAGCACAAT-3’,R:5’-GCTGATCCACAT CTGCTGGAA-3’;miR-103a-3p F:5’-GAGCAGCAT TGTACAG-3’,R:5’-GTGCAGGGTCCGAGGT-3’;U6 F:5’-CTCGCTTCGGCAGCAGCACA-3’,R:5’-AACGCTTCACGAATTTGCGT-3’。反应条件:95 ℃、75 s;95 ℃、30 s,60 ℃、40 s,45个循环。2-ΔΔCT法对SIX4、miR-103a-3p表达水平进行定量分析。
1.3.2 双荧光素酶鉴定miR-103a-3p与SIX4的靶向关系:TargetScan数据库查找SIX4 mRNA的3’UTR与miR-103a-3p的结合位点。设计合成SIX4的3’UTR WT和3’UTR MUT(SIX4 3’UTR-WT、SIX4 3’UTRMUT),分别与miR-103a-3p mimic或mimic NC共转染GBC-SD细胞中,双荧光素酶报告基因检测试剂盒检测各组荧光素酶活性。
1.3.3 细胞培养及分组:GBC-SD细胞用10%胎牛血清的RPMI 1640培养液培养,将细胞置于37 ℃ 5%CO2培养箱中培养,每天观察细胞状态,在细胞密度85%左右传代,细胞传代3次进行实验。
实验分五组:对照组、mimic NC组、miR-103a-3p mimic组、miR-103a-3p mimic+pc DNA3.1 组、miR-103a-3p mimic+SIX4组。对照组GBC-SD细胞正常培养,mimic NC组GBC-SD细胞Lipofectamine®2000试剂盒转染50 nmol/L mimic NC,其余各组Lipofectamine®2000试剂盒转染50 nmol/L miR-103a-3p mimic,miR-103a-3p mimic组转染至正常培养GBCSD细胞,miR-103a-3p mimic+pc DNA3.1组转染至已经转染过pc DNA3.1空载体且稳定表达的GBC-SD细胞,miR-103a-3p mimic+SIX4组转染至已经转染过pc DNA3.1-SIX4质粒且稳定表达的GBC-SD细胞,转染6 h,更换为10%胎牛血清的RPMI 1640培养液继续培养48 h,进行后续研究。
1.3.4 qRT-PCR检测细胞中SIX4 mRNA、miR-103a-3p水平:“1.3.3”细胞处理后,加1 mL Trizol,提取总RNA,参考“1.3.1”检测细胞中SIX4 mRNA、miR-103a-3p水平。
1.3.5 蛋白印迹法检测细胞中SIX4蛋白水平:“1.3.3”细胞处理后,添加蛋白裂解液,冰上孵育10 min,12 000 r/min 4 ℃离心20 min,上清为总蛋白,BCA蛋白试剂盒对总蛋白浓度进行测定。25 μg蛋白上样,聚丙烯酰胺凝胶电泳分离蛋白质,蛋白转移至NC膜上,5%脱脂奶粉室温封闭2 h;添加SIX4、GAPDH一抗,置于4 ℃孵育过夜;洗涤后添加对应二抗,常温下孵育1 h。DAB显色试剂盒显色,蛋白凝胶成像系统拍照和定量分析。
1.3.6 CCK-8法检测细胞增殖情况:按照1.3.3处理细胞后,离心收集细胞,细胞浓度稀释成1×104个/mL,每孔100 μL接种于96孔板中,置于37 ℃、5% CO2培养箱中培养24 h,只添加培养液孔为空白组,培养相同时间,加入CCK-8试剂后继续培养2 h,酶标仪中450 nm处测定溶液吸光度(optical density,OD)值。
1.3.7 Transwell检测细胞侵袭情况:Transwell小室经基质胶包被后放入24 孔板中。按照“1.3.3”处理细胞后,离心收集细胞,细胞用单纯的RPMI 1640培养液稀释成5×103个/mL,每孔500 μL接种于Transwell小室上层,小室下层添加10%胎牛血清的RPMI 1640培养液,24孔板置于37 ℃、5% CO2培养箱中培养48 h,取出细胞,结晶紫染色5 min,蒸馏水清除背景色,显微镜下拍照并计数。
1.3.8 蛋白印迹法检测细胞中Ki-67、PCNA、MMP2、MMP9蛋白水平:按照“1.3.5”方法检测细胞中Ki-67、PCNA、MMP2、MMP9蛋白水平,一抗为Ki-67、PCNA、MMP2、MMP9、GAPDH。
1.4 统计学分析
统计学软件GraphPad 9.0 对数据进行分析。计量资料以()描述,两组间比较采用配对t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验;采用Person相关性分析检测SIX4与miR-103a-3p的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 胆囊癌及癌旁组织中SIX4 mRNA、miR-103a-3p表达情况
与癌旁组织相比,胆囊癌组织中SIX4 mRNA水平升高(t=21.795,P<0.001),miR-103a-3p水平降低(t=20.753,P<0.001),见图1。SIX4与miR-103a-3p表达呈负相关(r=-0.419,P=0.017),见图2。在癌症体细胞突变目录(COSMIC)数据库的168个胆囊癌样本中,SIX4 mRNA的平均水平为(2.87±0.64),miR-103a-3p的平均水平为(0.49±0.05);Person分析结果显示,SIX4与miR-103a-3p表达呈负相关(r=-0.154,P=0.046),见图3。

图1 胆囊癌(n=32)及癌旁组织(n=32)中SIX4 mRNA(A)、miR-103a-3p(B)水平比较
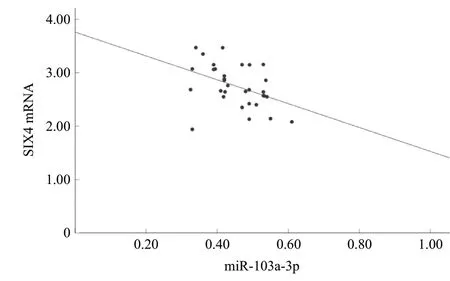
图2 临床胆囊癌组织样本(n=32)中SIX4 mRNA与miR-103a-3p的相关性分析

图3 COSMIC数据库中胆囊癌样本(n=168)SIX4 mRNA与miR-103a-3p的相关性分析
2.2 双荧光素酶验证miR-103a-3p与SIX4的靶向关系
TargetScan分析发现,SIX4 mRNA的3’UTR含有miR-103a-3p序列保守碱基,见图4A。双荧光素酶实验验证二者的靶向关系,结果显示,与mimic NC+SIX4 3’UTR-WT相比,miR-103a-3p mimic+SIX4 3’UTR-WT细胞荧光素酶相对活性下降(F=48.728,P<0.001),见图4B。
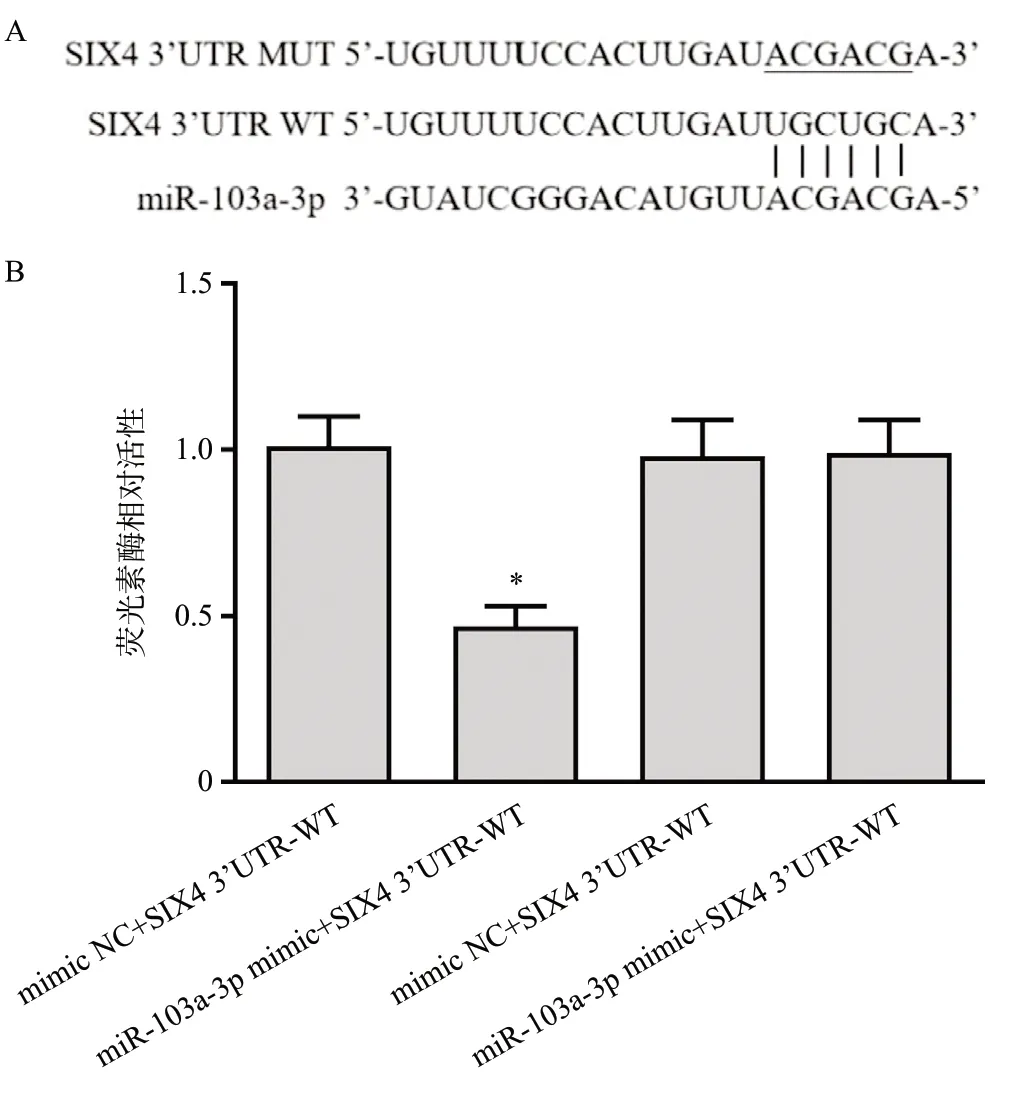
图4 miR-103a-3p与SIX4的靶点预测(A)和靶向关系验证(B)
2.3 各组细胞中SIX4、miR-103a-3p表达情况
5组间比较,SIX4 mRNA(F=82.606,P<0.001)和蛋白(F=229.772,P<0.001)水平及miR-103a-3p水平(F=48.603,P<0.001)差异均具有统计学意义。分别与对照组、mimic NC组相比,miR-103a-3p mimic组、miR-103a-3p mimic+pc DNA3.1组、miR-103a-3p mimic+SIX4组细胞中SIX4 mRNA和蛋白水平降低(P<0.05),miR-103a-3p水平升高(P<0.05);分别与miR-103a-3p mimic组、miR-103a-3p mimic+pc DNA3.1组相比,miR-103a-3p mimic+SIX4组细胞中SIX4 mRNA和蛋白水平升高(P<0.05),miR-103a-3p水平降低(P<0.05),见图5。

图5 各组细胞中SIX4 mRNA(A)和蛋白(B)、miR-103a-3p(C)水平比较(n=6,)
2.4 各组细胞增殖情况
5 组细胞OD450值比较,差异有统计学意义(F=25.985,P<0.001)。分别与对照组、mimic NC组相比,miR-103a-3p mimic组、miR-103a-3p mimic+pc DNA3.1组细胞中OD450降低(P<0.05);分别与miR-103a-3p mimic组、miR-103a-3p mimic+pc DNA3.1组相比,miR-103a-3p mimic+SIX4组细胞中OD450升高(P<0.05)。见图6。

图6 各组细胞增殖情况比较(n=6,)
2.5 各组细胞侵袭情况
5组细胞侵袭数量比较,差异有统计学意义(F=96.255,P<0.001)。分别与对照组、mimic NC组相比,miR-103a-3p mimic组、miR-103a-3p mimic+pc DNA3.1组、miR-103a-3p mimic+SIX4组细胞侵袭数量降低(P<0.05);分别与miR-103a-3p mimic组、miR-103a-3p mimic+pc DNA3.1组相比,miR-103a-3p mimic+SIX4组细胞侵袭数量升高(P<0.05)。见图7、图8。
图7 各组细胞侵袭情况(×200)
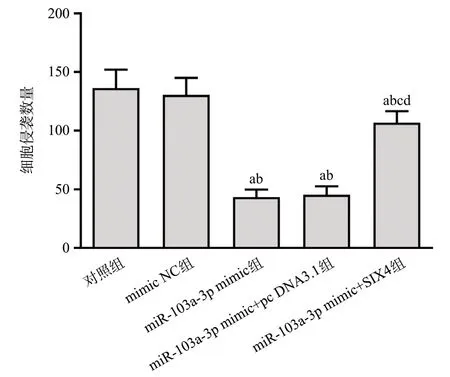
图8 各组细胞侵袭数量比较(n=6,)
2.6 各组细胞中Ki-67、PCNA、MMP2、MMP9蛋白表达情况
5组细胞中Ki-67、PCNA、MMP2、MMP9蛋白水平差异有统计学意义(F=18.133、80.484、27.124、68.126,均P<0.001)。分别与对照组、mimic NC组相比,miR-103a-3p mimic组、miR-103a-3p mimic+pc DNA3.1组细胞中Ki-67、PCNA、MMP2、MMP9蛋白水平,miR-103a-3p mimic+SIX4 组细胞中PCNA蛋白水平降低(P<0.05);分别与miR-103a-3p mimic组、miR-103a-3p mimic+pc DNA3.1组相比,miR-103a-3p mimic+SIX4 组细胞中Ki-67、PCNA、MMP2、MMP9蛋白水平升高(P<0.05)。见图9。
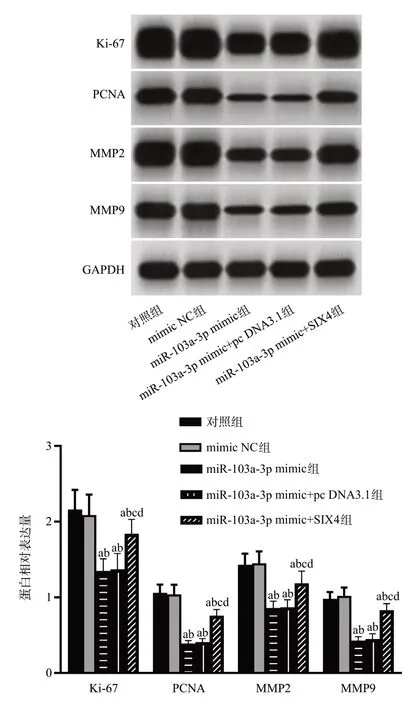
图9 各组细胞中Ki-67、PCNA、MMP2、MMP9蛋白水平比较(n=6,)
3 讨论
目前治疗胆囊癌的有效方法是胆囊癌根治性切除术,但只对早期胆囊癌有较好的治疗效果,晚期(Ⅲ、Ⅳ期)患者尚无手术指征[8-9]。胆囊癌初期无明显症状,发现时往往已至晚期,不再适合手术治疗,且晚期患者常出现淋巴结及远处转移,导致其预后较差[10]。因此,寻找新的治疗方法及靶点对于胆囊癌的治疗具有较高意义。
目前,许多研究证明miRNA畸变与胆囊癌进展有关。Jiang等[11]报道,与相邻的正常组织相比,miR-365在人类胆囊癌组织中的表达降低,miR-365可能具有抑制肿瘤的作用。Li等[12]研究发现,miR-188-5p在人胆囊癌组织中表达下调,miR-188-5p通过靶向Wnt2b和Smad2 在胆囊癌中发挥抑癌作用。Zong等[13]发现,miR-125b在胆囊癌组织中下调,是胆囊癌进展的抑制因子。以上研究均提示miRNAs可能被用作胆囊癌的治疗标志物。有研究已经揭示miR-103a-3p在前列腺癌[14]、甲状腺癌[15]中均影响癌细胞增殖、侵袭、迁移,为疾病治疗提供新靶标,但目前尚缺少其在胆囊癌中作用的研究。本研究发现,miR-103a-3p在胆囊癌组织中低表达,推测低表达miR-103a-3p可能影响胆囊癌的发生发展。深入研究发现,在胆囊癌细胞中过表达miR-103a-3p可以抑制癌细胞的增殖和侵袭,这与其在非小细胞肺癌中的研究[16]正好相反,推测其可能是由于细胞类型不同导致miR-103a-3p的表达趋势发生改变。本研究进一步验证了细胞增殖、侵袭的蛋白表达情况。Ki-67、PCNA作为增殖标志蛋白,Ki-67高表达与肿瘤细胞周期、肿瘤转移关系密切,PCNA在细胞增殖启动中发挥重要作用[17];MMP2 作为重要的Ⅳ型胶原酶,分泌过多会促进肿瘤扩散和转移[18];MMP9 参与肿瘤细胞穿透基底膜和血管,可促进肿瘤发生和发展[19]。本研究发现,在胆囊癌细胞中过表达miR-103a-3p可抑制细胞中Ki-67、PCNA、MMP2、MMP9蛋白表达,与增殖、侵袭实验结果一致,证实miR-103a-3p可通过下调相关蛋白表达抑制胆囊癌细胞增殖和侵袭。
miRNA通过结合靶基因的3’UTR调控靶基因的转录或翻译,进而调控疾病。既往研究揭示了miR-103a-3p在各种肿瘤中的多个靶点,如非小细胞肺癌中的CCNE1[20]、胶质瘤中的PDK4[21]。在本研究中,生物信息学分析预测SIX4 3’UTR是miR-103a-3p的潜在结合位点,并经双荧光素酶验证了这一预测。SIX4作为同源盒基因家族成员之一,最早发现其可调控Na+/K+-ATP酶亚基的表达[22];SIX4在肝细胞癌组织中表达高于癌旁组织和远端正常组织,且其表达水平与预后关系密切,可作为临床预测肝细胞癌预后的指标[23];食管鳞状细胞癌中SIX4 表达上调,可促进食管鳞状细胞癌的肿瘤生长和细胞转移[24]。上述研究说明SIX4可能是一种促癌因子。在本研究中,胆囊癌组织中SIX4 表达上调,推测SIX4 可能影响胆囊癌疾病进展并参与介导miR-103a-3p抑制胆囊癌进展的过程。此外,在miR-103a-3p过表达基础上SIX4表达升高可促进细胞增殖、侵袭,并上调Ki-67、PCNA、MMP2、MMP9蛋白表达,提示miR-103a-3p可能通过抑制靶基因SIX4 从而抑制胆囊癌细胞增殖、侵袭,实现对疾病的缓解。
综上所述,本研究发现胆囊癌组织中miR-103a-3p低表达、SIX4 高表达,在胆囊癌细胞中过表达miR-103a-3p后能抑制SIX4的表达,从而降低胆囊癌细胞增殖、侵袭,发挥抗肿瘤作用。本研究为胆囊癌的发生提供了可能的新机制,为胆囊癌患者提供了可能的治疗靶点。越来越多的证据表明,miRNA替代疗法(miRNA活性的提高)可以恢复失去的功能,是一种非常有前途的癌症治疗方法[25]。因此,本研究结果为miR-103a-3p胆囊癌替代治疗研究提供了理论依据。然而,对于miR-103a-3p替代治疗的临床应用,miRNA的体内传递仍然是一个很大的挑战。此外,还需要进一步的实验来分析miR-103a-3p在体内对胆囊癌的抗肿瘤作用,以开发从实验室到临床的新的治疗策略。再者,miR-103a-3p靶基因较多,亦可能通过别的基因发挥作用,发现更多与胆囊癌关系密切的靶基因也是本研究未来的重点。
