废旧TNT 资源化再利用研究进展
2022-10-22龚建良郭旺军伍致生王户生
张 杰,康 超,龚建良,郭旺军,伍致生,王户生
(西安近代化学研究所,陕西 西安 710065)
0 引言
2,4,6-三硝基甲苯(TNT)是二战以来使用最为广泛的含能材料,也是全球各军事强国大规模生产和装备的含能材料。一方面,即使在新一代含能材料如奥克托今(HMX)、六硝基六氮杂异伍兹烷(CL-20)广泛使用的今天,各国仍然保持着相当规模的TNT 生产。另一方面,随着武器装备的升级换代,退役装备中也会产生大量废旧TNT。这些大量生产或退役的TNT 如果不进行妥善处置,将对自然环境和公共安全造成严重影响[1]。研究表明TNT 对人和动物都有致命或者不利影响,会造成脾脏和肝脏严重且不可逆损伤[2],被美国环境局(US EPA)列为人类致癌物[3]。环境方面,TNT 及其降解产物(如苯胺、硝基苯)与土壤中的颗粒有机物(POM)、可溶性有机物(DOM)及自由组分有着特定的相互作用[4],可通过与上述土壤组分共迁移而进一步污染地下水或者新的土壤[5]。
目前废旧TNT 固体及含TNT 装药的药柱等销毁主要依靠焚烧,该方法在消耗电能的同时会产生大量有毒有害气体(如一氧化碳、二氧化氮、二噁英等)及温室气体。TNT 资源化再利用是通过化学或生物转化将TNT 转化为化工中间体或生物质,将组成TNT 的原子最大限度地保留到最终产物中,实现废旧TNT 原子经济性的再利用[6-8]。TNT 通过化学转化得到的多数化合物是目前医药、染料、高分子领域所需的关键新材料,而且很难通过其他技术路线得到;通过生物转化可将TNT 作为新的碳源/氮源为微生物的培养提供营养,从而衍生出一系列新的生物质或代谢产物[9]。为此,按照化学转化、微生物降解2 类废旧TNT 转化方式,综述了TNT 甲基氧化、硝基还原、SE1 芳基取代、需氧及厌氧微生物降解等不同类型的转化降解实例,为全面了解TNT 资源化再利用及升级退役TNT 处理方式奠定基础。
1 TNT 化学转化途径及再利用研究
1.1 基于甲基氧化的转化途径
1.1.1 将TNT 氧化为2,4,6-三硝基苯甲酸
TNT 的甲基氧化为羧基在其化学转化中占有至关重要的位置,氧化为2,4,6-三硝基苯甲酸(TNBA)后可以通过酰胺化、酰氯化、酯化及脱羧等化学转化得到一系列结构多样的化工中间体。
使用重铬酸钠(Na2Cr2O7)将TNT 以中等收率(57%~82%)氧化为TNBA 曾是废旧TNT 向化工中间体转化的关键工艺[10],TNBA 可在NaOH 的碱液中脱羧得到1,3,5-三硝基苯(TNB)[11]。TNB 除本身是与TNT 相当的含能材料外,也是安全炸药TATB 的关键原材料。TNBA 也可通过锡粉/盐酸还原,并在碱性条件下脱羧、水解,实现TNBA 向间苯三酚(Phloroglucinol)的转化[12](Scheme 1)。间苯三酚作为重要的非阿托品类解痉挛药物,在临床广泛应用[13]。S. C.Kim 等[14]改进了间苯三酚合成反应,并指出使用的重铬酸钠会造成严重的环境问题,通过微波辅助水解,可大幅降低水解步骤酸的使用量并缩短了反应时间。近年来由于重铬酸钠工艺带来的重金属及废酸污染,该氧化工艺已完全被淘汰;均苯三酚制备工艺也升级为间三氯苯水解。
周智明小组[15]研究了基于有机小分子(THICA)催化、O2为氧化剂的新型环保策略,成功将TNT 绿色高效地(产率78%~82%)转化为TNBA。该方法使用10% mol 的THICA 作为催化剂,使用环保氧化剂为该类反应提供了一个环保的氧化途径(Scheme 2)。该方法与重铬酸钠氧化相比,具有反应体系无重金属、使用氧气为氧化剂、乙酸作为溶剂可循环使用等优势。小分子催化剂THICA 用量较高且难以循环利用,是限制该工艺推广的主要因素,该工艺未来发展方向主要有2 个,一方面是降低催化剂的成本及使用量,另一方面是使用压缩空气替代氧气。
使用O3/H2O2体系,Co2+为催化剂甲酸为溶剂的氧化策略[16],可以将TNT 氧化为TNBA 后进一步脱羧得到1,3,5-三硝基苯(TNB)。O3/H2O2氧化虽使用催化量的乙酸钴,但氧化剂采用臭氧和双氧水,整体工艺过程环保性明显优于重铬酸钠工艺。与氧气/THICA体系相比,环保性及对反应进程的控制较差。此外臭氧及双氧水制备、使用及运输均比氧气复杂。TNB 可进一步在碳粉、三氯化铁和水合肼的体系中完全还原,在盐酸体系中后处理得到均苯三胺三盐酸盐(Scheme 3)。均苯三胺盐酸盐在超支化材料、金属有机框架化合物(MOF)、聚氨酯等新材料领域具有潜在应用。
2,4,6-三硝基苯甲酸可选择性地还原硝基得到相应的单还原产物。FeCl3催化,NH2NH2为还原剂以中等收率(52%~63%)选择性还原单个邻位硝基,在乙酸酐中回流以81%收率环化得到苯并六元内酯化合物,进一步在液氨中回流以90%收率得到苯并六元内酰胺化合物[17](Scheme 4),该苯并六元内酰胺是多种活性天然产物的关键骨架。碱性条件下Ti3+也可还原TNBA 得到邻位硝基和对位硝基分别被还原的产物[18],但该方法在邻对位选择性方面存在不足。

Scheme 1 Transformation based on TNT oxidation[10-12]

Scheme 2 Metal free oxidation of TNT via O2/THICA conditions[15]

Scheme 3 Oxidation of TNT via O3/H2O2 conditions[16]

Scheme 4 Selective reduction of TNBA[17-18]
TNBA 在氯化亚砜/DMF 条件下以70%的收率得到2,4,6-三硝基苯甲酰氯(TNBCl),由于3 个硝基的强拉电子效应使得该酰氯非常稳定,多次应用在复杂天然产物全合成中。TNBCl 可进一步与邻氨基苯酚以较高收率(82%)得到酰胺化合物,此处酰胺化与酯化反应的竞争由于TNBCl 独特的缺电特性而优先发生酰胺化;进一步,在氨水的作用下发生分子内的SE1取代以86%的收率得到七元内酰胺醚类化合物,而该骨架正是活性天然产物Sintamil 的核心骨架[19](Scheme 5)。
在硫酸二甲酯的作用下可将TNBA 转化为2,4,6-三硝基苯甲酸甲酯,与其他多硝基化合物类似,该化合物具有SE1 取代反应的活性位点。在甲醇钠/甲醇体系中,甲氧基负离子进攻硝基发生取代反应以54%的产率得到邻位和对位单取代两个产物。进一步在碱性条件下水解制备成酸后可制备具有甲氧基/硝基取代的天然产物Sintamil 类似物[19](Scheme 6)。

Scheme 5 Research on 2,4,6-trinitrobenzoyl chloride[19]

Scheme 6 Research on methyl 2,4,6-trinitrobenzoate[19]
TNBCl 与不同官能团的一级胺和二级胺缩合以中等偏上的收率得到相应的酰胺化合物。酰胺的位阻较大时,甲氧基(83%)、苯氧基(94%)、叠氮负离子(48%)SE1 取代反应得到对位取代产物,此时位阻效应占主导;若使用氢键给体类试剂,如甲胺发生SE1 取代反应,则以52%的收率得到邻位甲胺基取代的产物,此时氢键诱导效应占主导;当换为位阻较小的苯基酰胺,使用氢键给体类试剂甲醇(83%)、苯酚(70%)邻位诱导效应更为显著。第二次SE1 取代反应,使用亲核能力更强的BnS-离子进攻,则以75%收率得到邻、对位取代的衍生物[20](Scheme 7)。
1.1.2 将TNT 氧化为2,4,6-三硝基苯甲醛
在O3/H2O2体系中,Co2+为催化剂,乙酸为溶剂,可实现TNT 向2,4,6-三硝基苯甲醛(TNBAl)的一步转化(产率68%)[16]。该方法优于I2催化下缩合形成亚胺再酸性条件下水解制备TNBAl 的策略[21]。在得到TNBAl 之后,可与苯胺及其衍生物反应以较高收率制备一系列亚 胺[22]。TNBAl 发生SE1 取代可以92%的产率制备邻对位单BnS 取代产物,其中邻位取代产物(产率40%)可进一步在磺酰氯的作用下以54%的产率成环得到结构新颖的五元芳香杂环,该杂芳环的硝基还可以进一步发生SE1 取代反应得到一系列活性天然产物的核心骨架[23](Scheme 8)。
1.1.3 将TNT 氧化为2,4,6-三硝基苯甲醇
使用Br2和NaHCO3原位制备的NaBrO,可氧化TNT 得 到2,4,6-三 硝 基 苯 甲 醇,并 在Ti3+催 化 下 以60%的产率选择性还原对位硝基得到4-氨基-2,6-二硝基苯甲醇[18]。2,4,6-三硝基苯甲醇可在硝酸体系中以62%的产率得到硝酸酯产物[24](Scheme 9)。

Scheme 7 Research on 2,4,6-trinitrobenzamide derivants[20]

Scheme 8 Research on 2,4,6-trinitrobenzaldehyde[16,21-23]
TNT 在碱性条件下与甲醛(99%)、三氟乙醛(71%)、三氯乙醛(70%)发生Aldole 反应可得到的高苄位醇[25],在碱性DMF 体系中发生分子内的取代反应得到苯并二氢呋喃类化合物(Scheme 10);第二步分子内SE1 环化反应,R 取代基需为CF3、CCl3等拉电子取代基。

Scheme 9 Research on(2,4,6-trinitrophenyl)methanol[18,24]

Scheme 10 Aldole reaction of TNT[25]
2,4,6-三硝基苯乙醇在肼/三氯化铁还原下以80%的收率得到邻位硝基选择性单还原的产物,进一步在TsCl/吡啶和氧气的作用下环化氧化以中等收率得到多硝基取代的吲哚及其衍生物[26]。2,4,6-三硝基苯乙醇在氯化亚砜条件下氯代后可在碱性条件下消除以两步29%的收率得到2,4,6-三硝基苯乙烯[27]。在尝试进行苯乙烯类聚合失败后,使用不同的胺类作为亲核试剂制备得到一系列高苄位氨基取代的衍生物。2,4,6-三硝基苯乙醇在氟化试剂作用下可制备高苄位氟代物[28]。2,4,6-三硝基苯乙醇通过Ts 保护制成易离去基团后可与卤化锂发生SN2 取代反应制备得到高苄位溴代、碘代的衍生物,为后续的该类化合物研究提供了有效的参考(Scheme 11)。

Scheme 11 Preparation and transformation of 2-(2,4,6-trinitrophenyl)ethan-1-ol[26-28]
TNT 由于多硝基的致钝特性使得甲基很难发生氧化。早期使用的重铬酸钠、高氯酸钠及高锰酸钾等氧化方式虽然可以实现TNT 向TNBA 的转化,但同时也会产生大量废酸和重金属盐,不满足新的环保要求近年已完全淘汰。研究表明,O3/H2O2/Co2+体系和O2/THICA 体系都可以在较为温和条件下使用绿色氧化剂实现TNT 向TNBA 的转化。在氧化选择性、环保性等方面O2/THICA 体系具有明显优势,但要实现工业化应用还需解决催化剂成本高、用量大以及能否直接用压缩空气代替氧气等问题。TNBA 是TNT 向下游产品转化的关键化合物:羧基可以进一步转化为酰氯、酰胺、酯基等衍生物;硝基可通过选择性还原制备成氨基苯甲酸类医药中间体;硝基也可以发生SE1 取代反应得到一系列醚/硫醚苯甲酸类衍生物;上述衍生物进一步的可构筑一些活性天然产物核心骨架。此外,TNBA 脱羧后得到的TNB 是另外一个关键衍生物,下游转化产物是一系列高度对称的多元酚/醇及多元氨产物,TNB 同时也是安全炸药TATB 的原材料。
O3/H2O2/Co2+体系氧化过程会有部分TNT 停留在2,4,6-三硝基苯甲醛,优于I2催化下缩合形成亚胺再酸性条件下水解制备2,4,6-三硝基苯甲醛的策略。除了制备一系列亚胺类化合物外,2,4,6-三硝基苯甲醛也可以通过SE1 取代可制备邻对位单BnS 取代产物,进一步制备结构新颖的五元芳香杂环。
使用Br2和NaHCO3原位制备的NaBrO,可氧化TNT 得到2,4,6-三硝基苯甲醇。通过选择性还原可制备得到的系列氨基苯甲醇衍生物是重要的医药中间体。TNT 在碱性条件下与醛基发生Aldole 反应可得到高苄位醇,这类高苄位醇可衍生得到系列氟、氯、溴、碘衍生物,同时也是制备4,6-二硝基吲哚及其衍生物的关键原料。
TNT 甲基氧化除制备2,4,6-三硝基苯甲醇需使用溴素外,其他氧化过程均使用绿色氧化剂(如O2、O3、H2O2等),呈现出多样、绿色、高效的特点,尤其是TNBA 作为TNT 向下游产品转化的关键化合物,其高效绿色氧化方法的持续研究尤为重要。从甲基氧化的下游转化产品来看,主要是氨基苯甲酸类、醚/硫醚苯甲酸类衍生物、氨基苯甲醇衍生物及氨基高苄位醇衍生物等医药中间体,鉴于该类产品很难通过其他合成途径得到,具有独特的自限性,可作为特异性合成模块用于新药研发。TNBA 脱羧得到TNB 经还原水解等反应会得到系列中心对称三元氨/醇,在MOF、高分子材料等领域具有广泛应用。
1.2 基于硝基还原的相关转化
1.2.1 选择性单硝基还原
TNT 选择性单硝基还原具有重要的意义,还原得到的2-氨基-4,6-二硝基甲苯及4-氨基-2,6-二硝基甲苯都是重要的化工中间体。TNT 在铁粉/乙酸条件下能够以36%的收率得到单邻位还原产物2-氨基-4,6-二硝基甲苯;在氨水/硫化氢体系中可以47%的产率得到对位还原产物4-氨基-2,6-二硝基甲苯;这类化合物在甲酸/硫酸体系中能够以较高收率得到甲基化产物[29](Scheme 12)。
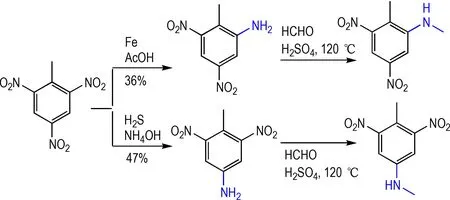
Scheme 12 Selective solo-reduction of TNT[29]
2-氨基-4,6-二硝基甲苯在S2Cl2/DABCO 的作用下可以90%的收率构筑苯并五元氮硫杂芳环骨架,进一步在甲基二甲胺离子对发生加成反应(45%)得到多环骨架。该骨架在活性药物分子的合成中具有潜在的应用价值[30]。4-氨基-2,6-二硝基甲苯在混酸(含乙酸)的条件下制备得到苯环三硝基取代的产物,并验证了其在硫酸作用下发生重排得到苯环四硝基取代物的反应机理;在不含乙酸的混酸中得到苯环四硝基取代物,并进一步转化得到一系列结构新颖的多硝基甲苯类化合物[31]。此外,4-氨基-2,6-二硝基甲苯在硝化条件下的制备4-氨基-2,3,5,6-四硝基甲苯,4-氨基-2,3,5,6-四硝基苯甲酸的合成,得到一系列高度硝基化的新型化合物[29](Scheme 13)。
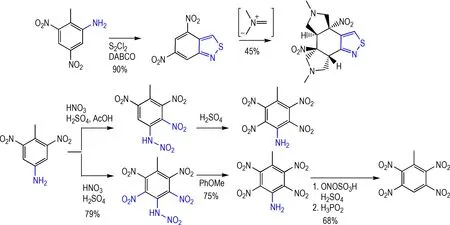
Scheme 13 Further transformation of TNT solo-reduction products[29-31]
1.2.2 其他还原反应
不同当量下水合肼/三氯化铁在10 ℃下可实现TNT 多样性还原[32]。通过调节水合肼的使用量可得到一系列还原产物:当使用1 当量水合肼时,以70%的产率得到邻位选择性单还原产物2-氨基-4,6-二硝基甲苯;使用2 当量水合肼时,以57%的产率选择性得到双邻位还原产物2,4-二氨基-6-硝基甲苯;当使用大过量(5 当量)水合肼时,以68%的收率得到硝基全部还原产物2,4,6-三氨基甲苯(Scheme 14)。该体系通过水合肼当量的调控,可以高选择性、中等偏上的产率得到单邻、双邻、全部硝基还原产物。配合其他还原体系可实现TNT 中各硝基多样性选择性还原,为其转化为高附加值医药化工中间体提供了重要支撑。
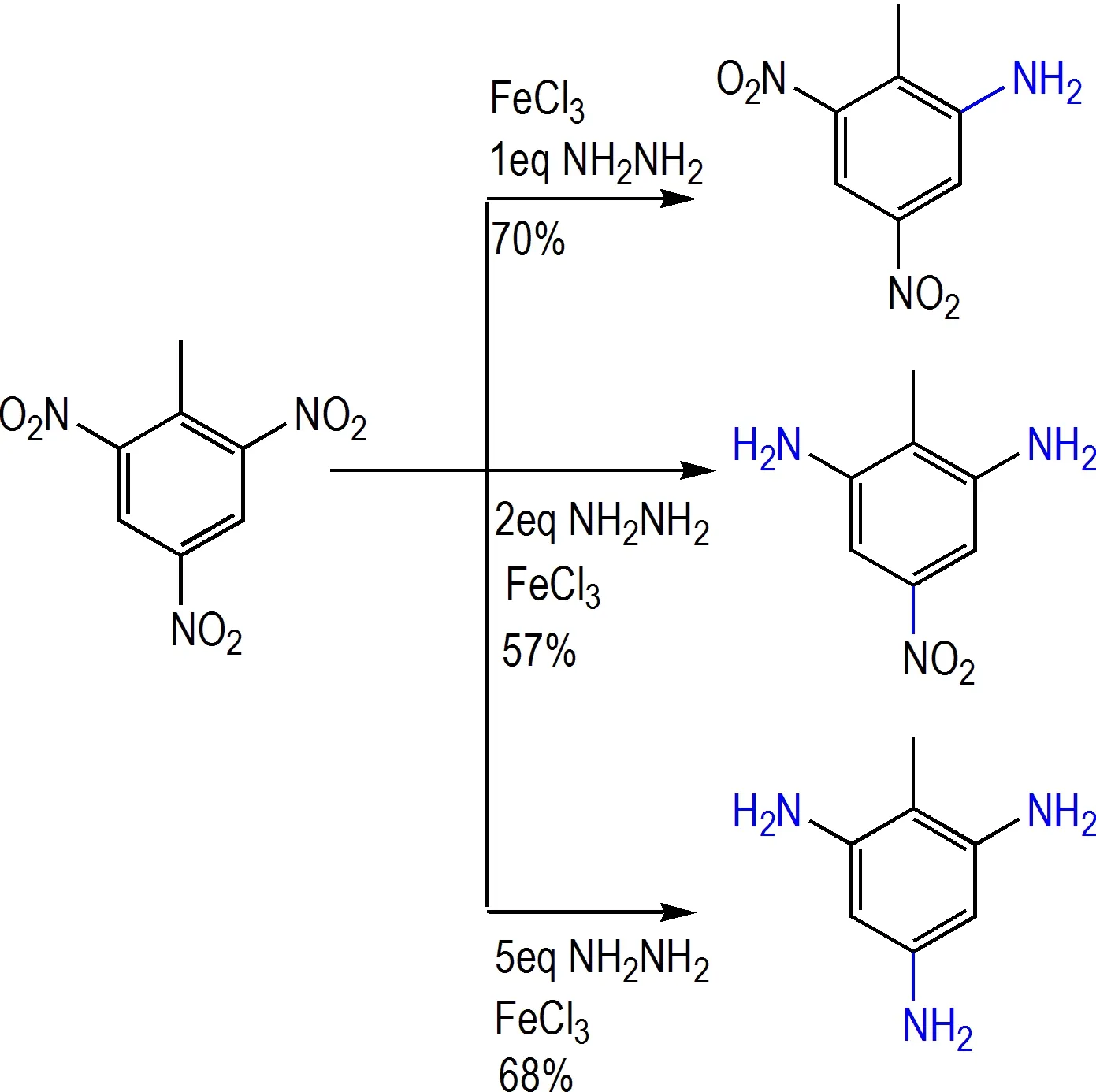
Scheme 14 Selective reduction of TNT[32]
TNT 资源化再利用过程中,产品附加值的提升固然重要,另外一个重要考量因素是市场需求总量。甲基间苯三酚(Methylphloroglucinol,MPG)在医药、染料等领域具有广阔需求,尤其是基于MPG 的耐久染料有望创造较大市场需求。MPG 的合成途径较多,总体来说有分步法和一步法:分步法首先需要将TNT 还原为甲基均苯三胺,方法主要有盐酸/金属体系、氢化还原体系等,第二步采用酸性条件下的水解;一步法历程与两步法一致,采用金属盐酸体系一锅法完成还原和水解。盐酸/金属体系一锅法虽然操作简单且成本较低,但是收率往往较低并产生大量废酸和金属盐等环境污染物。氢化还原、微波辅助水解是可行方案,但也存在氢化催化剂成本高、易中毒失效等不足[33-34](Scheme 15)。

Scheme 15 Dyes based on methylphloroglucinol[33-34]
TNT 硝基还原具有选择性优势,可通过多种还原体系的组合选择性进行邻/对位单还原、双还原及完全还原,得到系列氨基甲苯类化合物。后续水解或氨基衍生化能够进一步丰富产品多样性。这些下游转化产品中甲基间苯三酚值得关注,在染料及光电材料领域具有广阔应用前景。基于MPG 骨架的偶氮类染料已体现出明显优于现有染料的附着力和稳定性,在建筑、印染、防腐等领域具有应用前景。
1.3 基于取代反应的相关转化
1.3.1 甲基发生的取代反应
TNT 在碳酸镁存在下直接溴代以较高收率得到2,4,6-三硝基苄溴[24],该苄溴在硝酸银的作用下可以生成2,4,6-三硝基苄醇硝酸酯(收率86%),或者与水杨醛(或者3-羟基-2-萘醛)发生缩合反应得到七元醚环(Scheme 16)。此外TNT 在次氯酸钠溶液中可发生氯代制备2,4,6-三硝基苄氯[35]。
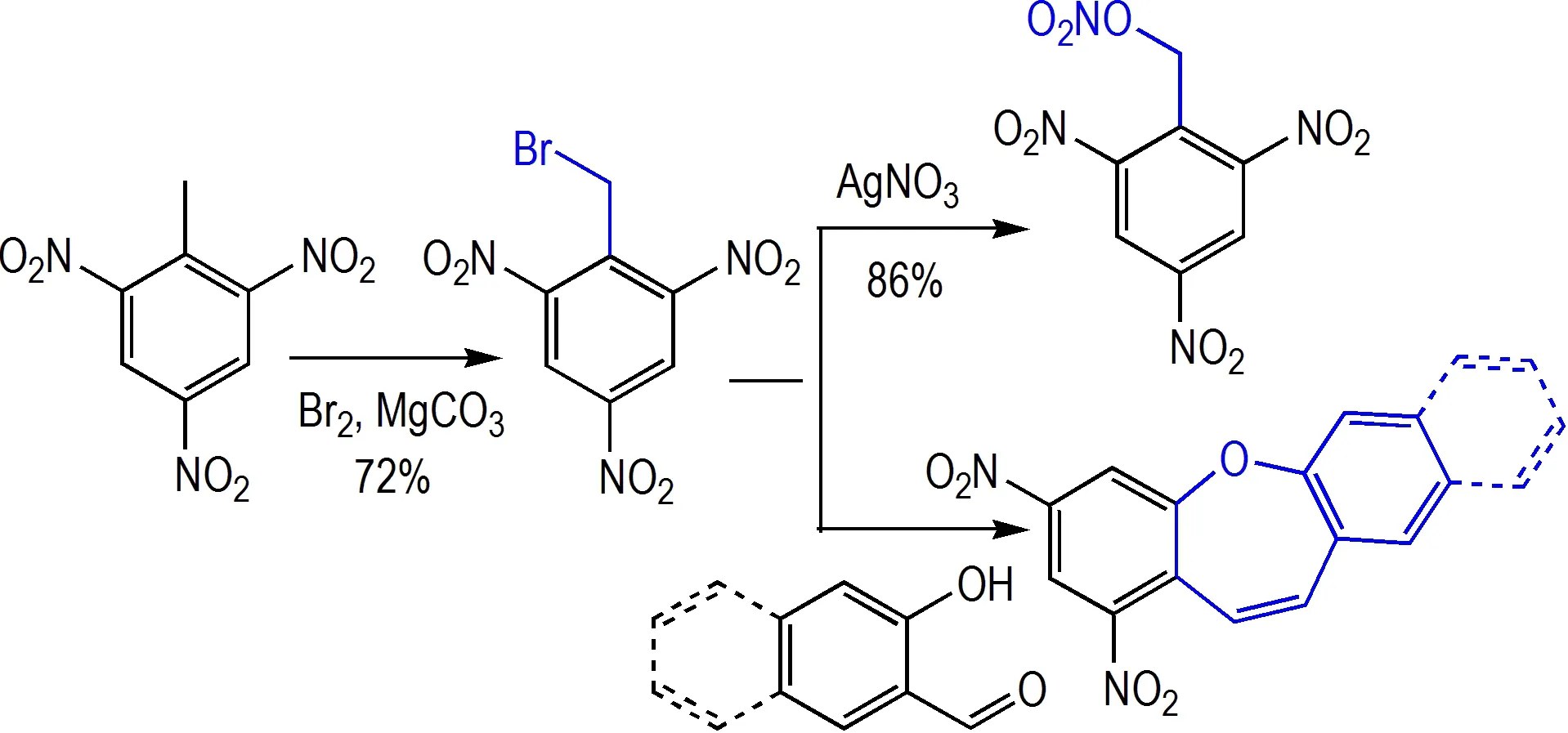
Scheme 16 Direct methyl halogenate of TNT[24,35]
TNT 与氨基甲酸衍生物发生缩合反应得到烯基胺类产物[36],并进一步在盐酸作用下脱去胺基得到2,4,6-三硝基苯乙醛(58%)、在液溴作用下得到α-二溴-2,4,6-三硝基苯乙醛(52%)、在亚硝酸钠/盐酸的作用下得到α-肟-2,4,6-三硝基苯乙醛(66%)并在碳酸钾的作用下以75%的产率制得2,4-二硝基-6-羟基苯甲腈(Scheme 17)。
2,4,6-三硝基苯乙醛可在酸性条件下与乙二醇制备相应的缩醛(95%)、或与芳胺在亚硝酸的作用下 制 备α-芳 基 肼-2,4,6-三 硝 基 苯 乙 醛(66%~79%),芳胺为苯胺、或对氯/对甲氧基苯胺对反应活性没有明显影响;进一步的,在碳酸钾的作用下发生分子内的缩合制备苯并五元含氮杂环(82%~91%)。后续研究表明该含氮杂环化合物中的硝基可以被亲核试剂取代,如叠氮负离子(75%)、苯酚(70%)、苯硫酚(95%)、苄硫醇(90%)、环己硫醇(89%),制得一系列类似物[37](Scheme 18)。

Scheme 17 Reactions between TNT and acetals[36]
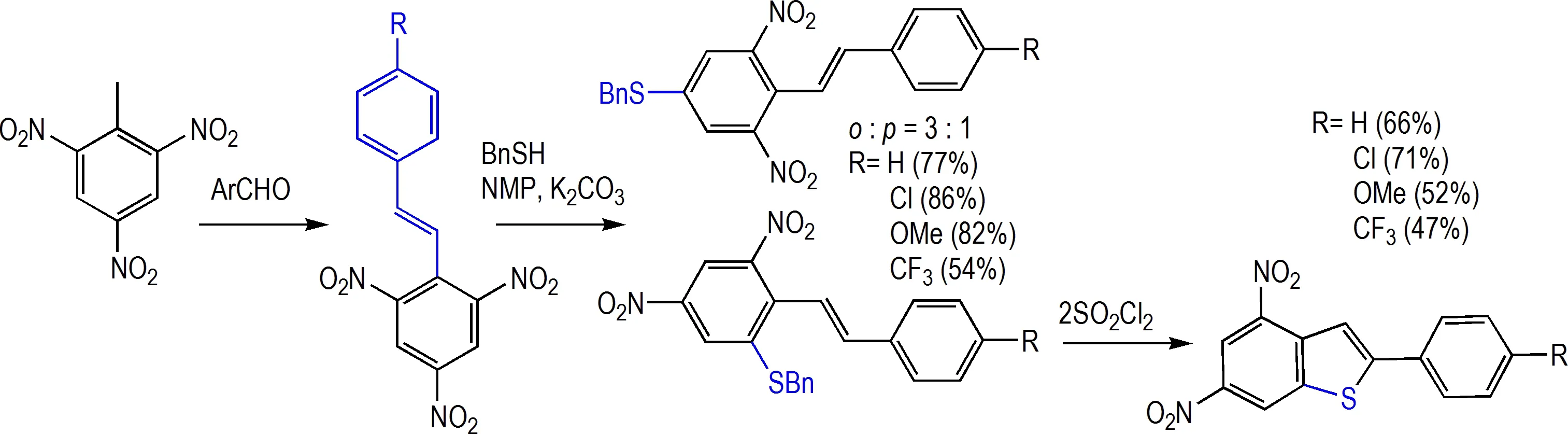
TNT 可与苯甲醛衍生物发生缩合反应,进一步与BnSH 发生SE1 反应得到邻位或对位被BnS 取代的产物(o∶p=3∶1),SE1 取代反应受芳基取代基效应影响较为显著,当取代基为氯(86%)、甲氧基(82%)等富电子取代基时产率明显高于无取代基时的77%,当取代基为缺电子取代基CF3时产率只有54%。非常特别的是邻位BnS 取代产物可以在磺酰氯的作用下合成多官能团化的苯并噻吩类化合物[38](Scheme 19),具有潜在的应用价值。
TNT 在NOCl 和吡啶的作用下可以中等收率制备2,4,6-三硝基苯 甲腈(TNBCy)[39],S. Y.Pyun 小组[40]对该反应机理进行了系统研究。TNBCy 可参与各种硝基取代反应,从而制备一系列结构新颖多样的化合物[20,41](Scheme 20)。以碳酸钾为碱:3 当量硫醇衍生物与TNBCy 发生取代反应可以中等偏上收率得到三取代产物;1 当量苄硫醇与TNBCy 反应以91%收率得到单取代产物,邻/对位取代比例为3∶1。同样的,在甲醇/甲醇钠体系中控制甲醇钠的当量也可以得到多样化的产物:1 当量甲醇钠条件下以90%~93%的高收率得到单取代产物,邻/对位选择性随着反应温度的升高逐渐下降;2 当量甲醇钠条件下以85%的收率得到双取代产物,剩余硝基为邻/对位的比例是2∶1;3 当量甲醇钠回流条件下能够以88%的收率得到三取代产物。
TNT 在碱性条件下可发生一系列反应得到二聚产物HNS[42](Scheme 21)。A. J. Bellamy 小组[43]系统研究了该反应在实验室的放大连续生产,设计并验证了一个动力学静态混合器。M. Lu 小组指出醇、碱和有效的氯源是影响该反应的3 个要素[35]。

Scheme 18 Research on 2-(2,4,6-trinitrophenyl)acetaldehyde[37]
Scheme 19 Condensation between TNT and aldehyde[38]

Scheme 20 Reactions of 2,4,6-trinitrobenzonitrile[39-41]

Scheme 21 Homocoupling of TNT[35,42]
1.3.2 硝基发生的SE1 芳基取代反应
TNT 可直接发生SE1 芳基取代反应制备一些列衍生物[20];TNT 可在不同硫亲核试剂下发生SE1 芳基取代 反 应,对 甲 基 苯 硫 酚(70%)、5-溴-2-氟 苯 硫 酚(20%)、α-巯基乙酸甲酯(44%)、苄硫醇(40%)均以较高区域选择性得到邻位取代产物,只有苄硫醇得到7%的对位取代产物;邻位单取代产物可在双氧水条件下氧化得到砜类衍生物,氧化反应进程受取代基影响较大,当R 为Bn(94%)、iPr(83%)、Et(45%)、Me(77%)、CH(Me)COOEt(13%)时,随着取代基给电子能力变弱,氧化收率也随之下降[44](Scheme 22)。

Scheme 22 SE1 reactions of TNT[20,44]
TNT 取代反应位点有2 个:甲基取代衍生化得到苄溴、苯乙醛、二苯乙烯、苯甲腈类化合物;硝基发生SE1 取代得到醚/硫醚类化合物。值得指出的是,TNT下游转化产物的硝基也可以发生SE1 取代反应,进一步丰富了TNT 下游转化产品的多样性。基于取代反应的转化产品中,苯甲腈类衍生物是一类高附加值医药中间体;二硝基甲苯衍生物经还原、光气化得到系列改性TDI 有望作为现有TDI 添加剂,调节聚氨酯、聚碳酸酯类高分子材料的部分特定性能。
2 TNT 微生物转化途径及再利用研究
细菌、真菌等微生物不仅在自然界分布广泛,在含能材料生产、存储及使用等场所也大量存在,这些微生物能够缓慢分解环境中含能材料等污染物起到净化作用[45-46]。研究表明少数细菌和真菌能够在含能材料污染的土壤中存活,某些特定菌种可以将含能材料作为单一氮源或碳源进行代谢[47]。
2.1 需氧细菌的TNT 代谢途径及研究进展
需氧细菌可以将TNT 转化为2,6-二氨基-4-硝基甲苯(2,6-DA-4-NT),2-氨基-4-硝基甲苯(2A-4-NT)和2-氨基-2-亚硝基-6 硝基甲苯(4A-2NOC-6-NT)等硝基还原产物(Scheme 23);通常需氧细菌将TNT 的1~2 个硝基通过非特异性NAD(P)H 依赖的硝基还原酶还原为羟胺,进一步转化为氨基硝基甲苯化合物、二甲基偶氮苯等化合物,三个硝基的全部彻底还原较为困难。需氧细菌在转化TNT 时,每还原1 mol 硝基到氨基 需3 mol NAD(P)H 和3 mol H+并产生3 mol NAD(P)+和1.5 mol H2O;除个别的脱硝作用产生的亚硝酸根及氨基外,TNT 在需氧细菌代谢中不作为氮源或碳源参与核心代谢,产生的NAD(P)+作为重要的电子受体参与ATP 的合成并为细菌代谢提供能量;代谢产生的多氨基硝基甲苯、偶氮苯等代谢产物通过分子泵(multidrug efflux pump)排出[48]。
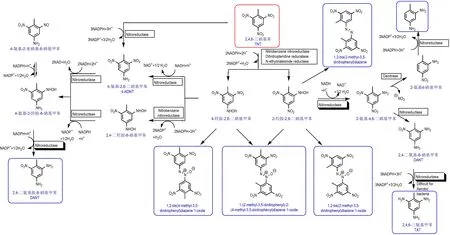
Scheme 23 Aerobic bacteria’TNT biodegradation pathway[48-68]
需氧型细菌Pseudomonas能够将TNT 作为唯一氮源;P. savastanoi能够将TNT 转化为2,4-DNT,在介质中富含葡萄糖的条件下TNT 将被转化为4-氨基-2,6-二硝基甲苯(4-ADNT)和2-氨基-4,6-二硝基甲苯(2-ADNT)并抑制TNT 的去硝基转化途径;在Bacillus sp.、Staphylococcus sp.、Pseudomonas aeruginosa培养基中检测到需氧代谢途径最终产物之一的4-氨 基-2-亚 硝 基-6-硝 基 甲 苯(4A-2NOC-6-NT);P. Aeruginosa也能够将TNT 代谢产物ADNTs 转化为极性较大的化合物。Aken 等[49]系统研究了Methylobacteriumsp.对同位素标记的含能材料[U-ring-14C]TNT(25 mg·L-1),[U-14C]RDX(20 mg·L-1)和[U-14C]HMX(2.5 mg·L-1)的微生物代谢及代谢动力学,TNT 在十天内会被完全消耗,检测到氨基二硝基甲苯及二氨基硝基甲苯中间体,未检测到14CO2表明在需氧代谢过程中TNT 并未参与碳循环。从厌氧发酵池内分离得到的Desulfovibrio sp.硫酸盐还原菌,可以将TNT 作为唯一氮源进行代谢[50]。使用大肠杆菌Escherichia coli对TNT 进行有氧代谢发现该大肠杆菌可以将TNT 作为唯一氮源并存在局部去硝化作用[51-52]。从TNT 污染土壤中分离得到的新型菌株Achromobacter spanius STE 11,该分离菌株能够在20 小时内将TNT(100 mg·L-1)彻底清除。通过测定代谢中间体2,4-二硝基甲苯(7 mg·L-1)、2,6-二硝基甲 苯(3 mg·L-1)、4-ADNT(49 mg·L-1)及2-ADNT(16 mg·L-1)的浓度验证有氧代谢途径,并发现该菌种在生长阶段的去硝化作用;生物质累积及元素分析表明该菌种将TNT 作为唯一氮源[53]。可降解TNT 的需氧型细菌及其代谢途径见表1。

表1 可降解TNT 的需氧型细菌及其代谢途径Table 1 TNT degradable aerobic bacteria and their biodegradation pathway
基于需氧细菌的TNT 转化最大优势在于需氧细菌种类多、来源广、且易于培养,在TNT 污染土壤、水体等环境中均可有效分离出TNT 耐受且具备转化功能的需氧细菌。然而,从代谢途径可以看出绝大部分需氧细菌无法完全降解TNT,代谢过程会停留在硝基单还原、双还原产物及其二聚、多聚体,这些代谢产物无法进一步在单一细菌内完成转化,只能通过分子泵排出。这种代谢模式的弊端主要有:随着代谢进程局部不完全代谢产物浓度会快速上升,达到一定阈值后细菌无法有效排出高毒性的不完全代谢产物,从而影响细菌的基础代谢;此外,该代谢模式只能利用部分硝基的氧化电势为细菌提供能量,TNT 无法作为碳源或氮源参与核心代谢,利用率较低。
2.2 厌氧细菌的TNT 代谢途径及研究进展
与TNT 需氧代谢类似,厌氧细菌每还原1 mol TNT 到TAT 需9 mol NAD(P)H 和9 mol H+并产生9 mol NAD(P)+和4.5 mol H2O,为细菌提供能量;不同的是彻底还原产物TAT 将转化为2,4,6-三羟基甲苯并产生3 mol 铵根离子(NH4+),为细菌提供氮源;2,4,6-三羟基甲苯进一步转化为1 mol 乙酰辅酶A 和1 mol 琥珀酰辅酶A 参与TCA 循环,为细菌提供碳源(Scheme 24)。由此可见,厌氧代谢的优点是TNT 所含的碳、氮、氧及硝基所具有的氧化势能均能通过代谢为细菌提供能量、氮源及碳源,无有毒末端代谢产物的积累。厌氧型细菌Desulfovibrio sp.、Clostridium sp.和古生菌Methanococcus sp能够将TNT 彻底的还原为TAT,Clostridium菌种的多数细菌能够在厌氧环境下还原TNT;Desulfovibriospecies能够在厌氧环境下将TNT 作为唯一氮源进行代谢;Clostridium和Desulfovibrio菌种能够催化TNT 还原并产生降解最终产物TAT[48]。

Scheme 24 Anaerobic bacterial TNT biodegradation pathway[48,61,75-77]
TNT 还原为TAT 的过程中经历了若干中间体,如DANTs 还原为TAT 是需要丙酮酸和氢气,同时该反应也是整个TNT 还原代谢的决速步骤[69]。与TNT 需氧代谢类似,TNT 的厌氧代谢过程也经历了亚硝基、羟胺等中间体最终被还原为氨基;然而只有在厌氧代谢下,C. acetobutylicum能 够 经Bamberger 重 排[70]反 应 将4-羟 胺-2,4-二 硝 基 甲 苯 转 化 为2-氨 基-5-羟 基-4-羟胺-6-硝基甲苯,4-ADNT 及2-ADNT 经非特异性NAD(P)H 硝基还原酶还原为DANT,在C.sordelli,C.bifermentans和C. sporogenes等的作用下DANT 可以被直接还原为TAT[71-73]。与TNT 的需氧代谢产物(氨基硝基甲苯化合物、二甲基偶氮苯等)不同,TAT 可以通过转氨基作用转化为2,4,6-三羟基甲苯并进一步转化为4-羟基甲苯[50]。4-羟基甲苯是甲苯生物代谢途径中的重要中间体,在4-monoxygenase、4-Hrdroxylenzaldehrde dehydrogenase、Iron-sulfur-flavoprotein reductase/Oxygenase和辅酶A的作用下代谢产生乙酰辅酶A及琥珀酰辅酶A 参与三羧酸循环[74]。可降解TNT 的厌氧型细菌及其代谢途径见表2。

表2 可降解TNT 的厌氧型细菌及其代谢途径Table 2 TNT degradable anaerobic bacteria and their biodegradation pathway
与需氧细菌不同,厌氧细菌TNT 转化的最大优势在于:TNT 会被完全还原为TAT,该过程3 个硝基的氧化电势会为细菌生产ATP 等能量物质提供能量;TAT通过氨基转移作用游离出铵根离子为细菌提供氮源;氨基转移产物甲基均苯三酚MPG 经酶促反应转化为对羟基甲苯后可进入核心的三羧酸循环,为细菌提供碳源;整个代谢过程中不完全代谢产物较少,在一定浓度范围内不会影响细菌的生长。然而,厌氧细菌存在种类较少、来源限制性高、培养过程复杂等不足。
2.3 真菌的TNT 代谢研究进展
与细菌代谢不同,真菌在需氧的条件下主要对TNT 进行矿化,只有极个别的厌氧细菌如Cladosporiumresinae and Cunninghamellaechinulatavar. Elegans可无矿化作用的将TNT 转化为主要为偶氮四硝基甲苯还原产物[48]。可降解TNT 的需氧型真菌及其代谢途径见表3。
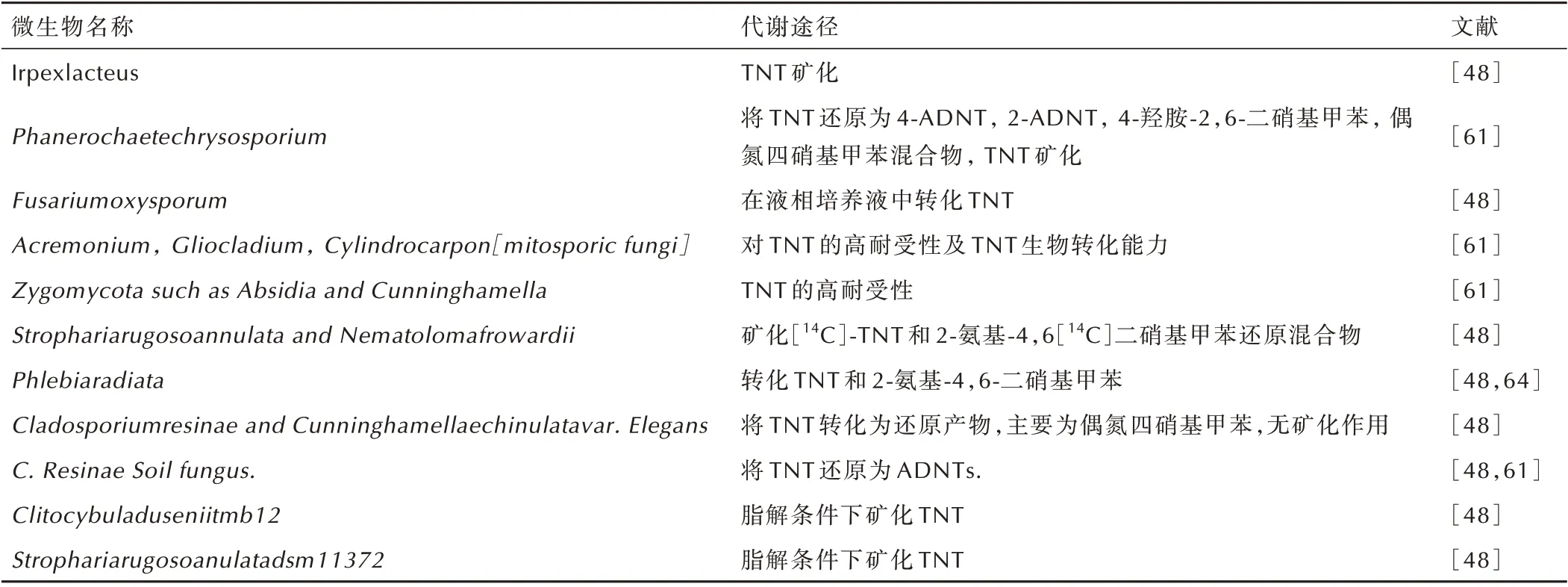
表3 可降解TNT 的真菌及其代谢途径Table 3 TNT degradable fungi and their biodegradation pathway
TNT 的真菌代谢主要形成矿化产物,或部分硝基还原产物。由于真菌普遍具有致病性,不具备实际应用价值。
TNT 微生物转化是除了化学转化外的另外一个重要资源化利用途径。基于微生物种群特有的酶和代谢途径不仅可以实现硝基还原,也能够将TNT 作为氮源、碳源及能量来源参与核心代谢。然而目前可用于TNT降解的微生物种类较少,整体种群分布及可用微生物资源现状研究不足;微观层面,TNT 降解微生物的基因测序及解读、关键代谢途径及相关酶的研究较少;上述因素限制了微生物在TNT 资源化再利用中的应用。
3 总结和展望
综上所述,TNT 多样性的化学转化可将其甲基氧化为羧基、醛基或醇,硝基选择性的还原为氨基,或发生芳基SE1 取代反应得到对应的取代产物。这些氧化、还原、取代反应的一级转化产物也可进一步转化为酰氯、酰胺、亚胺、硝酸酯、烷基胺、氮硫杂芳环、苯酚、苄溴、烯基胺、苯乙烯衍生物、苯甲腈、二聚体HNS 等二级衍生产物,二级衍生产物也还进一步的通过系列转化得到天然产物关键骨架、染料分子等众多功能化的产物。上述转化产物是废旧TNT 资源化再利用的重要中间体或目标产物,其结构多样且很难通过其他原材料获得,为废旧TNT 原子经济性转化提供多种解决方案。
TNT 生物转化途径同样具有多样性,这种多样性不仅体现在数目众多的需氧细菌、厌氧细菌及真菌可耐受TNT 高生物毒性并将其作为能量来源、碳源或氮源进行代谢,还体现在代谢产物的多样性上:大多数需氧细菌虽然不将TNT 作为氮源或碳源参与核心代谢,但可还原TNT 中的部分硝基,产生的NAD(P)+作为重要的电子受体参与ATP 等能量物质的合成并为细菌代谢提供能量,TNT 部分还原产物(如2,6-DA-4-NT、2A-4-NT、4A-2NOC-6-NT 等)通过分子泵排出后可作为代谢产物进行提取,为该类化合物的生物合成提供了解决方案;部分厌氧细菌可将TNT 进行深度还原得到TAT,进一步通过转氨基作用转化为2,4,6-三羟基甲苯后参与TCA 循环,TNT 所包含的碳、氮、氧及硝基所包含的氧化势能均通过代谢为细菌提供能量、氮源及碳源,厌氧细菌的TNT 完全降解能力为TNT 废水处理、TNT 污染土壤净化及以TNT 为营养物质的生物质培养提供了解决方案,具有相对较为广阔的发展前景。
随着废旧TNT 销毁的环保要求日益提升,综合考虑经济性等因素,废旧TNT 的深度资源化再利用将是近几年需重点解决的难题。为此我们对TNT 化学及生物转化未来发展方向做出以下2 点展望:
(1)基于现有合成方法学的TNT 化学转化研究已非常全面,新转化途径依赖于未来合成方法学的突破;整体来说TNT 化学转化将超越实验室研究阶段,面向医药、染料、高分子等领域的TNT 转化产物将在市场需求的牵引下逐步进入中试甚至产业化放大阶段,尤其是TNT 下游转化产物很难通过其他化学途径获得,依托产物自限性的新药研发、新材料拓展及功能材料改性将是应用的重点方向;此外,绿色工艺及安全性研究将是工业化过程的重点;
(2)TNT 微生物转化依旧是实验室研究重点,结合基因工程及现代分子生物学技术的最新进展,基因及蛋白层面的TNT 微生物代谢研究将有望突破菌种限定,基因编辑及体外酶促转化可能为废旧TNT 深度再利用带来新的解决方案。
