低压静电场对凡纳滨对虾多酚氧化酶性质影响
2022-10-18李甜张珊李孟华吴梦兰段昕辰林慧敏
李甜,张珊,李孟华,吴梦兰,段昕辰,林慧敏
(浙江海洋大学食品与药学学院,浙江 舟山 316021)
凡纳滨对虾(Litopenaeus vannamei)是我国经济价值较高的对虾品种之一,其肉质鲜美,营养丰富,深受消费者青睐。但捕捞失活后,凡纳滨对虾体表色素易沉着,即黑变,影响其感官品质。尽管凡纳滨对虾轻微的黑变对健康无害,但却极大地影响了对虾的销售质量。对虾的黑变是由多酚氧化酶(polyphenol oxidase,PPO)将酚类氧化生成醌类,醌类化合物与蛋白质聚合,进一步生成色素导致的[1]。虾内源性多酚氧化酶活性变化与黑变的发展密切相关,因此,有效抑制多酚氧化酶的活性会延缓储藏期间对虾黑变[1]。冷冻储藏可以防止虾黑变,但传统的冷冻方法可能会改变肉组织中水分的含量和分布[2],从而导致大冰晶的形成,虾的品质发生变化,同时解冻产品的脂质和蛋白质也会发生过度氧化[3]。这些变化可能会大大降低虾制品的质量。因此,人们致力于开发新的冷冻方法以达到“冷冻保鲜”的目的,如高压[4]、超声[5]、磁场[6]、等离子体[7]和高压静电场[8],但这些方法往往成本高、不方便、不稳定,短期内难以大规模应用于肉类加工。
近年来,低压静电场已被证明是在冷冻过程中保存食品的有效方法,该方法易于实现,适用于多种食品,且价格低廉[9]。Xie等[10]研究发现在牛扒冷冻过程中施加低压静电场,可以降低牛扒的汁液损失和质构损失。张珊等[11]研究发现,低压静电场通过抑制虾肉中腐败微生物的生成,使对虾pH值与挥发性盐基氮(total volatile base nitrogen,TVB-N)值、蒸煮损失率始终比对照组低,但该研究并未对虾体内的多酚氧化酶进行研究报道。
本文以凡纳滨对虾为研究对象,通过多酚氧化酶性质,如酶活性、表面疏水性、超微量Ca2+-三磷酸腺苷酶(Ca2+-adenosine triphosphatase,Ca2+-ATPase)活性、聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrohoresis,SDS-PAGE)、圆二色谱在两种贮藏条件下的差异性,研究微冻条件下低压静电场对凡纳滨对虾多酚氧化酶酶活性影响。本研究将为低压静电场(low voltage electrostatic field,LVEF)在对虾冷冻贮藏中的应用提供参考。
1 材料与方法
1.1 材料与试剂
鲜活凡纳滨对虾,购于舟山国际水产城,保温箱中加冰充氧,30 min内运送到实验室,立即剔除死亡、不完整的个体后用纯净水冲洗2次,用碎冰将对虾猝死,挑选个体差异不大、肢体完整、体表有光泽的对虾作为研究样品,用冰水(0℃~4℃)清洗后沥干。
SDS-PAGE试剂盒(包括蛋白上样缓冲液、凝胶快速配制试剂):上海碧云天生物技术有限公司;R250考马斯亮蓝染色液:武汉谷歌生物科技有限公司;宽分子量蛋白质Marker:美国Thero Scientific公司;pH8.0的20 mmol/LTris-HCl溶液、固体硫酸铵、pH6.5磷酸盐缓冲液(phosphate buffer solution,PBS)、左旋多巴(levodopa,L-DOPA)、溴酚蓝指示剂(均为分析纯)、Ca2+-ATPase活性试剂、巯基试剂盒、总蛋白试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
BX-2000型静电场装置:浙江驰力科技股份有限公司;Eppendorf 5425R高速冷冻离心机:赛默飞世尔科技(中国)有限公司;PHS-25型酸度计:梅特勒托利多公司;FSH-2型可调高速匀浆机:常州国华电器有限公司;DZF-150真空冷冻干燥箱:郑州长城科工贸有限公司;UV5900紫外可见分光光度计:上海元析仪器有限公司;JASCO-J-720CD光谱偏振仪:北京市六一仪器厂。
1.3 低压静电场装置及试验分组
低压静电场装置:本试验的静电场装置由静电场发生装置和放电板组成,其中静电场发生装置为AC220 V、50/60 Hz,放电板(140 mm×120 mm)在冰箱(-7℃)内产生低压静电场,形成负离子环境,放电板垂直放置,试验样品与放电板平行确保物料不与放电板直接接触,静电场发生装置输出电压为2 500 V、电流为0.2 mA。静电场环境模拟图见图1。
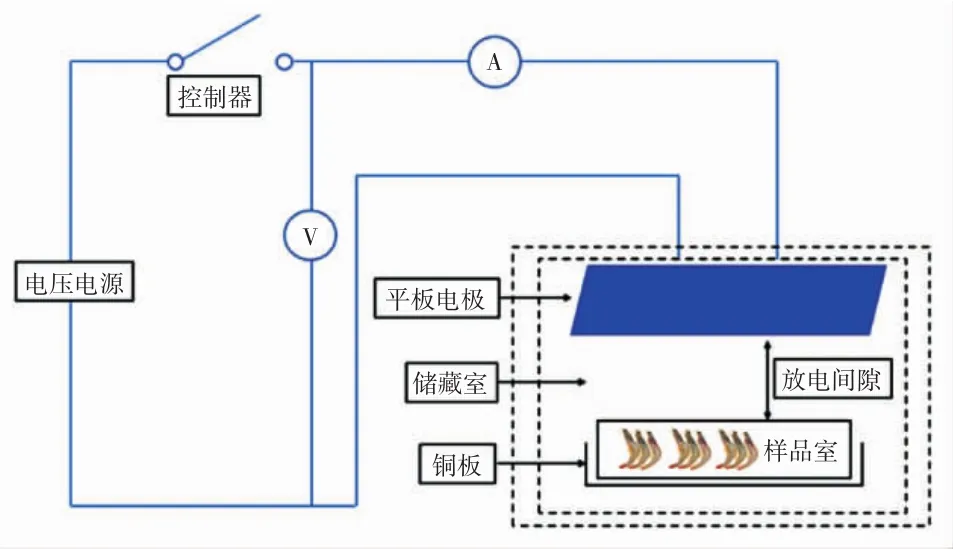
图1 对虾样品在静电场环境中的放置模拟图Fig.1 Simulation of sample placement in LVEF
试验分组:将沥干的对虾样品先装入无菌密封袋中再放入保鲜盒内,一组为在低压静电场条件下贮藏的处理组,即LVEF组;一组为在冰箱中贮藏的对照组(Con组),两组样品储藏温度均为-7℃。将购买虾的当天记做试验第0天,每4 d对虾的各项指标取样检测,试验重复两次、每个重复中各指标分别进行3次检测。
1.4 多酚氧化酶性质研究
1.4.1 多酚氧化酶的制备
参考López-Caballero等[12]的多酚氧化酶的制备方法并略有改动。将LVEF组和Con组的凡纳滨对虾取出,在无菌密封袋封装条件下用流水解冻,至半解冻状态下时,取对虾头部并去除头部外壳,取出完整的脑部组织20 g,用消毒过的剪刀将脑组织剪碎成小块肉粒,按 1∶4(g/mL)向虾脑组织中加入80 mLpH8.0、20 mmol/LTris-HCl,充分混合后在4℃下匀浆10min,然后在冰水中静置3h,冷冻离心25min(4℃,8000r/min),取上清液,上清液中添加固体硫酸铵,(20±2)℃下静置30 min,当饱和度达到40%时,先进行硫酸铵盐析24 h再用20 mmol/LTris-HCl(pH8.0)作为透析液透析12 h,透析过程中每4 h需要更换一次透析液,透析完成后冷冻离心 10 min(4℃,4 000 r/min),所得上清液即为多酚氧化酶粗液,酶液冷冻保存于-80℃冰箱中备用。
1.4.2 酶活性测定
参考Xu等[13]多酚氧化酶活性测定方法并稍作修改。在离心管中加入1.0 mL、15 mmol/L的左旋多巴及pH6.5、1.6 mL、0.05 mol/L的磷酸盐缓冲液,再加入0.4 mL的酶液。充分混合后于37℃的水浴锅中反应3 min,而后在490 nm处测吸光值。根据多酚氧化酶作用于底物释放的物质在490 nm有最大吸光值来计算酶活性值,1 min内能转化1 μmol底物的酶量称为1酶单位(U),用A/(min·mL)表示。
1.4.3 总巯基含量的测定
参照试剂盒说明书测定多酚氧化酶的总巯基含量。
1.4.4 表面疏水性的测定
参考梁慧等[14]多酚氧化酶表面疏水性的测定方法进行测定,在20 μL、1 mg/mL的溴酚蓝溶液中加入2 mL酶液并充分混匀。Con组直接在溴酚蓝溶液加入2 mL的pH8.0、20 mmol/LTris-HCl缓冲液。在室温(20±2)℃下充分振荡10 min后在595 nm处测定其吸光值。表面疏水性的计算公式如下。

1.4.5 总蛋白含量的测定
参照试剂盒说明书测定总蛋白含量。
1.4.6 Ca2+-ATPase活性的测定
参照试剂盒说明书测定多酚氧化酶Ca2+-ATPase活性。以每小时每毫克蛋白中三磷酸腺苷酶(adenosine triphosphatase,ATPase)分解ATP所释放的无机磷的量表示(U/mg prot)。
1.4.7 SDS-PAGE测定
多酚氧化酶首先用SDS-PAGE试剂盒中蛋白上样缓冲液溶解(1∶1体积比混合),然后在95℃水浴下反应20 min。电泳凝胶板厚1 mm,下层胶的质量分数为12%,上层胶的质量分数为5%,每次上样量10 μL。电泳设置的电流为80 mV,电泳时间为3 h,当样品由上层胶进入下层胶界面后立刻将电流调至120 mV。电泳结束后,用预先配制好的0.1%考马斯亮蓝染色液在培养皿中对胶片进行染色,水平摇床染色30 min,用超纯水冲洗3次后用含7%冰醋酸和5%甲醇的脱色液脱色至蛋白条带清晰即可。
1.4.8 圆二色谱的测定
根据Zhou等[15]的方法进行圆二色谱(circular dichromatography,CD)分析。在180 nm~260 nm即远紫外范围内,以1 nm的带宽和50 nm/min速度扫描18 CD光谱。每次处理后24 h内扫描0.2 mL 1.0 mg/mL PPO。所有测得的CD光谱用pH6.5、50 mL磷酸盐缓冲液进行基线校正,PPO二级结构的含量依据Dichroweb网站的SELCON3算法来计算。
1.5 数据分析
所有样品进行3次平行试验,数据用Excel 2007进行处理,数据作图采用Origin 8.5软件。
2 结果与讨论
2.1 LVEF对PPO酶活性的影响
LVEF对PPO酶活性的影响见图2。

图2 LVEF对PPO酶活性的影响Fig.2 Effect of LVEF on polyphenol oxidase activity
由图2可知,两组PPO的酶活性变化趋势相同。随着贮藏时间的延长,都呈先上升后降低再上升的趋势。贮藏0~4 d时小幅度增高,4 d~12 d时Con组酶活性从92.0 A/(min·mL)降为82.3 A/(min·mL),LVEF组从91.4 A/(min·mL)降到84.7 A/(min·mL)。对虾死亡后,体内糖原在无氧环境下发生糖酵解而产生大量酸类物质,pH值下降进而影响了PPO的酶活性[16]。12 d后,PPO酶活性逐渐回升,原因是随贮藏时间的延长而被逐渐激活。在24 d的贮藏试验中,除12 d外,其余贮藏时间Con组酶活性高于LVEF组,这说明LVEF能够有效抑制PPO的活性。
2.2 LVEF对PPO总巯基的影响
LVEF对PPO总巯基含量的影响见图3。
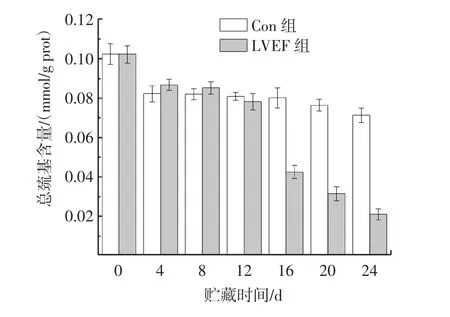
图3 LVEF对PPO总巯基含量的影响Fig.3 Effect of LVEF on the content of thiol in polyphenol oxidase
巯基一般指蛋白质或多肽链上半胱氨酸残基上的巯基基团,它在维持蛋白质活性和蛋白质结构的稳定上有重要作用。图3显示,随着贮藏时间的延长,两组样品的总巯基含量整体呈下降趋势。其中Con组PPO的总巯基含量从初始0.102 4 mmol/g prot到贮藏结束时下降到0.071 5 mmol/g prot,LVEF组的PPO的总巯基含量从初始0.102 4 mmol/g prot到贮藏结束时下降到0.021 1 mmol/g prot,分别下降了30.18%和79.39%,LVEF组的PPO的巯基含量下降更明显。
在体内或者人工环境条件下,蛋白质或多肽链上巯基和二硫键会相互转化,这种转化在一定程度上反映了蛋白质高级结构的折叠和去折叠的互相转化。由图3可知,LVEF组样品的巯基含量在整个贮藏过程中下降速度比Con组快,其原因可能是低压静电使得原本在PPO内部的活性巯基基团因蛋白酶空间折叠和去折叠构象的转变而被暴露于表面,激化了化学反应从而导致巯基含量显著下降[17]。Jia等[18]在用高压静电场(high voltage electrostatic field,HVEF)解冻猪肉时发现,HVEF组比对照组猪肉的肌原纤维蛋白的巯基含量明显减少。这也显示电场环境下蛋白空间构象发生改变进而使巯基含量改变。
2.3 LVEF对PPO表面疏水性的影响
蛋白表面疏水性是对蛋白质细微结构变化的一个敏感测量指标,被用于进一步评估蛋白质构象的稳定性。在LVEF条件下凡纳滨对虾PPO表面疏水性的变化如图4所示。
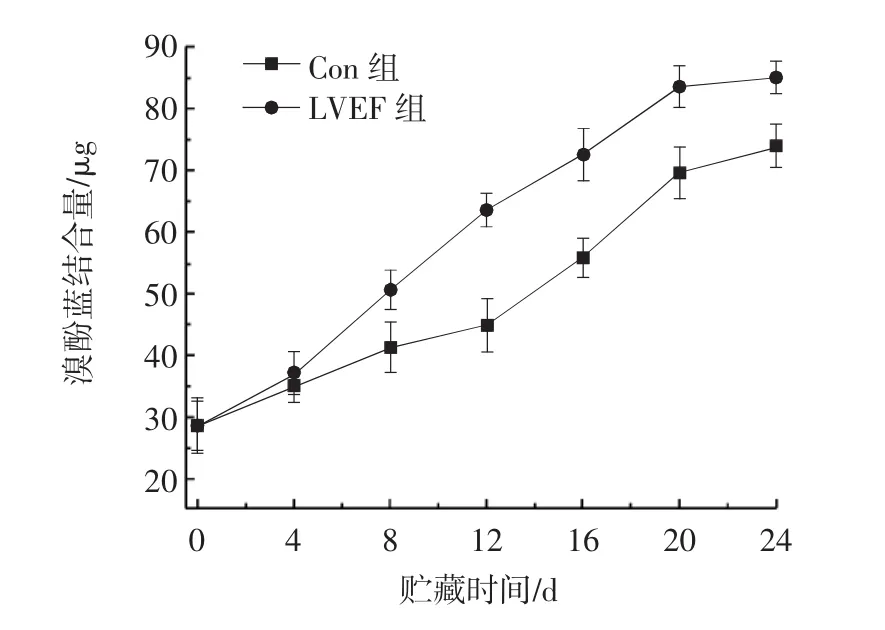
图4 LVEF对PPO表面疏水性的影响Fig.4 Effect of LVEF on the surface hydrophobicity of PPO
图4显示,在冷冻处理条件下,PPO分子被展开和拉伸,空间结构变得松散,因此随着贮藏时间的延长,两组样品的表面疏水性均呈上升趋势。经过24 d的贮藏,其中Con组对虾样品PPO表面疏水性从初始值的28.47 μg升高到 73.90 μg,而LVEF组对虾样品PPO表面疏水性则由初始值28.47 μg升高到85.10 μg,LVEF组升高较Con组明显。在贮藏过程中因腐败微生物代谢和生化反应使蛋白质变质,构象破坏,蛋白质内部的疏水基团暴露,导致疏水性增加。而LVEF组的表面疏水性上升较Con组高的原因可能是静电场释放O3会使得蛋白质的表面疏水性增加。
2.4 LVEF对PPO总蛋白的影响
总蛋白含量是反映蛋白质变性程度的一个重要指标。对虾在冷冻贮藏期间,腐败微生物代谢及生物内源酶会使对虾体内蛋白质被逐渐分解,蛋白质的构象被破坏,因此总体蛋白含量下降。LVEF对PPO总蛋白的影响见图5。
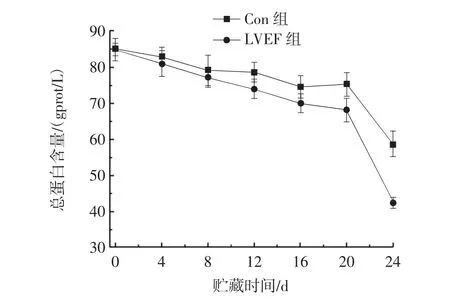
图5 LVEF对PPO总蛋白的影响Fig.5 Effect of LVEF on total protein of polyphenol oxidase
图5显示,在24d的贮藏期间,两组的总蛋白含量均呈下降趋势,但Con组总蛋白含量下降速率较LVEF组更缓慢。LVEF组的总蛋白含量由初始值84.88 gprot/L降为42.48 gprot/L,Con组由84.81gprot/L降为58.87gprot/L。说明LVEF对于PPO的蛋白变性具有促进作用。贮藏20 d后,LVEF处理加速了PPO的变性,蛋白质变性成为总蛋白含量下降的主要原因,导致总蛋白呈“断崖式”下降。
2.5 LVEF对PPO的Ca2+-ATPase活性的影响
不同贮藏方式下的PPO中Ca2+-ATPase活性差异如图6所示。
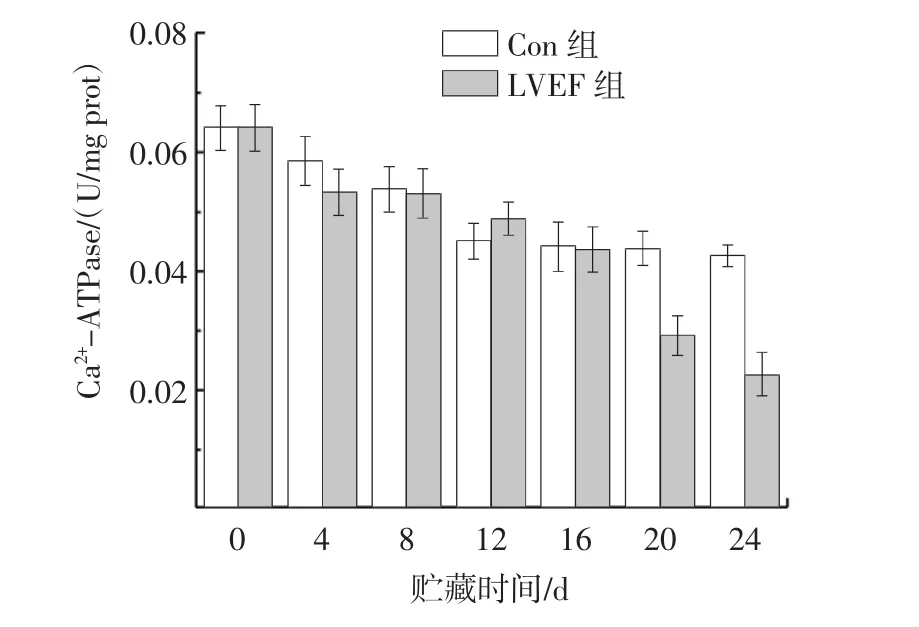
图6 LVEF对Ca2+-ATPase的影响Fig.6 Effect of LVEF on Ca2+-ATPase
由图6可知,LVEF组的Ca2+-ATPase活性初始值为 0.064 2 U/mg prot,24 d 后仅为 0.022 7 U/mg prot;Con组的Ca2+-ATPase活性初始值为0.064 2U/mg prot,24 d后为0.042 8 U/mg prot。两组在前期下降速度缓慢,但贮藏20 d时,Con组的Ca2+-ATPase下降速率较稳定,而LVEF组则下降明显,说明贮藏后期蛋白质变性程度加剧,这与总蛋白含量的研究结果一致。Ca2+-ATPase活性可作为蛋白质的变性指标,说明了LVEF会加速PPO蛋白变性。Huang等[8]研究发现,电场可以降低酯酶的活性,维持产品的质量。
2.6 SDS-PAGE测定结果
PPO在两种条件下贮藏的SDS-PAGE电泳结果如图7所示。

图7 SDS-PAGE分析结果Fig.7 SDS-PAGE analysis results
由图7的SDS-PAGE可知,PPO分子质量约为210 kDa,这与 Nirmal等[19]结论相似。在 8、16、24 d 贮藏期间,LVEF组与Con组相比,各条带色度和宽度均没有出现明显变化,即没有观察到PPO的降解。各组及各贮藏期间PPO分子质量都在210 kDa,说明LVEF并不是通过降解PPO蛋白分子来影响酶活性。Xie等[17]在用LVEF解冻牛肉试验研究中也发现,LVEF不会影响蛋白分子质量。
2.7 PPO圆二色谱分析
PPO圆二色谱分析见图8,多酚氧化酶二级结构比例见表1。
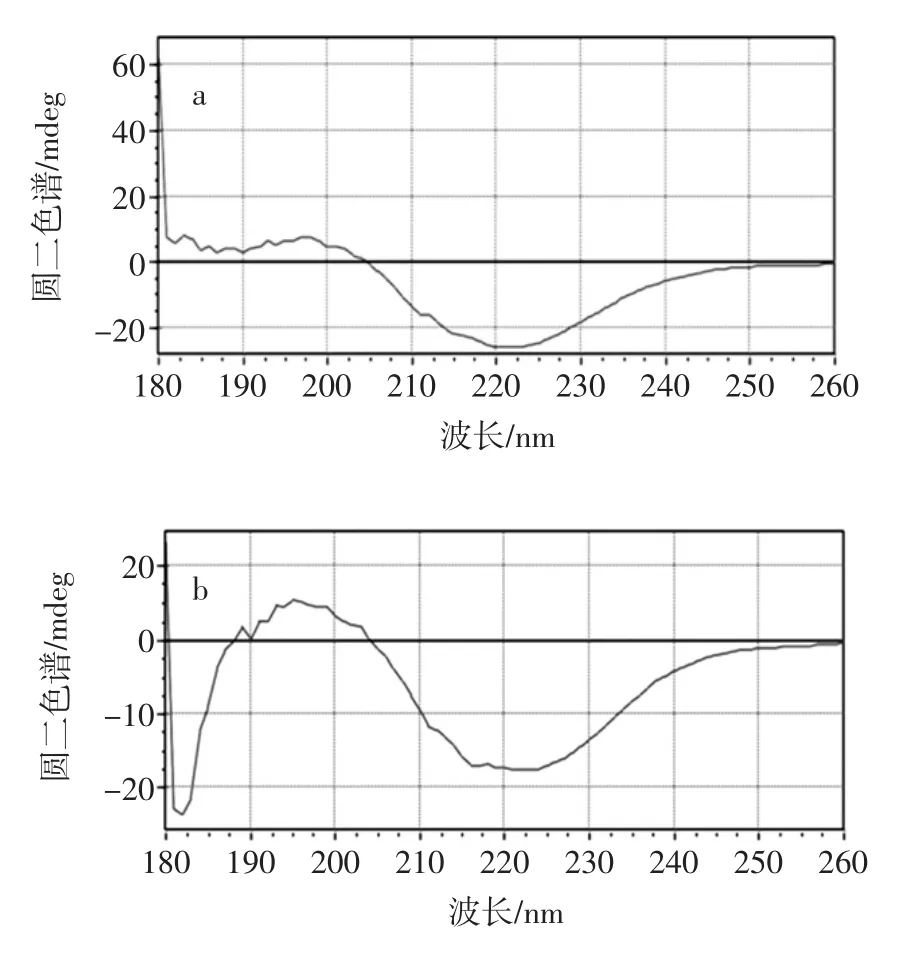
图8 多酚氧化酶圆二色谱分析Fig.8 Circular dichroism analysis of PPO
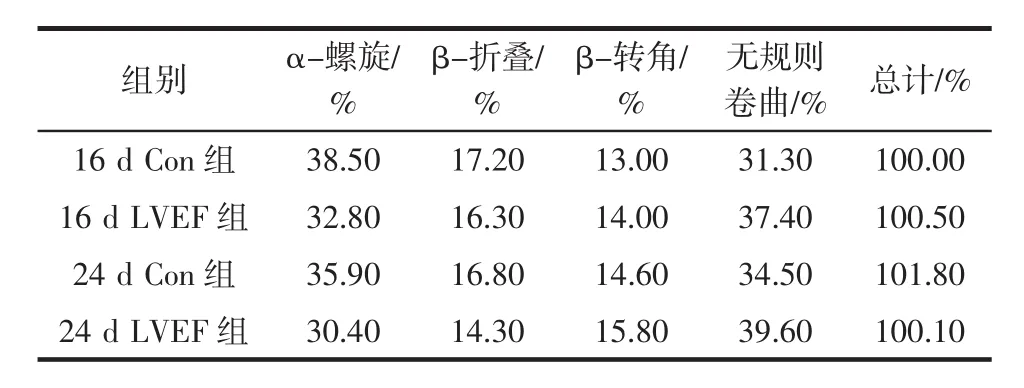
表1 多酚氧化酶二级结构比例Table 1 Secondary structure analysis of polyphenol oxidase
圆二色谱中180 nm~260 nm的远紫外区可以反映蛋白质主链构象的光活性基团的肽键的分布区。α-螺旋和β-折叠结构反映的是蛋白质分子的有序性,而β转角和无规则卷曲等则体现了蛋白质分子的无序性[20]。
由图8可知,α-螺旋、β-折叠和无规则卷曲构象的CD谱的线性叠加,两组色谱图均在220 nm处具有负峰,这是α-螺旋结构的特征吸收峰,说明PPO中有多种构象并存,并以α-螺旋结构为主。
由表1可知,LVEF处理后的PPO的α-螺旋及β-折叠含量减少,β-转角及无规则卷曲含量相对增高,表明LVEF通过改变PPO的二级结构α-螺旋、β-折叠比例改变酶活性。
3 结论
本研究考察了LVEF对凡纳滨对虾PPO性质的影响。除12 d外,其余贮藏时间LVEF组PPO酶活性低于Con组,两组样品的总巯基、总蛋白含量和Ca2+-ATPase活性总体呈下降的趋势,但LVEF组样品下降更为明显,这说明LVEF有促进PPO蛋白变性的作用;SDS-PAGE显示PPO的分子量未发生明显变化,这说明LVEF并不会断裂PPO的分子链;CD谱和表面疏水性的检测结果显示LVEF可能是通过改变PPO的二级结构来影响酶的活性。试验结果发现,LVEF在凡纳滨对虾的微冻保鲜过程中可以通过抑制PPO酶的活性延长产品货架期,这对于对虾的储运销售具有指导意义,并为对虾产品的储运保鲜提供了新的思路。
