一株利福平高耐受鸭疫里默氏杆菌的分离鉴定及基因组分析
2022-09-23刘玲俐赵亚楠靳亚洁祁晶晶田明星王少辉于圣青
刘玲俐,赵亚楠,靳亚洁,祁晶晶,田明星,王少辉,李 涛,于圣青
(中国农业科学院上海兽医研究所,上海 200241)
自1932年美国分离出第一株鸭疫里默氏杆菌(Riemerella anatipestife, RA)后[1],世界各国都陆续报道了该菌的感染病例,目前RA已经成为影响我国乃至世界家鸭养殖业的重要细菌性病原体之一。随着2012年首个鸭疫里默氏杆菌ATCC 11845基因组的发表,至今为止,美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)已经收录了57个RA的基因组遗传信息,其中有14个是完整的全基因组序列。通过对基因组进行生物信息学分析,可以提高人们对细菌形态结构、代谢、致病性、耐药性等分子机制认识。
另一方面,由于RA血清型众多,且各血清型之间交叉保护性差,造成商业化疫苗防控效果不明显,因此,现阶段,使用抗生素是防治RA的主要方法之一。利福平由于具有较好的对细菌杀伤作用,而在养殖场得到广泛使用,但是近年来流行病学调查结果显示,RA利福平耐药菌株分离率逐年上升,但现有研究文献多偏重耐药表型分析,对于利福平高耐受RA的基因组分析,鲜见报道。本研究对一株来自安徽某家鸭养殖场分离的利福平耐药株进行了菌种鉴定、血清型分析、药敏测试、基因组分析等,以期为RA利福平耐药机制研究提供理论基础。
1 材料与方法
1.1 病料与菌株来源 病料采集于安徽某家鸭养殖场,CH3、Yb2、HXb2等菌株由本实验室保存。
1.2 主要试剂 胰蛋白大豆肉汤(Tryptic Soy Broth,TSB)购自美国Becton Dickinson公司;细菌基因组DNA提取试剂盒购自天根生化科技(北京)股份有限公司;利福平(纯度:97%)购自上海Aladdin生化科技股份有限公司;微生物药敏试纸:利福平、头孢唑肟、氟苯尼考、多西环素、红霉素、林可霉素、大观霉素、恩诺沙星、四环素、青霉素、氨苄西林、新霉素、链霉素、诺氟沙星、多粘菌素B、氯霉素购自温州市康泰生物科技有限公司。
1.3 主要仪器与设备 PCR仪购自美国Applied Biosystems公司;核酸电泳仪及全自动凝胶成像系统均购自上海天能科技有限公司;二氧化碳培养箱及Nano-Drop N1000分光光度计均购自美国Thermo公司。
1.4 细菌分离、纯化及保存 无菌采集病鸭的心脏、肝脏、脾脏、脑等组织器官,研磨处理,划线接种于TSA固体培养基,置于37℃、5%CO2恒温培养箱培养1~3 d,挑取固体培养基上的单菌落,接种于TSB液体培养基,置于37℃、220 rpm的摇床中培养12~16 h,取菌液划线接种于TSA固体培养基,连续三次划线,挑单菌进行扩大培养。将获得的单菌菌液,添加终浓度为25%~30%的甘油,置于-80℃冰箱冻存备用。
1.5 细菌基因组的提取 将单菌的纯培养物以1∶100的比例接种于TSB液体培养基,置于37℃、220 rpm的摇床中振荡培养12 h。按照细菌基因组DNA提取试剂盒的操作说明书,提取基因组DNA,用Nano-Drop N1000分光光度计测定DNA的浓度。
1.6 细菌种属鉴定 根据不同血清型RA共有的保守基因:16S rRNA、ompA和groEL设计引物(表1),以CH3菌株为阳性对照,采用三重PCR鉴定RA[2]。PCR扩增体系(20 μL)如下:2×TaqPCR Master Mix 10 μL,上、下游引物各1 μL,基因组DNA 1 μg,ddH2O补足至20 μL。PCR扩增程序如下:94℃预变性4 min;94℃变性40 s,52℃退火40 s,72℃延伸1 min,共30个循环;72℃再延伸10 min。用凝胶成像仪扫描1%琼脂糖凝胶电泳后的PCR产物,胶回收产物送至上海擎科生物有限公司进行测序。
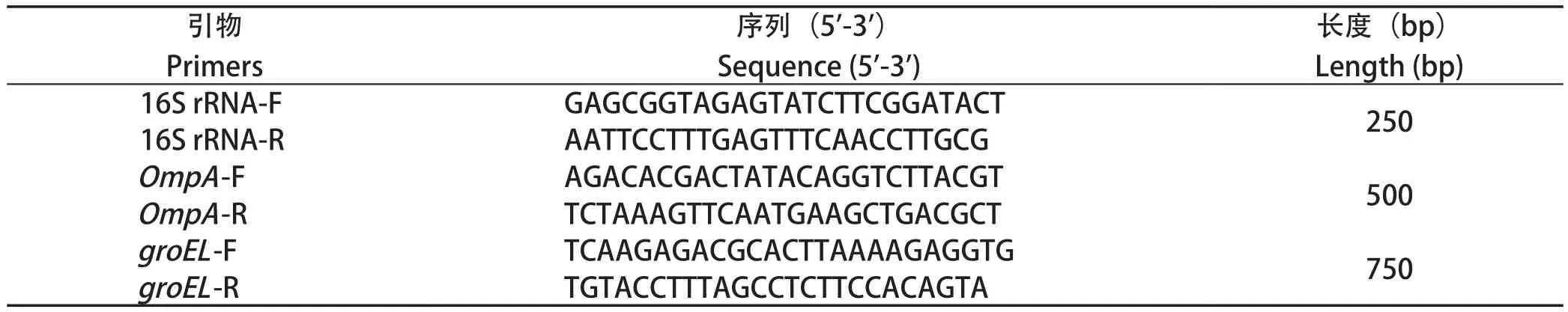
表1 本研究中所用的引物Table 1 Primers used in this study
1.6 细菌血清型鉴定 复苏冻存于-80℃的RA-WH9,用一次性接种环划线接种于TSA固体培养基,置于37℃、5%CO2的恒温培养箱,静置培养1~3 d。取RA血清型1型、2型、10型鸭抗血清各一滴分别滴于干净玻片上,再用一次性接种环挑取RA-WH9菌落,混匀于不同血清型的鸭抗血清中,室温静置片刻后,通过观察是否有凝集现象的发生,从而对分离菌的血清型进行鉴定。
1.7 细菌药敏实验 药敏实验按CLSI2018版本推荐的K-B纸片扩散法及微量肉汤稀释法进行,K-B纸片扩散法判断标准参照CLSI2018。由于目前RA利福平耐药折点未确定,因此参照Sun等[3]研究设定RA利福平MIC>0.5 μg/mL为利福平耐药。
1.8rpoB基因突变分析 以RA-rpoB-F:ATGAATAA GAACATCATATTTGCC、RA-rpoB-R:TTTCAA TCTATCTATCGTATTATCC为引物,分别扩增CH3、Yb2、HXb2、RA-WH9的rpoB基因。PCR扩增体系(50 μL):基因组DNA 1 μg,RA-rpoB-F 1 μL,RA-rpoB-R 1 μL,2×PrimeSTAR Max 25 μL,ddH2O补足至50 μL。PCR扩增程序采用三步法:98℃预变性2 min;98℃变性10 s,55℃退火15 s,72℃延伸70 s,共35个循环;72℃再延伸10 min。用凝胶成像仪扫描1%琼脂糖凝胶电泳后的PCR产物,胶回收产物送至上海擎科生物科技有限公司进行测序,比对测序结果,分析rpoB基因的突变位点。
1.9 生长曲线测定 复苏冻存于-80℃的菌种保存液,划线接种于TSA固体培养基,置于37℃、5%CO2恒温培养箱,静置培养1~3 d,挑取TSA固体培养基上的单菌落接种于TSB液体培养基,置于37℃、220 rpm的摇床中,震荡培养至OD600值为1.0,1∶100比例转接于含有150 mL TSB液体培养基锥形瓶中,置于37℃、220 rpm的摇床中,震荡培养18 h,每隔2 h取800 μL菌液测定OD600值并记录(实验重复3次)。最后用GraphPad Prism 6.02绘制菌株在体外的生长曲线,以CH3、Yb2、HXb2等RA代表株作为参照株。
1.10 细菌全基因组测序和组装 利用MiSeq测序平台对分离菌基因组DNA进行测序。通过使用两个独立的基因组文库:Illumina HiSeq小片段文库及PacBio 20 kb文库,采用鸟枪法进行测序。用短序列组装软件SOAPdenovo2和组装软件Canu、SPAdes等对lllumina和PacBio平台的测序结果进行联合组装,最终获得该分离株的全基因组序列。
1.11 细菌基因预测与注释 利用Glimmer、GeneMarkS、Prodigal软件对ORF进行预测,使用GeneMarkS预测质粒基因组,利用tRNAscan-SE v2.0软件对基因组中包含的tRNA进行预测,利用Barrnap软件对基因组中包含的rRNA种类、位置、序列信息进行预测,利用Tandem Repeats Finder软件进行串联重复序列位置、重复次数、核酸组成等信息预测,通过NCBI非冗余蛋白数据库(Non-Redundant Protein Database,NR)、EBI非冗余基因数据库Swiss-Prot和Pfam数据库,对ORF进行功能注释,利用COG数据库对蛋白质的同源基团进行功能分类,利用GO数据库(Gene Ontology)进行基因聚类分析,通过IslandViewer预测基因组岛(Gene Ilands, GIs),使用CGView软件绘制基因组图谱。
2 结果
2.1 细菌的分离与鉴定 经纯化培养后,分离菌株在TSA固体培养基上呈半透明、露滴样的圆形菌落。采用三重PCR扩增RA保守基因:16S rRNA、ompA和groEL基因。结果表明,该菌株可扩增到RA 16S rRNA、ompA和groEL基因片段,大小分别为250 bp、500 bp和750 bp,与预期结果相符(图1),胶回收PCR产物并送测序。结果表明,PCR扩增出了RA的特征条带,可判定该菌为鸭疫里默氏杆菌,将其命名为RA-WH9。
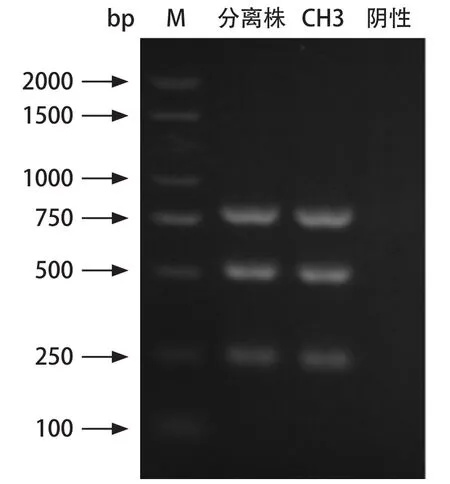
图1 PCR扩增鉴定结果Fig.1 The result of PCR amplification
2.2 血清型鉴定结果 玻片凝集实验结果显示,室温静置片刻后,RA-WH9与血清型1型鸭抗血清出现清晰的凝集颗粒,与血清型2型鸭抗血清、血清型/10型鸭抗血清无明显凝集现象,因此确定RA-WH9为血清型1型分离菌株。
2.3 药敏实验结果 K-B纸片法结果显示,RA-WH9对头孢唑肟、氯霉素、氟苯尼考、多西环素、红霉素和林可霉素敏感;对大观霉素、恩诺沙星和四环素中度敏感;对青霉素、氨苄西林、新霉素、链霉素、诺氟沙星、多粘菌素B和利福平耐药。微量肉汤稀释法表明RA-WH9对利福平的MIC>50 μg/mL,CH3、Yb2、HXb2对利福平的MIC<0.1 μg/mL。
2.4rpoB基因突变分析结果 研究表明病原菌对利福平的耐药性通常是由靶位点基因rpoB突变所导致[4],因此我们将RA-WH9rpoB基因与对利福平敏感的CH3、Yb2、HXb2做了多重序列比对。结果表明,rpoB氨基酸序列与Yb2、HXb2有2个位点氨基酸不同,与CH3有5个位点氨基酸不同,而Yb2、HXb2 rpoB氨基酸序列则完全相同(表2)。
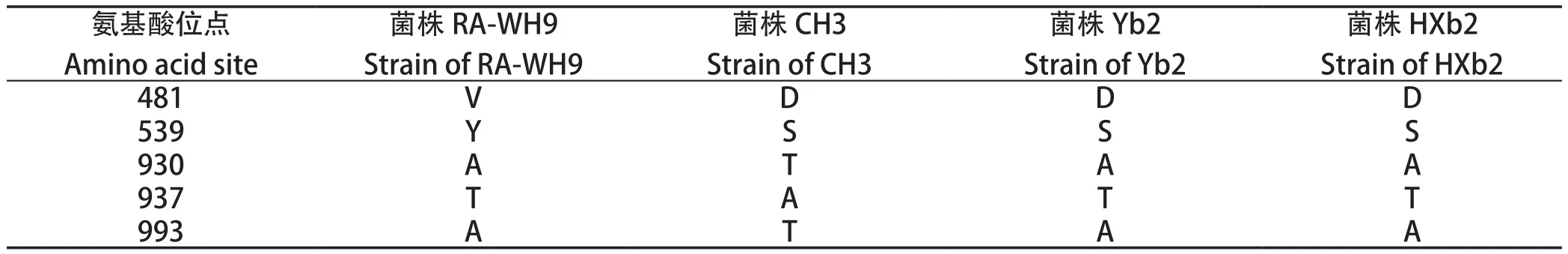
表2 RA-WH9与 CH3、Yb2、HXb2 rpoB氨基酸差异Table 2 rpoB amino acid differences among RA-WH9, CH3, Yb2 and HXb2
2.5 生长曲线测定结果 生长曲线测定结果表明,在体外培养的条件下(相同培养基,无药物选择压力),利福平敏感株CH3、Yb2、HXb2之间的生长速率无明显差异,但利福平耐药株RA-WH9的生长速率小于利福平敏感株CH3、Yb2、HXb2(图2)。
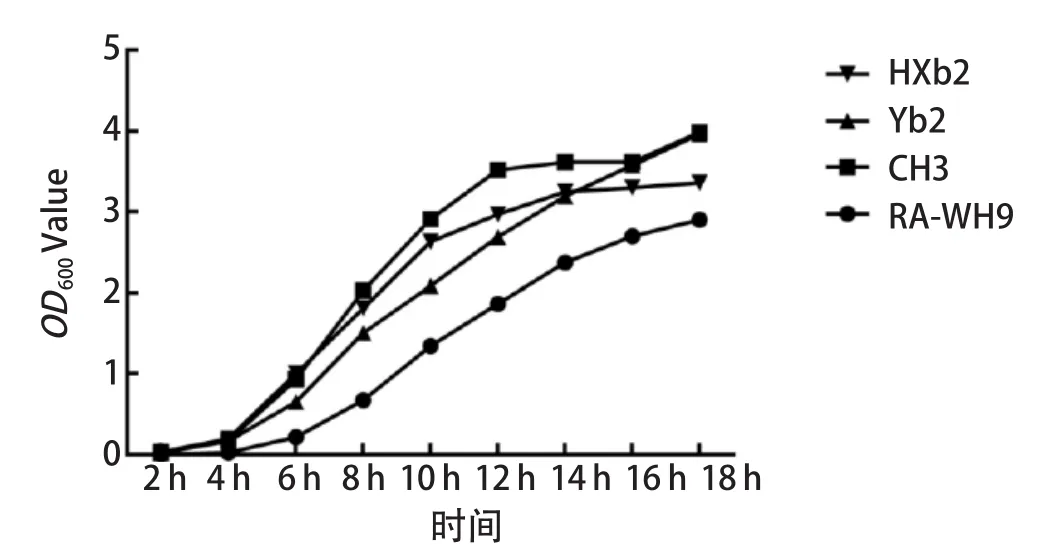
图2 RA-WH9和 CH3、Yb2、HXb2生长曲线Fig.2 Growth curves of CH3, Yb2, HXb2 and RA-WH9
2.6 基因组分析
2.6.1 基因组组分分析 RA-WH9携带一个染色体及一个质粒,染色体包含2 488 018个碱基对,GC含量34.58%。多重基因组比对结果表明,RA-WH9染色体与HXb2、RA-CH-1、RCAD0133染色体结构最为接近(图3)。ORF预测结果表明,RA-WH9染色体共编码2563个基因,总长度为2 223 315 bp,占基因组的88.98%,GC含量35.24%,平均每个基因的长度为867.476 bp,其中有1805个基因的长度小于1000 bp,758个基因的长度大于1000 bp,编码3套16S-23S-5S核糖体rRNA操纵子,41个tRNA,36个串联重复序列,250个转运蛋白,420个跨膜蛋白。
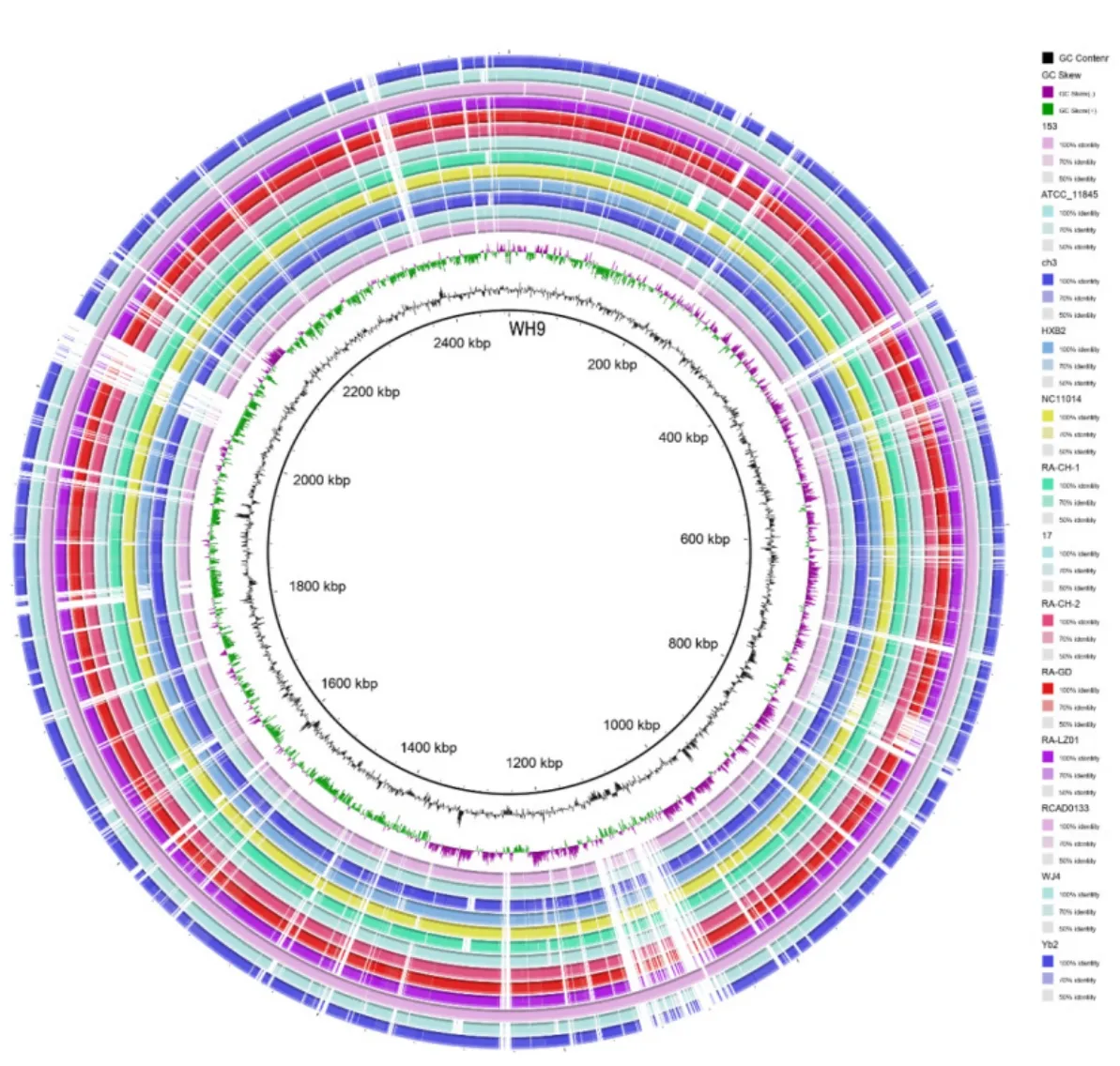
图3 多重基因组比对圈图Fig.3 Multiple genomic alignment map
2.6.2 COG数据库注释 COG数据库分析结果表明,RA-WH9基因组包括20个功能类别,其中505个基因与新陈代谢有关,329个基因与细菌分裂繁殖相关,562个基因与染色体结构和稳定性相关(图4)。
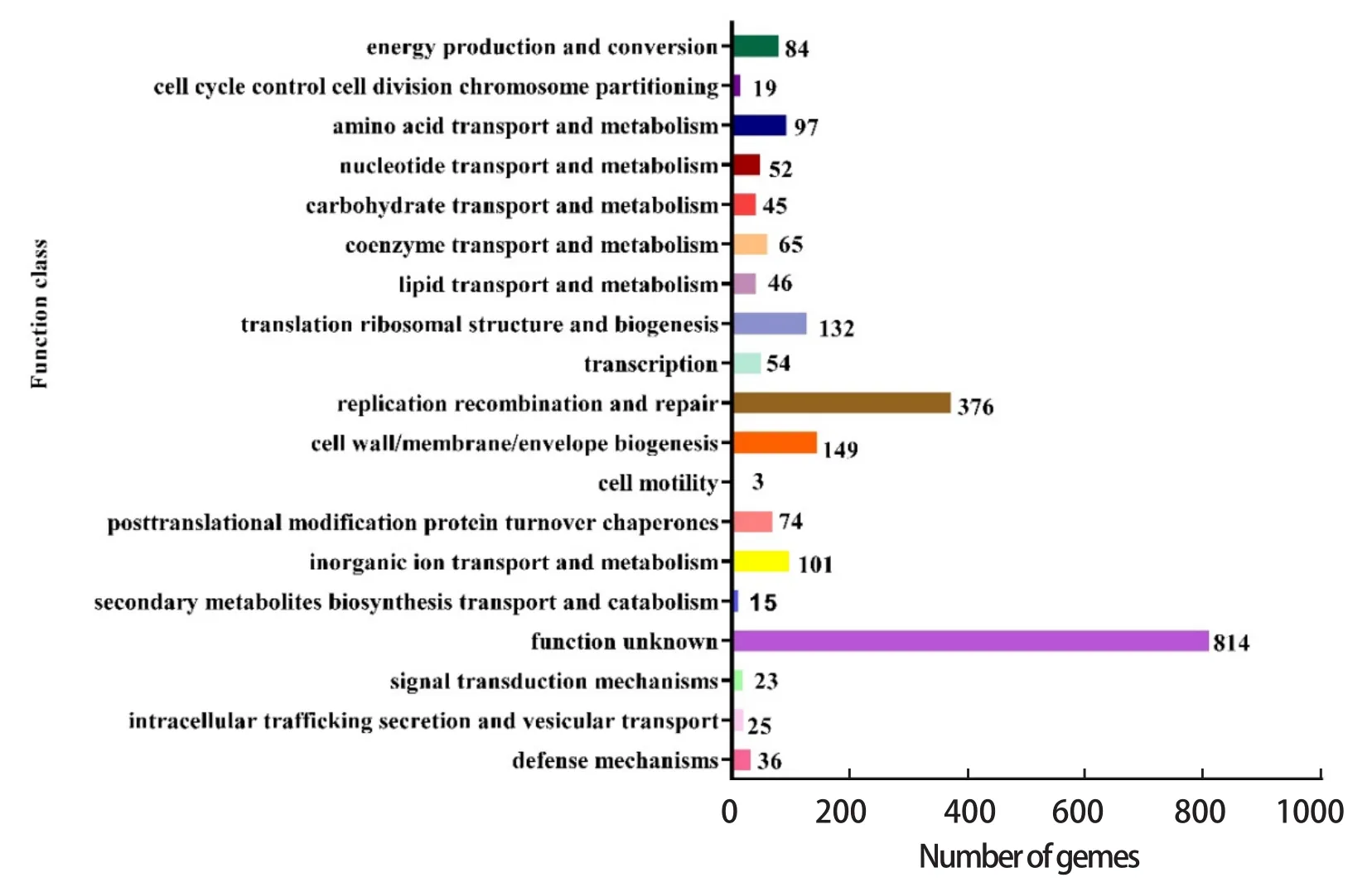
图4 COG注释分类统计Fig.4 COG annotation classification statistics
2.6.3 GO数据库注释 GO数据库分析结果表明,RAWH9染色体共有1697个基因获得GO注释,占全部基因的66.21%,根据GO注释中功能的不同,可将这1697个基因分为三大类,其中与细胞组分相关的基因有749个,与分子功能相关的基因有1407个,与生物过程相关的基因有1243个(图5)。
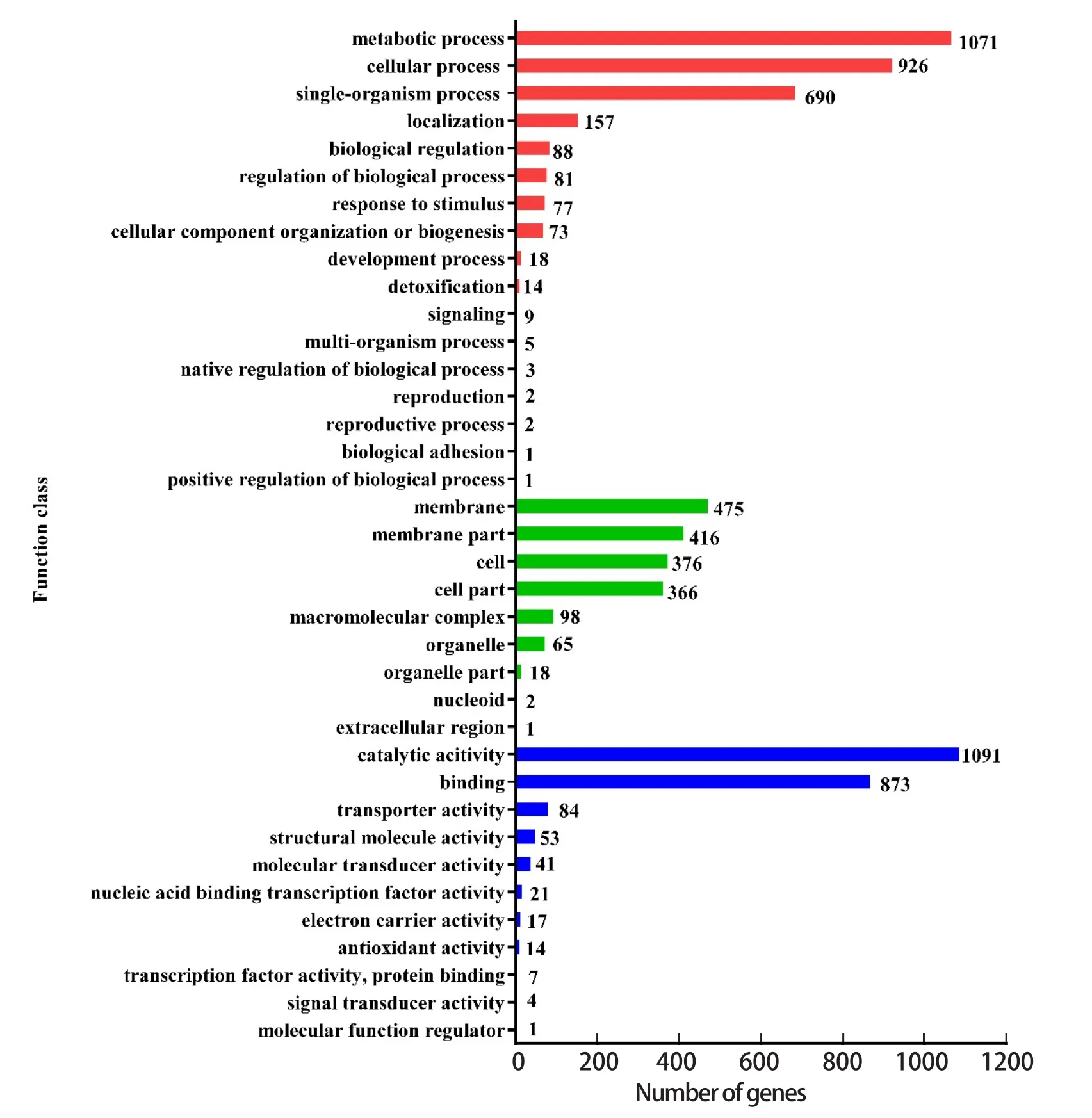
图5 GO注释聚类分析Fig.5 Gene distribution based on GO classification
2.6.4 KEGG数据库注释 为了进一步研究每个基因在各种代谢途径中所发挥的作用,我们使用KEGG数据库,进行了基于pathway的分析。分析结果表明,共有1313个基因获得KEGG注释,占全部基因的51.23%,分布于39个信号通路(图6)。
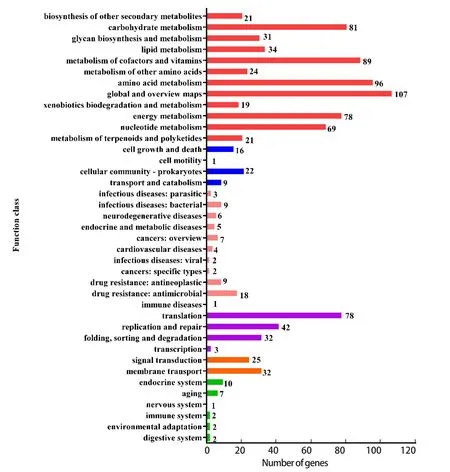
图6 KEGG通路分类统计图Fig.6 Classification statistics of KEGG pathway
2.6.5 毒力基因分析 RA-WH9毒力基因分析结果表明,RA-WH9基因组编码128个与毒力有关的基因(表3)。进一步分析表明,该菌含有Ⅳ型菌毛,且携带有三种类型的分泌系统:Ⅲ型分泌系统、Ⅵ型分泌系统、Ⅶ型分泌系统。

表3 RA-WH9的毒力基因预测分类统计表Table 3 Statistical table of virulence gene prediction of RA-WH9
2.6.6 耐药基因分析 RA-WH9耐药基因分析结果表明,RA-WH9基因组共编码88个耐药基因,主要包括:四环素、磷霉素、异烟肼、多粘菌素、利福平、甲氧苄氨嘧啶、莫西霉素、莫匹罗星、氨基香豆素、氟喹诺酮类抗生素、糖肽类抗生素、吡嗪酰胺、林可酰胺类抗生素、链球菌素、β-内酰胺类抗生素、磺胺类抗生素、糖肽类抗生素、脂肽类抗生素等,与RA-WH9药敏实验的结果较一致(图7)。此外,RA-WH9染色体中还携带多种可导致非特异性耐药的基因,可通过外排泵的泵出作用、基因盒的整合作用、灭活酶的产生、细胞膜通透性的改变等方式产生耐药性。
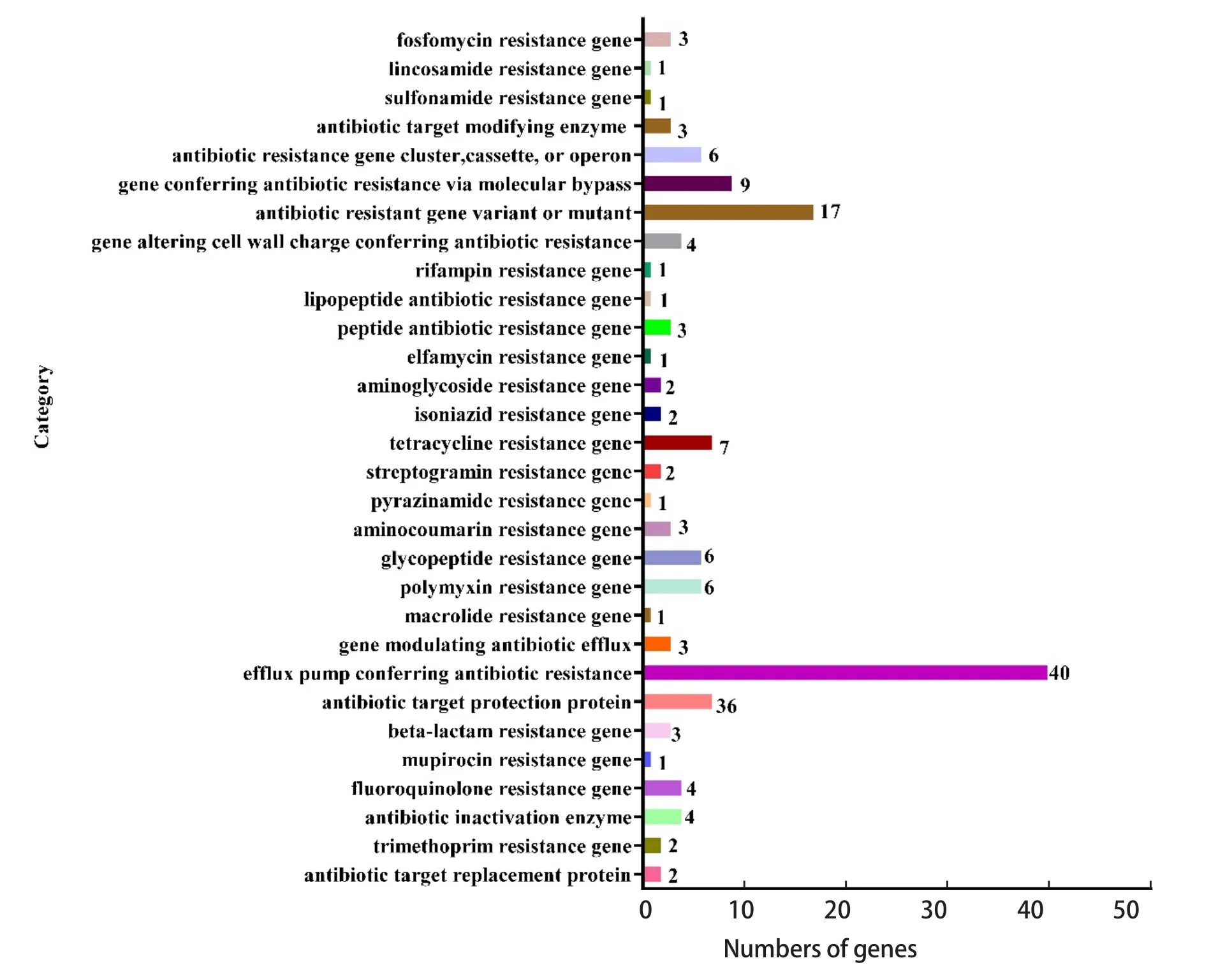
图7 耐药基因分类统计图Fig.7 Classification statistics of drug resistance gene
2.6.7 基因组岛分析 携带有多种功能基因的基因组岛,是水平转移元件中最为重要的一种形式,根据携带的功能基因,可将基因组岛分为共生岛、毒力岛、耐药岛及代谢岛等[5]。基因组岛长度一般为10~100 kb,携带功能基因、整合酶及质粒接合相关的因子等,其携带的基因通常能够给病原菌带来选择优势[6]。
利用IslandViewer对RA-WH9基因组,进行基因组岛分析,我们发现RA-WH9基因组共含有19个基因组岛(表4),其中GI03是毒力岛,GI01、GI02、GI04、GI05、GI06、GI07、GI10、GI13、GI17、GI19是代谢岛,GI-16既是毒力岛又是耐药岛,携带有毒素因子基因relE及四环素类药耐药基因tetX[7]。此外,分析结果还表明,GI03基因岛中携带有一个血凝素基因,血凝素具有免疫原性,在病原菌导入宿主细胞的过程中发挥着重要的作用[8];GI14基因组岛含有2个编码冷休克蛋白的基因,冷休克蛋白不仅参与宿主冷休克反应和低温胁迫,也是宿主正常生长和分化所必需重要基因之一[9]。
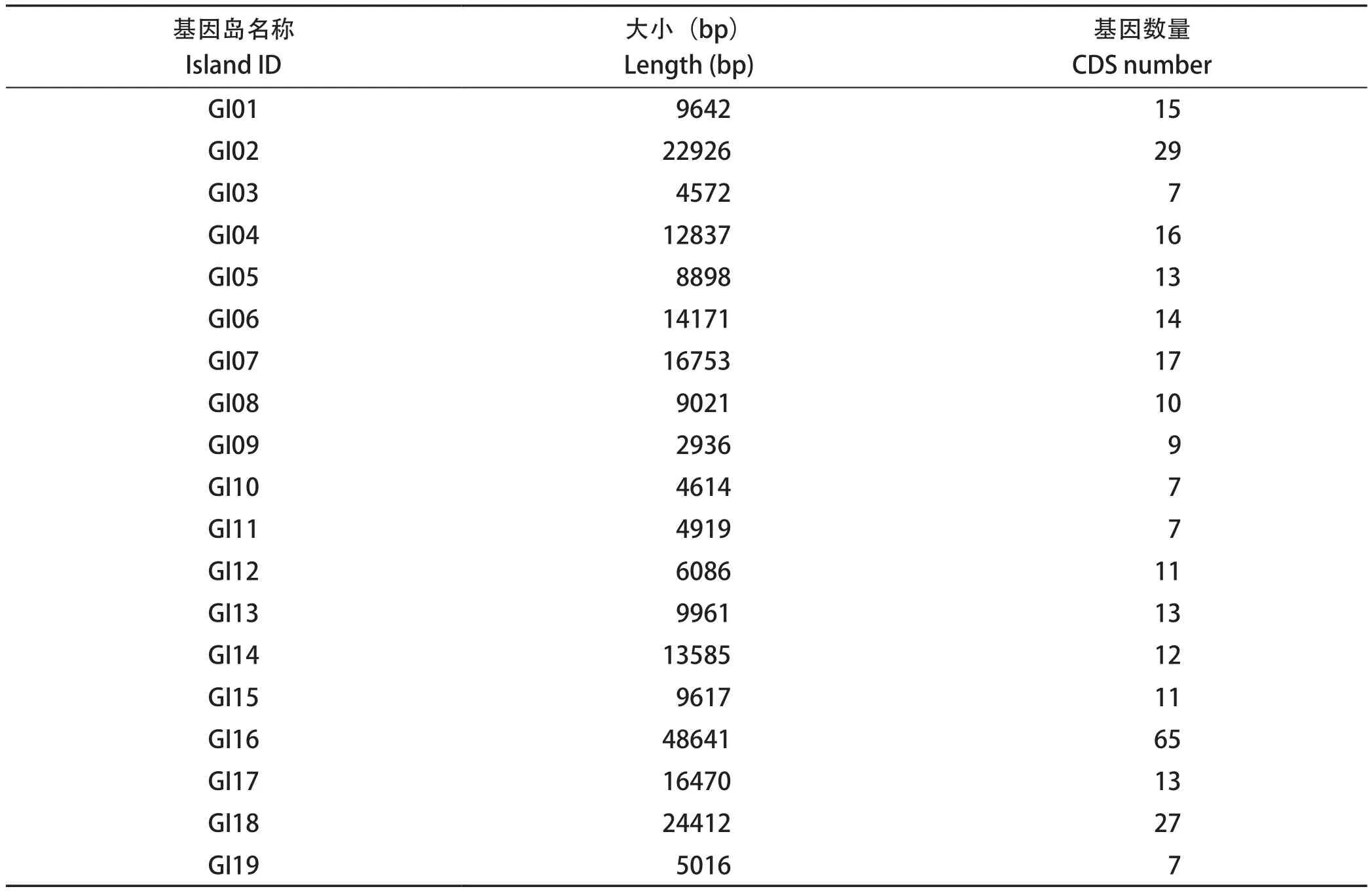
表4 基因组岛详情Table 4 Genomic island details
2.6.8 RA-WH9的进化分析 为了分析RA-WH9与其他鸭疫里默氏杆菌的亲缘关系,我们构建了一个基于16S rRNA的NJ系统发育树。结果表明,RA-WH9和鸭疫里默氏杆菌P-2123、RCAD0133遗传距离最近(图8)。
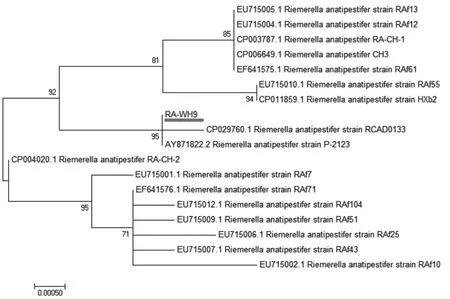
图8 基于16S rRNA的进化分析Fig.8 Evolution analysis based on 16S rRNA
3 讨论
RA是世界家鸭养殖业重要病原菌之一,迄今为止,国内外报道RA的流行血清型超过21种,且不同血清型菌株之间缺乏有效的交叉保护[10],给RA防治带来很大困难,因此,抗生素是现阶段防治RA的主要手段之一。然而,由于养殖业长时间、超范围的使用抗生素,导致RA耐药问题越来越严重,临床耐药菌株分离率逐年上升[11]。程冰花等[12]对2017-2018年在安徽地区分离的37株RA进行耐药分析,发现所有分离菌均对卡那霉素、庆大霉素、链霉素、丁胺卡那、多粘菌素B耐药,超过90%的分离菌对阿莫西林、新霉素、红霉素、阿奇霉素、林可霉素耐药。朱元军等[13]检测南方地区分离的120株RA对16种抗生素的敏感性,发现超过90%的菌株对庆大霉素、链霉素、丁胺卡那,卡那霉素耐药,7重及以上耐药菌株占比高达97.5%。但现有研究多局限于流行病学调查,较少见耐药基因的分离、鉴定等研究。近年来,随着基因组测序技术的发展,尽管国内外相关研究者基于基因组测序技术,发现和鉴定了一些RA毒力因子,但尚未见从基因组层面对RA耐药菌株进行全面分析[14]。
本研究从安徽养殖场患病家鸭组织器官中分离、鉴定出一株RA,将其命名为RA-WH9。由于RA对培养基营养成分要求较高,在MH培养基上不生长,因此药敏实验均采用TSB液体培养基、TSA固体培养基。K-B纸片扩散法及微量肉汤稀释法结果表明该菌为多重耐药菌,其对利福平的MIC达到50 μg/mL。Sun等[3]通过微量肉汤稀释法测定了110株RA对利福平的MIC,发现有71%RA对利福平的MIC≤8 μg/mL。这表明,RA-WH9为利福平高耐受菌株。
现有研究表明,细菌对利福平主要耐药机制之一为细菌rpoB氨基酸突变。利用多重序列比对,我们分析了RA-WH9与其他3株利福平敏感株(CH3、Yb2、HXb2)rpoB氨基酸序列异同,分析结果表明,与利福平敏感株相比,RA-WH9 rpoB存在5个位点的氨基酸不同:D481Y、S539Y、T930A、A937T、T993A。Sun等[3]证实RA rpoB中,S539Y的突变与利福平的耐药性相关,T930A、A937T、T993A这3个点突变与利福平的耐药性无关,至于rpoB D481Y突变是否与利福平的耐药相关仍需进一步的研究。
文献指出,某些基因的耐药突变通常会对细菌的重要生理功能产生不利影响,即在没有药物选择压力下,药物敏感株往往比耐药株能够更好完成生活周期[15]。利用体外生长曲线模型,我们比较了RA-WH9与药物敏感株CH3、Yb2、HXb2生长周期异同。实验数据显示,相同培养基,无药物选择压力下,RA-WH9生长速率小于药物敏感株,暗示RA-WH9某些基因的耐药突变导致适应成本。细菌呈现的耐药特征称为耐药表型(resistant phenotype),携带的耐药基因称为耐药基因型(resistant genotype)。尽管细菌的耐药表型由其耐药基因型决定,但耐药表型和耐药基因型之间没有完全的一致性。通过K-B纸片扩散法、微量肉汤稀释法,我们检测了RA-WH9的耐药表型;为了全面了解RA-WH9耐药基因型,借助细菌基因组高通量测序技术,我们构建了RA-WH9基因组精细图。分析结果表明,RA-WH9基因组共编码88个耐药基因,其耐药基因型与耐药表型较为一致。同时,多重基因组比对分析结果表明,RA-WH9染色体与HXb2、RA-CH-1、RCAD0133染色体结构最为接近。文献研究表明,RA-CH-1为血清1型RA,这也侧面证实了我们对RA-WH9血清学鉴定结果[16]。
细菌获得耐药性的另外一种重要方式是基因水平转移(horizontal gene transfer, HGT),是指以转化、转导和接合转移三种方式,通过质粒、整合子、转座子、基因岛等水平转移元件(mobile genetic element, MGE),在不同菌株间发生基因交换。文献研究表明,细菌间的基因水平转移无时无刻不在发生,是造成细菌基因组多样性的主要原因之一,也是耐药性基因在环境扩散主要风险因素之一。MGE同样在RA耐药性的传播中也发挥着重要的作用。染色体分析结果表明,RA-WH9携带有多个可移动元件:1个质粒、7个CRISPR系统、19个基因岛,猜测其对抗生素的耐药性尤其是对利福平的耐药性可通过基因水平转移的方式扩散至自然环境中,存在较大的环境扩散风险,但仍需进一步的研究。
总之,本研究从全基因组水平对鸭疫里默氏杆菌利福平高耐受菌株RA-WH9进行了初步的解析,这些信息将为后续耐药机制及分子致病机制等方面的研究指明方向。
