广东肇庆地区鸭疫里氏杆菌耐药性和毒力基因分析及ERIC-PCR分型研究
2022-09-23张旭财李燕红陆毅兴谢龙飞曾振灵熊文广
张旭财,李燕红,陆毅兴,常 依,谢龙飞,曾振灵,熊文广
(1.广东省兽药研制与安全评价重点实验室,广州 510642;2.国家兽药安全评价(环境评估)实验室(华南农大),广州 510642;3.国家兽医微生物耐药性风险评估实验室,广州 510642;4.岭南现代农业科学与技术广东省实验室,广州 510642)
鸭疫里氏杆菌(Riemerella anatipestifer,RA)是一种革兰阴性、无芽孢、无鞭毛的杆状细菌。在受感染动物中能够引起以纤维素性心包炎、肝周炎和脑膜炎等炎症反应为主要病变的鸭疫里氏杆菌病[1]。该病传染性强、病死率高,在世界范围内引起养鸭业巨大的经济损失[2]。
疫苗免疫是防控鸭疫里氏杆菌病的主要手段之一,然而目前的研究证明RA的血清型众多,并且不同血清型之间无明显的交叉保护。此外,部分疫苗的研制还面临成本较高和推广困难的问题,极大的提升了用疫苗来防控鸭疫里氏杆菌病的难度[3-4]。目前,我国仍广泛使用抗菌药物治疗鸭疫里氏杆菌病。但是,随着抗菌药物的广泛使用甚至是滥用,细菌耐药性问题也随之产生[5-6]。不同地区分离株的耐药状况存在差异,为了在养殖过程中有效防控鸭疫里氏杆菌病,应加强对我国水禽养殖场RA耐药性监测。
本研究以广东省肇庆市4个鸭场作为研究对象,采集疑似感染鸭疫里氏杆菌的病鸭进行细菌分离鉴定,对分离菌株进行药敏试验、耐药基因检测、毒力基因检测和ERIC-PCR分型研究,为了解RA流行病学分布和指导临床科学用药提供依据。
1 材料与方法
1.1 菌株来源 14株鸭疫里氏杆菌分离自广东省肇庆市的4个鸭场,标准菌株ATCC25922为本实验室保存。
1.2 主要试剂 胰蛋白胨大豆琼脂培养基(TSA)、胰蛋白胨大豆肉汤培养基(TSB)购自广东环凯微生物科技有限公司;新生胎牛血清购自浙江天杭生物科技股份有限公司;革兰氏染色液购自北京索莱宝科技有限公司;细菌DNA提取试剂盒购自天根生化科技(北京)有限公司;DNA marker、2×TaqPCR Master Mix均购自东盛生物科技有限公司;TaqDNA聚合酶(5 U/μL)、dNTP Mixture(2.5 mmol/L)、10×PCR buffer(Mg+plus)均购自宝生物工程(大连)有限公司;琼脂糖购自西班牙Biowest公司;庆大霉素(含量590 IU/mg)、头孢喹肟(含量98%)、安普霉素(含量99%)、阿莫西林(含量99%)、头孢噻肟(含量98%)、新霉素(含量92%)、黏菌素(6500 IU/mg)、环丙沙星(含量99%)购于大连美仑生物技术有限公司;头孢他啶(含量98%)、氟苯尼考(含量95%)、阿米卡星(含量97%)、恩诺沙星(含量98.5%)、多西环素(含量97%)、替加环素(含量98%)均购自生工生物工程(上海)股份有限公司;磺胺甲噁唑(含量99.0%)、甲氧苄啶(含量98.0%)购于广东翔博生物科技有限公司。
1.3 细菌分离培养 用灭菌的接种环蘸取疑似感染RA的病死鸭的脑组织、肺脏、心脏,划线接种于含有5%新生牛血清的TSA平板上,置于5%CO2培养箱中,37℃培养24~48 h。挑取呈圆形突起、表面光滑、边缘整齐的单菌落接种于含有5% 新生牛血清的TSA平板上,置于5%CO2培养箱中,37℃培养24~48 h,选取疑似单菌落接种于含有5%新生牛血清的TSB肉汤中,37℃振荡培养过夜后进行纯化培养和鉴定。
1.4 细菌染色镜检 蘸取纯化培养后的菌液涂布于载玻片中,经革兰染色,镜检观察细菌形态。
1.5 细菌PCR鉴定 取200 μL纯化培养后的菌液于2 mL的无菌EP管中,使用细菌DNA提取试剂盒提取细菌基因组。根据文献[7]合成鉴定引物ompA基因序列,(RA-F:5'-CTTGGTATCCAAG GGGATTATGTTT-3';RA-R:5'-TTTAACT GAGATGGGTTAACACCTC-3')引物由生工生物工程(上海)股份有限公司合成。以细菌DNA为模板,反应体系25 μL:2×TaqPCR Master Mix 12.5 μL,上、下游引物(10 μmol/L)各0.5 μL,10.5 μL ddH2O,1 μL模板。PCR扩增程序:94℃预变性5 min;94℃变性30 s,56℃退火30 s, 72℃延伸1 min,30个循环;72℃终延伸10 min。PCR产物于1%琼脂糖凝胶电泳后用凝胶成像系统观察并保存图片,且将PCR阳性产物送至测序公司测序,测序结果与NCBI数据库进行比对。
1.6 药敏试验 根据美国临床实验室标准化委员会(clinical and laboratory standards institute,CLSI)的指导原则,采用琼脂稀释法对14株分离菌进行15种抗菌药物最小抑菌浓度(minimal inhibitory concentration,MIC)的测定,试验过程中每种药板设置三个平行,以ATCC25922作为质控菌株。由于缺少CLSI批准的适用于RA的药物敏感折点值,本试验所用药物的质控范围及敏感折点值主要参考CLSI-2018中大肠杆菌、巴氏杆菌的耐药判定标准及有关鸭疫里氏杆菌耐药性的相关文献。
1.7 耐药基因检测 参照文献[8-9]合成氨基糖苷类(aac(6')-Ib、aph(3')-Ⅱ)、β-内酰胺类(blaSHV、blaDHA)、喹诺酮类(qnrA、qnrB)、四环素类(tet(A)、tet(B)、tet(C)、tet(X))、磺胺类(sul1、sul2)以及酰胺醇类(floR),6大类 13对耐药基因引物,引物均由生工生物工程(上海)股份有限公司合成,引物序列见表1。PCR反应体系25 μL:2×TaqPCR Master Mix 12.5 μL,上、下游引物(10 μmol/ L)各0.5 μL,10.5 μL ddH2O,1 μL模板。PCR扩增程序:94℃预变性5 min;94℃变性30 s,退火(退火温度详见表)30 s,72℃延伸1 min,30个循环;72℃终延伸10 min。PCR产物于1% 琼脂糖凝胶电泳后用凝胶成像系统观察并保存图片。
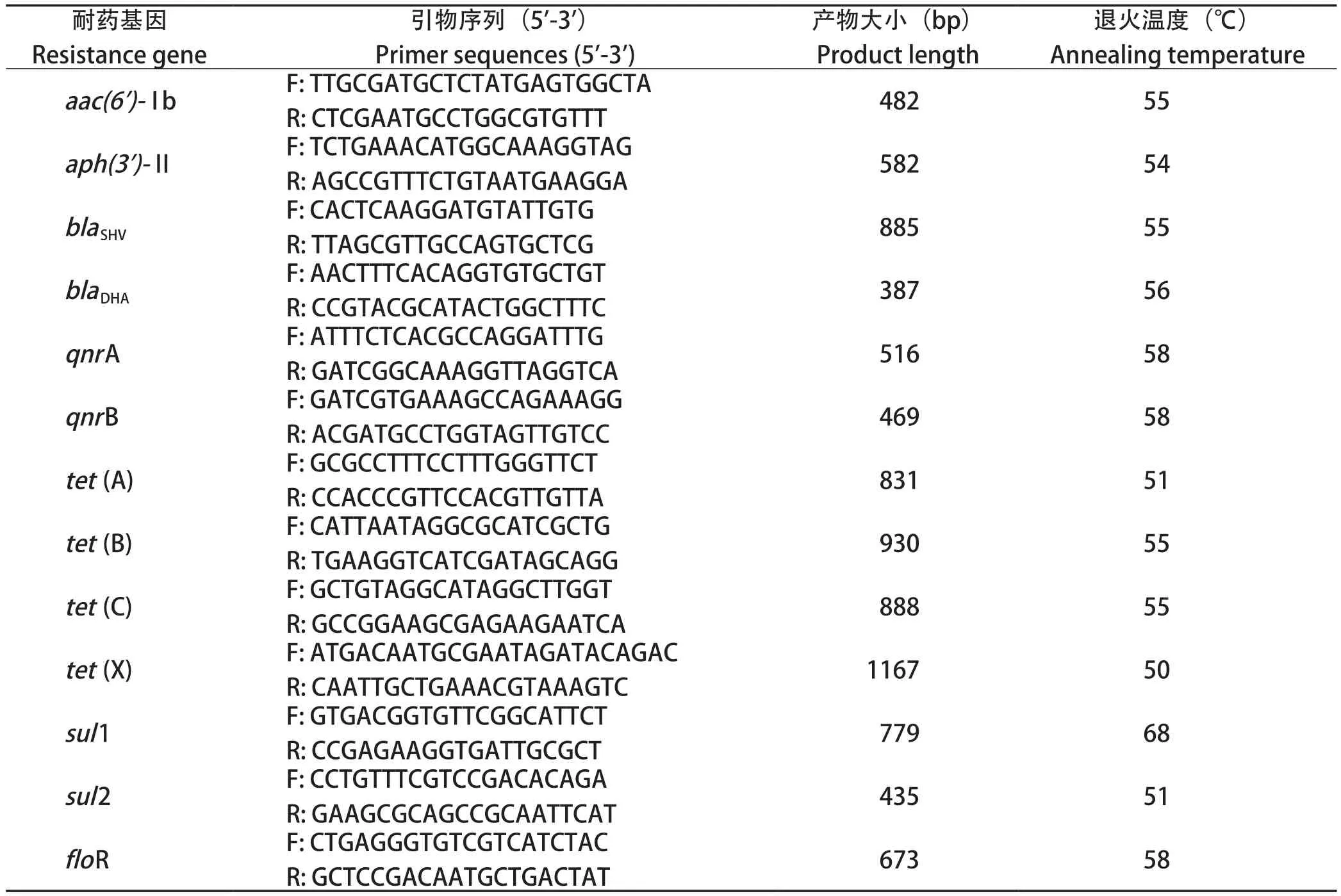
表1 耐药基因引物序列信息Table 1 Sequence information of drug resistance gene primers
1.8 毒力基因检测 以利用细菌DNA提取试剂盒提取的DNA为模板,用表2所示引物[10]分别扩增CAMP、wza、AS87_04050、Fur、SIP、TbdR1和luxE基因。PCR反应体系及条件同1.7。

表2 毒力基因引物序列信息Table 2 Sequence information of virulence gene primers
1.9 ERIC-PCR分型 参考文献[11]合成通用引物ERIC-1R(5'-ATGTAACTCCTGGGGATTCAC-3')和ERIC-2R(5'-AAGTAAGTGACTGGGGTA GCG-3'),构建25 μL反应体系:10×PCR Buffer 2.5 μL,dNTP Mixture(10 mmol) 2 μL,上下游引物各0.5 μL,E×Taq酶0.5 μL,模板2 μL,ddH2O 17 μL。经过优化的扩增程序为:94℃预变性7 min;95℃变性45 s,52℃退火60 s,65℃延伸2 min,30个循环;72℃终延伸10 min。扩增产物经1%琼脂糖凝胶电泳观察,拍照保存,并对其进行聚类分析。
2 结果
2.1 细菌分离与镜检结果 分离菌在含有5%新生牛血清的TSA平板表现为圆形突起、边缘整齐光滑、奶油状菌落。分离菌经革兰氏染色后,显微镜下呈革兰氏阴性,不能运动,短杆状,单个或成对排列(图1)。

图1 分离菌革兰氏染色镜检结果Fig.1 Gram staining results of isolated strains
2.2 PCR鉴定结果 以疑似菌株的DNA作为模板,使用鸭疫里氏杆菌OmpA基因特异性引物进行PCR鉴定,经琼脂糖凝胶电泳检测,PCR产物条带大小约为707 bp(图2),序列经比对后确定为鸭疫里氏杆菌。采用“菌株种属+鸭场编号+序号”的方式命名。以GDRA-A-1为例,其为广东肇庆A鸭场分离得到。

图2 细菌OmpA基因鉴定电泳图Fig.2 Identification of OmpA gene
2.3 药物敏感性的测定 以琼脂稀释法测定14株RA对15种抗菌药物敏感性试验,结果表明(表3),14株RA对新霉素、安普霉素、恩诺沙星、替加环素和复方新诺明耐药率最高,耐药率均达100%;对阿莫西林、头孢他啶、环丙沙星敏感性较高,分别为100%、100%和92.86%。
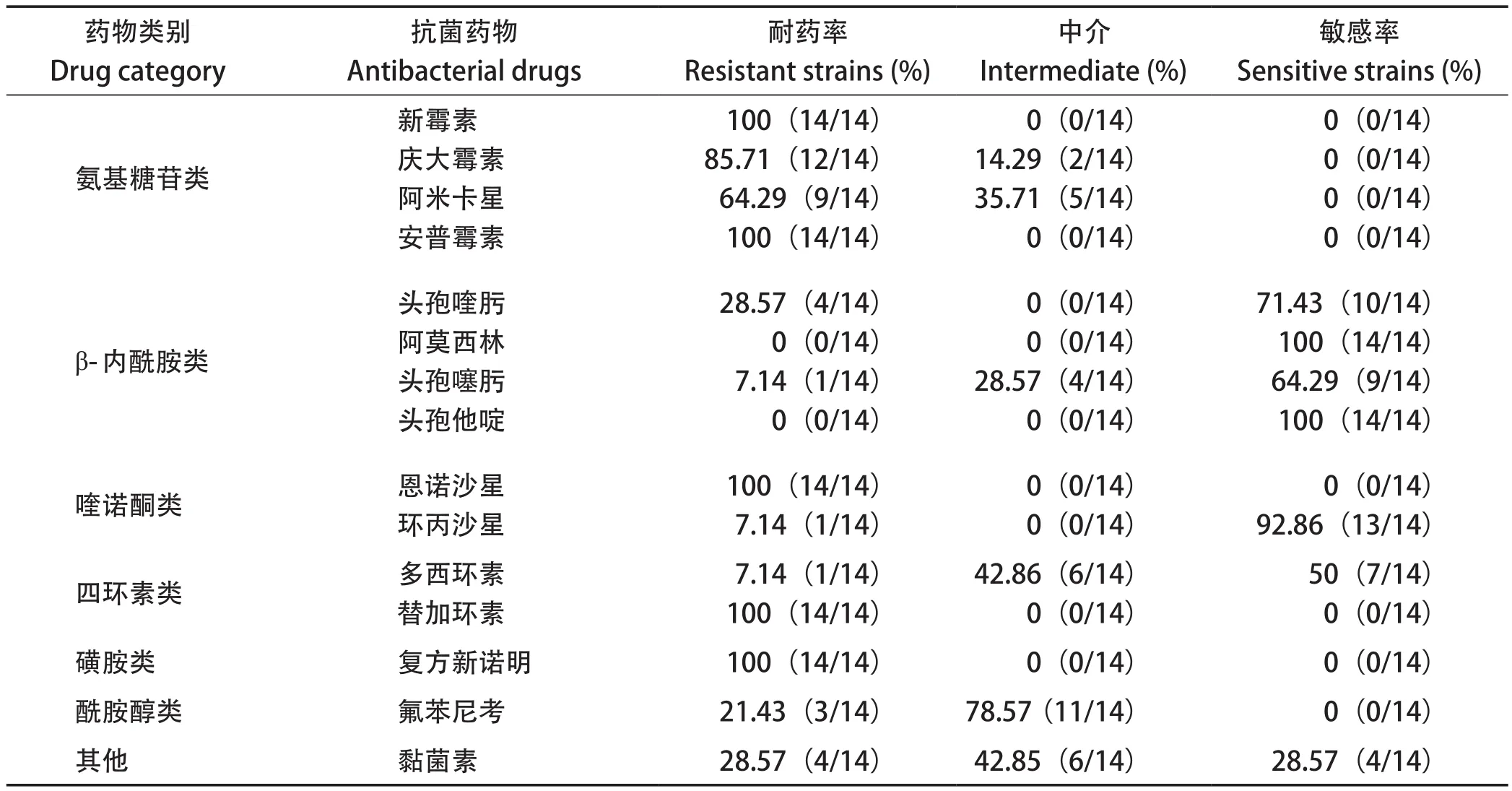
表3 分离菌的药敏试验结果Table 3 Drug susceptibility test results of isolated strains
2.4 耐药基因的检测 使用PCR对分离得到的RA进行13种耐药基因检测,RA携带耐药基因情况见表4。14株RA均携带四环素类耐药基因tet(X)和酰胺醇类耐药基因floR。其次,四环素类耐药基因中,除了tet(B)的检出率为64.29%以外,其余的2种耐药基因tet(A)、tet(C)均未被检出。磺胺类耐药基因中,sul1的检出率为50.00%,而sul2未被检出;在所有分离的RA中,氨基糖苷类耐药基因aac(6')-Ib、aph(3')-Ⅱ,β-内酰胺类耐药基因blaSHV、blaDHA,喹诺酮类qnrA、qnrB均未被检出。
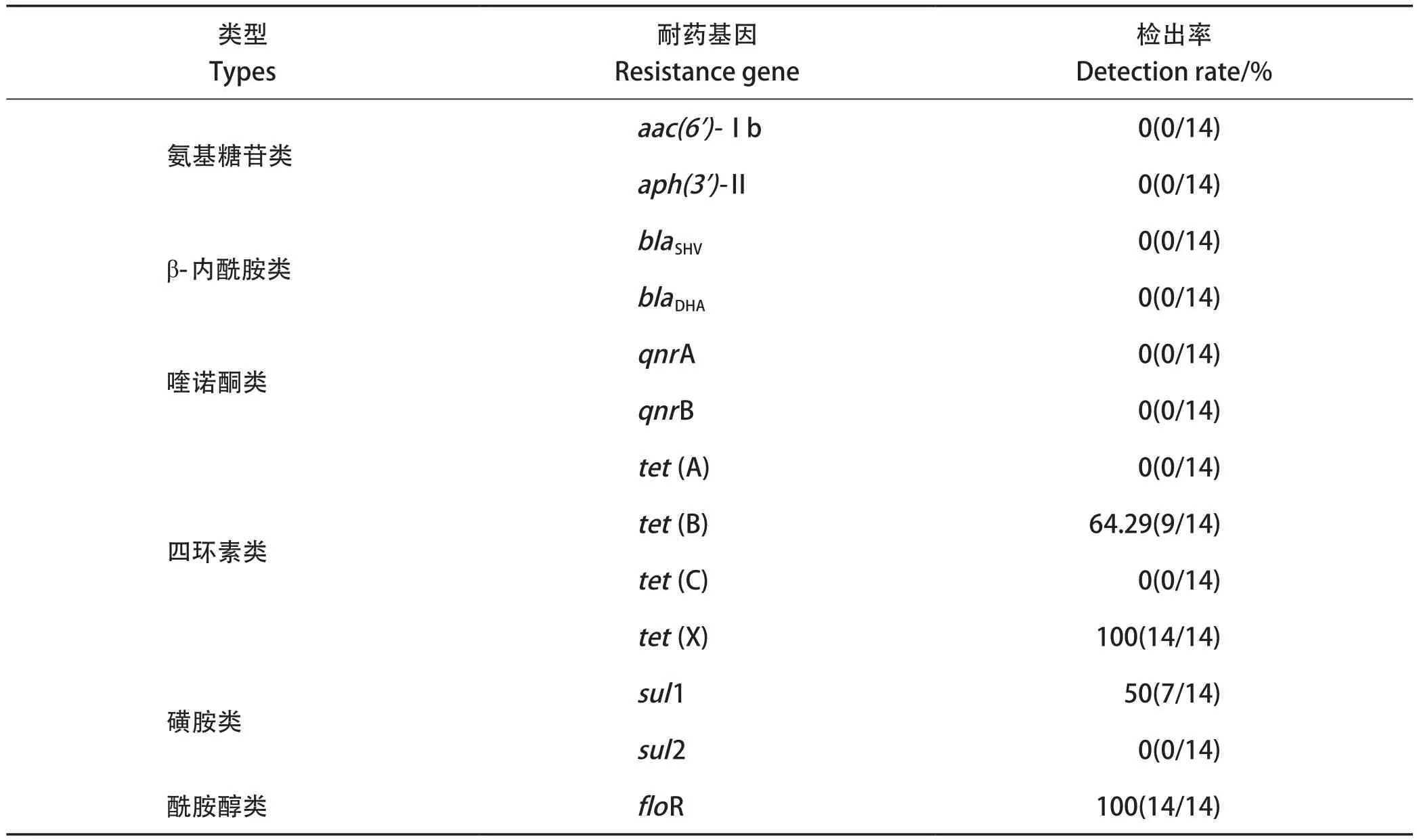
表4 分离菌耐药基因检测结果Table 4 Detection rate of resistance genes of isolated strains
2.5 毒力基因检测结果 利用PCR检测分离株携带的毒力基因,14株RA的毒力基因检出率如图3所示。其中,毒力基因AS87 _04050、wza和luxE的检出率分别高达100%、100%和92.86%。此外,毒力基因CAMP、SIP、Fur的检出率分别为7.14%、50.00%和85.71%,但14株RA中均未检测出毒力基因TbdR1。
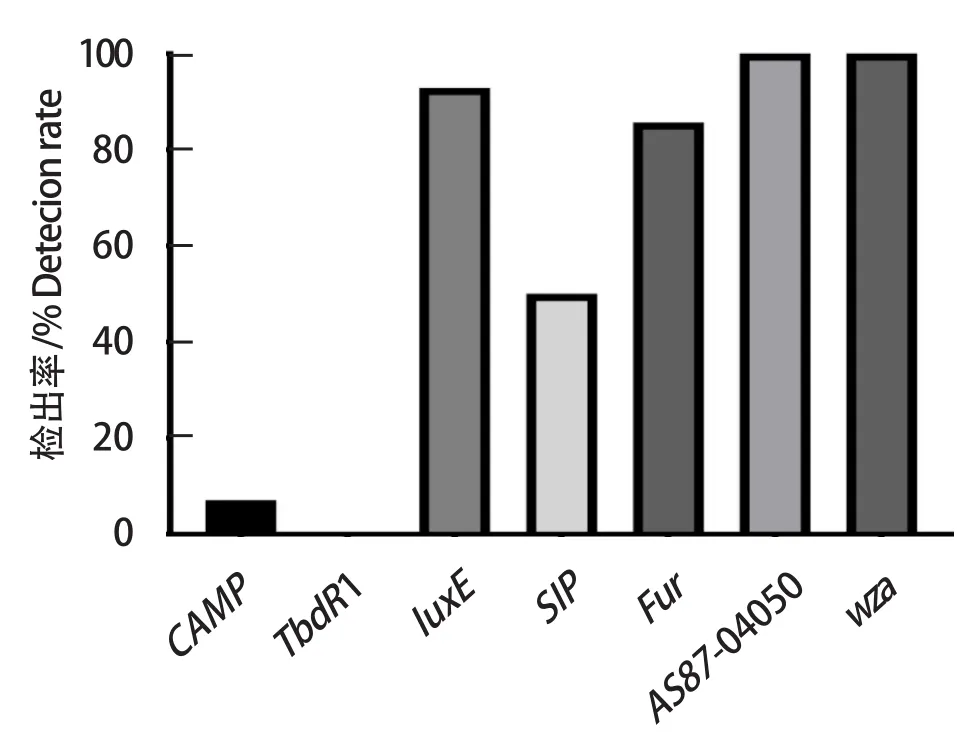
图3 14株分离株毒力基因检出率Fig.3 Virulence genes detection rate of 14 isolates
2.6 ERIC-PCR及聚类分析结果 14株RA分离株ERIC-PCR结果显示(图4),所有分离株均能扩增出条带,数目在1~9条不等,扩增片段浓度存在差异。聚类分析结果显示(图4),按90%的相似性可分为7个基因型,相同地区分离的菌株大部分聚集在同一分支。
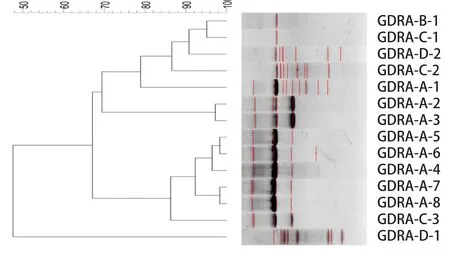
图4 14株RA ERIC-PCR电泳结果聚类分析Fig.4 Cluster analysis of electrophoresis results of 14 RA ERIC-PCR strains
3 讨论
目前,抗菌药物在治疗鸭疫里氏杆菌病中仍然发挥着重要作用。但长期不合理使用甚至滥用抗菌药使得细菌耐药性问题愈发严重。因此,进行药敏试验对养殖场有效治疗鸭疫里氏杆菌至关重要。经研究发现,安徽省部分地区分离株对新霉素、庆大霉素、卡那霉素表现高度耐药;对头孢拉定、头孢他啶、大观霉素表现敏感[12-13]。董洪燕等[14]在江苏省地区分离的RA均对新霉素、庆大霉素、卡那霉素耐药;对头孢曲松、头孢拉定、氟苯尼考敏感,敏感率达90%。贵州省分离株对庆大霉素、阿奇霉素、红霉素耐药;对头孢氨苄、头孢曲松敏感[10,15]。广东分离株对卡那霉素、盐酸环丙沙星、庆大霉素的耐药率81.25%~91.67%,其中54.17%的分离株多重耐药数目达9耐和10耐[16]。本研究药敏结果显示,所有分离株对氨基糖苷类药物(新霉素、庆大霉素、安普霉素)高度耐药;对阿莫西林、头孢他啶、环丙沙星高度敏感;分离株多重耐药数目最高达10耐。本研究分离株主要耐药药物与上述不同省份的结果大致相同,但主要敏感药物却不同。因此,加强不同地区水禽养殖场RA药敏监测十分重要。同时值得注意的是,替加环素目前仅批准用于人医临床,但近些年已有报道在不同动物源细菌中出现替加环素耐药[17],本次分离的RA均对替加环素耐药也暗示了应该采取措施防止重要抗菌药物的耐药菌在畜禽养殖场中传播与扩散。
耐药基因检测是当前研究细菌耐药性传播的重要手段。本研究中,13种耐药基因仅检测出4种,耐药表型与耐药基因的相关性不尽相同。14株RA分离株对氨基糖苷类药物的耐药表型为高度耐药,而所有分离株均未检测出氨基糖苷类耐药基因aac(6')-Ib、aph(3')-Ⅱ,这与肖琨等[18]的研究结果相似。这可能是菌株通过其他机制介导耐药或同类的其他耐药基因介导有关[19]。此外,除了β-内酰胺类耐药基因阳性率与耐药率相关性较高外,喹诺酮类、磺胺类、酰胺醇类耐药基因阳性率与耐药率的相关性较差,这可能是基因隐性表达、基因不表达或其他外界环境因素所致。值得注意的是,14株RA均携带tet(X)耐药基因,这与吴彩艳等[16]研究发现四环素耐药株的tet(X)耐药基因高携带率相似。有研究发现,RA可以携带多种tet型耐药基因,并且可能是tet(X)耐药基因的储存库。tet(X)亚型至今已发现约48种,不同的tet(X)亚型可能从鸭传播到其他动物以及人类身上[20-21]。对于养殖场从业人员来说,长期暴露在携带tetX细菌污染的环境中是存在风险的。
菌株携带毒力基因的数量对细菌的致病性与毒力产生影响。近些年来,越来越多RA相关毒力基因的研究报道,有关RA毒力基因的研究也为研制新型疫苗以及防控措施提供新思路[22-24]。本研究共检测了7种RA相关毒力基因,同一鸭场分离的RA携带不同的毒力基因,不同鸭场分离的菌株也有携带相同毒力基因的情况,但是,14株分离株中均未检测出TonB1依赖受体TbdR1,这其中的复杂机制有待进一步研究。对比分析发现,携带毒力基因最多的GDRA-A-3并不是多重耐药数目最多的菌株。同时,简单对比菌株多重耐药与携带毒力基因数量的相关性,发现两者间并不存在明显相关。
ERIC-PCR是一种快速、可靠的基因分型方法,可在RA流行病学调查中发挥作用[25]。本研究中,14株分离株均成功分型。可以发现,GDRA-B-1、GDRA-C-1和GDRA-D-2来自不同鸭场,其相似性大于90%,这揭示其可能具有相同的起源,随后通过鸭苗、人员等其他途径在不同的鸭场中传播,这也证实了耐药菌的传播风险。此外,分离自同一鸭场的RA拥有不同的基因型,证明了一个鸭场存在着多种基因型的RA,这也给临床防控带来困难。
科学防控鸭疫里氏杆菌与遏制细菌耐药性问题已刻不容缓,因此需加强对不同地区鸭疫里氏杆菌的耐药性监测,进而为临床合理用药提供依据。同时,加强细菌耐药机制研究和研发抗菌药替代品尤为重要。
