H9N2亚型禽流感病毒PA-X蛋白功能研究
2022-09-23李鲁兆崔宏锐林伟山李雪松杨健美滕巧泱刘芹防李泽君
李鲁兆,崔宏锐,林伟山,李雪松,杨健美,滕巧泱,刘芹防,李泽君
(中国农业科学院上海兽医研究所,上海 200241)
H9N2禽流感病毒在过去的二十年中在全球范围内广泛传播,不仅威胁着全球家禽业,而且也威胁着人类[1]。H9N2流感病毒易于重组和变异,研究H9N2流感病毒在家禽中的流行和变异,及时发现可能具有大流行潜力的新型重组流感病毒,可能对人类流感大流行提供重要的早期预警[2]。在H9N2疫苗广泛接种的养殖场中也仍能检测到H9N2病毒的存在[3]。
流感病毒的RNA聚合酶是一种异源三聚体复合物,由聚合酶碱性蛋白1(Poly-memse basic protein 1, PB1)、聚合酶碱性蛋白2(Poly-memse basic protein 2, PB2)和聚合酶酸性蛋白(polymerase acidic protein, PA)组成[4-5]。流感病毒聚合酶自身不具有合成mRNA帽子的活性,它必须利用宿主mRNA作为其mRNA帽子结构的供体[6]。在“帽子捕获”的过程中,病毒聚合酶利用其PB2帽子结合结构域捕获宿主mRNA的5'帽子结构,并利用其PA核酸内切酶活性在下游8~14个核苷酸处切割帽子结构[7-9]。
流感病毒基因片段3可以编码PA一种或PA和PA-X两种蛋白。在翻译过程中,核糖体在PA的mRNA上移动,经过一个富含U的区域时,其后面是一个稀有密码子,由于解码变慢,稀有密码子促进了核糖体进行+1移码[10],使得密码子CGU CAG解读为GUC,导致开放阅读框产生移位。PA-X与PA蛋白具有相同的N末端191个氨基酸,包括核酸内切酶结构域,但是核糖体移码会产生含有独特的短C端序列的PA-X[11]。研究发现H5N1亚型禽流感病毒的PA-X可以抑制病毒复制降低病毒毒力,同时可以降低宿主免疫反应,抑制宿主细胞中蛋白表达,从而阻断细胞的抗病毒反应[12-13]。
本研究利用H9N2禽流感病毒A2093毒株为背景,通过研究PA-X对宿主蛋白表达、病毒聚合酶活性及病毒增殖的影响,旨在初步阐明H9N2禽流感病毒PA-X在病毒复制中的功能。
1 材料和方法
1.1 材料 Phanta高保真酶、同源重组酶购自Vazyme公司;胶回收试剂盒购自Axygen公司;EcoRI和XhoI、StuI限制性内切酶购自NEB公司;DH5α感受态细胞购自擎科生物公司;去内毒素大提质粒试剂盒购自QIAGEN公司;双荧光素酶报告基因检测试剂盒购自Promega公司;DMEM培养基购自Hyclone公司;胎牛血清(FBS)购自Biosun公司;Opti-MEM购自Gibco公司;TransIT®-293 Transfection Rection Reagent购自Mirus Bio LLC公司;SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。
1.2 病毒、质粒、载体和细胞 A2093毒株的反向遗传操作系统质粒、pCAGGS质粒载体、A2093毒株的PB1、PB2和NP的表达质粒、eGFP蛋白和Renilla荧光素酶的表达质粒、转录产生病毒样RNA的Firefly荧光素酶质粒(NA-firefly)、pHW2000质粒载体、293T细胞、MDCK以及LMH细胞均由本实验室提供。
1.3 引物设计 根据A2093毒株PA基因序列以及A2093PA基因移码表达PA-X的序列设计引物表达PA-X和删除PA-X的表达。方法参照文献[14-15],引物序列见表1。

表1 PCR扩增引物Table 1 Primers for PCR amplication
1.4 质粒的构建 以A2093反向遗传操作系统的PA质粒为模版,利用表1的引物扩增目的片段。利用同源重组试剂盒将目地片段与目的质粒进行同源重组,目的片段PCS+PA与pCAGGS质粒重组得到共表达A2093 PA-X和PA的质粒pCAGGS-PA;目的片段PA-X(1)、PA-X(2)与pCAGGS质粒重组得到表达A2093 PA-X的质粒pCAGGS-PA-X;目的片段PCS+△PA(1)、PCS+△PA(2)与pCAGGS质粒重组得到仅表达A2093的PA的质粒pCAGGS-PA△PA-X;同样以A2093毒株反向遗传操作系统的PA质粒为模版通过PCR方法缺失PA-X后,利用同源重组方法插入到pHW2000载体中,构建A2093毒株缺失PA-X的PA的全长感染性质粒pHW2000-PA△PA-X。
1.5 宿主蛋白表达检测 通过转染表达eGFP质粒模拟宿主蛋白表达来检测PA-X对宿主蛋白表达的影响。具体操作为:293T细胞传代培养在6孔培养板内,长至60%~80%时,用于转染;将400 μL不含血清的opti-MEM培养液加至8个无菌的1.5 mL EP管中,取其中4个分别加入200 ng的pCAGGS-PA、pCAGGS-PA-X、pCAGGS-PA△PA-X和对照pCAGGS质粒,然后每管分别加入1 μg的eGFP表达质粒并混匀;将剩余的4个EP分别加入5 μL转染试剂TransIT-293 Transfection Reagent,混合并作用5 min;将上述含有质粒和含有转染试剂的两种液体混合均匀,室温静置30 min。轻轻弃掉6孔板中293T细胞培养液,将上述混合液分别加至6孔板中。37℃、5%CO2细胞培养箱培养24 h后用荧光显微镜检测。
1.6 聚合酶活性检测 293T细胞传代培养在24孔培养板内,细胞长至60%~80%时,用于转染;将200 μL不含血清的opti-MEM培养液分别加至4个无菌的1.5 mL EP管中,取2个加入opti-MEM的EP管,第一个管内加入A2093PB1、PB2、PA和NP表达质粒各400 ng,Firefly Luciferase质粒100 ng 和Renilla质粒20 ng混匀;第二个管内加入A2093PB1、PB2、PA△PA-X和NP表达质粒各400 ng,Firefly Luciferase质粒100 ng,Renilla质粒20 ng混匀;分别将7 μL转染试剂TransIT-293 Transfection Reagent加入到另外两个含有200 μL opti-MEM培养液的EP管中,混合并作用5 min;将上述含有质粒和含有转染试剂的两种液体混合均匀,室温静置30 min;轻轻弃掉24孔板中293T细胞培养液,将上述混合液全部均匀滴加到24孔板中。以上实验进行3个重复。37℃、5%CO2细胞培养箱培养24 h后利用双荧光素酶检测试剂盒对聚合酶活性进行检测,数据分析时取3个数值的平均值进行画图分析。
1.7 荧光定量检测 293T细胞传代培养在6孔培养板内,长至60%~80%时,用于转染;将400 μL不含血清的opti-MEM培养液加至6个无菌的1.5 mL EP管中,取其中3个EP管分别加入200 ng的pCAGGSPA、pCAGGS-PA△PA-X和对照pCAGGS质粒,然后每管分别加入1 μg的eGFP表达质粒并混匀;将剩余的3个EP管分别加入5 μL转染试剂TransIT-293 Transfection Reagent,混合并作用5 min;将上述含有质粒和含有转染试剂的两种液体混和均匀,室温静止30 min;轻轻弃掉6孔板中293T细胞培养液,将上述混合液分别加到6孔板中;将以上实验同时重复在4块6孔板上进行,以便在不同时间段取样。在4、8、12、24 h分别收取细胞,用RNA提取试剂盒提取细胞中的RNA,用DNA酶试剂盒处理残存的DNA后,用M-MLV逆转录酶反转录成cDNA,然后用实验室的eGFP的荧光定量体系来测定eGFP的mRNA含量。
1.8 病毒的拯救 利用实验室的A2093毒株的反向遗传操作系统,将A2093反向遗传操作系统的8个质粒质粒混匀,每个质粒1 μg,共转染293T细胞,48 h后将细胞及上清液接种9~10日龄SPF鸡胚,0.4 mL/枚,37℃培养,48 h后收取尿囊液进行血凝试验,阳性的尿囊液分装冻存于-80℃。对拯救得到的病毒提取RNA,扩增全基因组进行测序,利用DNAStar软件比较拯救得到的病毒与亲本病毒是否相同。通过以上的方法成功拯救了A2093毒株和PA-X缺失的A2093ΔPA-X毒株。
1.9 病毒的生长曲线 感染剂量为0.01 MOI的病毒液接种至T25细胞培养瓶中生长状态良好、密度在70%~80%的MDCK和LMH细胞上,并做2个重复,在37℃、5%CO2细胞培养箱感作1 h后,用无菌PBS清洗T25细胞培养瓶2次,加入含有TPCK-胰酶(1 μg/mL)的无血清细胞培养液SFM 5 mL。分别于接种后6、12、18、24、36、48 h 收集细胞上清液300 μL,同时补加300 μL无血清细胞培养液。使用同一批次细胞测定上清液中病毒滴度(TCID50/mL)。根据不同时间点细胞上清液中病毒的滴度绘制病毒在MDCK以及LMH细胞上的生长曲线。
1.10 统计学分析 实验结果获得的数据使用GraphPad Prism中的t检验方法进行比较,P≤0.05时,判断为显著性差异,标记*;当P≤0.01时,判断为极显著差异,标记为**;当P≤0.001时,标记***,判断为极极显著性差异。
2 结果
2.1 宿主细胞蛋白表达检测结果 用eGFP的表达来模拟宿主蛋白表达。结果显示,pCAGGS-PA质粒的表达可以显著抑制eGFP的表达,单独表达PA-X的pCAGGS-PA-X质粒的表达也可以显著抑制eGFP的表达,但是PA-X缺失的pCAGGS-PA△PA-X质粒的表达不能抑制eGFP的表达(图1)。
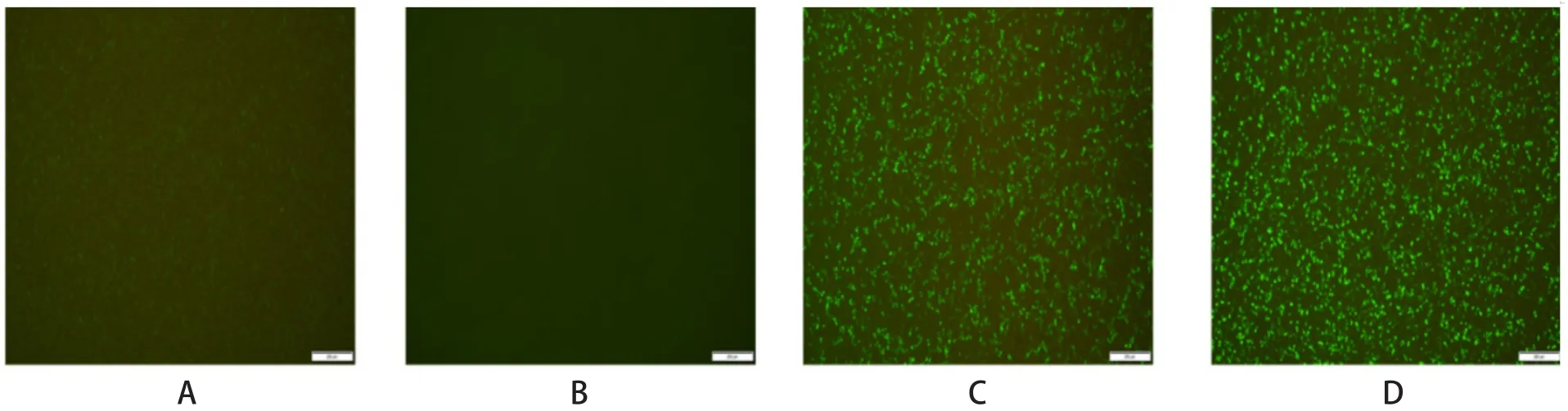
图1 eGFP蛋白表达检测结果Fig.1 Results of eGFP expression
2.2 聚合酶活性检测结果 当我们用PA-X缺失的pCAGGS-PA△PA-X质粒代替正常情况下使用的pCAGGS-PA质粒时,结果显示,A2093的复制子系统的聚合酶活性会有显著提高,具有统计学意义(图2)。结果表明,PA-X对聚合酶活性存在影响。
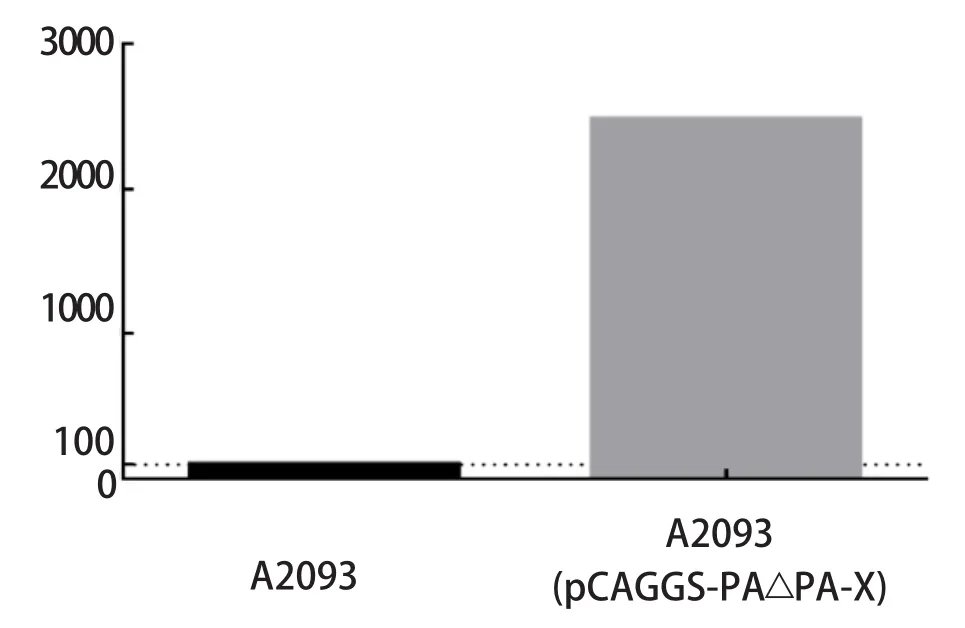
图2 聚合酶活性检测结果Fig.2 Polymerase activity results
2.3 荧光定量检测结果 A2093 PA-X可以抑制eGFP的表达,本研究通过荧光定量测定mRNA的含量来确定降低eGFP mRNA含量是否会降低eGFP的表达。我们分别转染了pCAGGS-PA、pCAGGSPA-X、pCAGGS-PA△PA-X以及pCAGGS质粒,当转染pCAGGS-PA、pCAGGS-PA-X质粒后eGFP的mRNA水平较转染pCAGGS均显著降低,具有统计学意义(P≤0.01)。但是转染pCAGGS-PA△PA-X质粒后eGFP的mRNA水平与转染pCAGGS的相差不大,见图3。结果表明PA-X是通过降低mRNA的含量来发挥抑制宿主蛋白表达的作用。
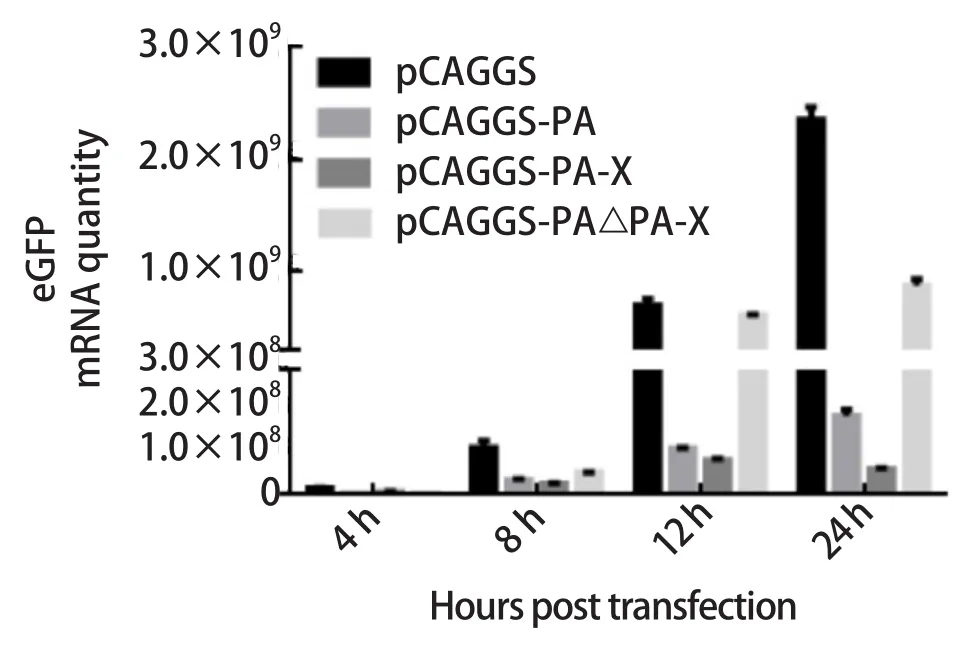
图3 荧光定量检测结果Fig.3 qPCR results
2.4 病毒的生长曲线 为了确定PA-X在A2093病毒中的作用,我们成功拯救出了A2093亲本病毒和PA-X缺失毒A2093ΔPA-X,然后在LMH和MDCK细胞上测定了它们的生长曲线,结果显示,在MDCK和LMH细胞上,从接种后12~36 h的不同时间点A2093ΔPA-X比A2093病毒滴度均明显降低,具有统计学意义(图4)。
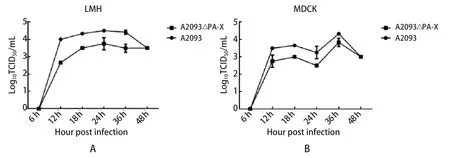
图4 病毒在LMH和MDCK细胞上的生长曲线Fig.4 Virus growth curve on LMH and MDCK cells
3 讨论
尽管流感病毒基因组很小,但仍表达了多种蛋白用于抑制宿主基因表达或关闭宿主蛋白表达,从而限制了宿主的抗病毒反应。已有研究表明,转染PA基因可以抑制与其共转染基因的表达[16],随着PA基因移码编辑的PA-X蛋白的发现,人们发现PA-X可以诱导细胞中宿主蛋白表达的关闭[11]。本研究证明了H9N2禽流感病毒的PA基因可以强烈抑制宿主基因表达,并且该能力是来源于其编码的PA-X蛋白,删除PA-X后的PA基因不能强烈抑制宿主基因表达。本研究用荧光定量的方法最终确定PA-X抑制eGFP表达是因为它降低了eGFP的mRNA水平。Khaperskyy等[17]研究表明PA-X可以切割宿主编码的未成熟mRNA从而降低mRNA水平来抑制蛋白表达,与本研究的结果一致。
在测定PA-X对聚合酶活性试验的影响时,我们发现PA-X缺失后聚合酶活性显著提高。由于其他聚合酶基因也是构建在pCAGGS的表达质粒上,PA-X同样可以抑制其表达,所以降低了聚合酶活性,并不是PA-X自身有降低聚合酶活性的功能。由于不同来源的PA-X具有不同的活性,所以通常测定聚合酶活性的方法是受到PA-X影响的,当比较不同毒株流感病毒聚合酶活性时需要考虑到PA-X在其中发挥的功能。
H9N2禽流感病毒PA-X缺失后在LMH和MDCK细胞上复制水平都降低了。可能是因为PA-X诱导感染细胞中宿主蛋白表达的关闭,从而有助于阻断细胞的抗病毒反应[12]。王晓泉等[18]发现H9N2 AIV SH7株的PA-X变异病毒SH7-FS株与SH7株在小鼠体内复制能力无显著差异,但是SH7-FS株在Vero细胞和MDCK细胞上复制水平比SH7株低。Hayashi等[19]研究表明虽然2009年大流行的H1N1病毒PA-X缺失株在人的细胞和小鼠细胞中病毒的复制都减弱,但增加了病毒对小鼠的致病性。Gong等[20]研究发现H1N1猪流感病毒中PA-X表达的下调增强了病毒在小鼠中的复制和毒力。Xu等[21]研究却表明PA-X表达的下调降低了H1N2病毒在PK15、PAM细胞和猪活体中的复制,并且还降低了H1N2病毒的毒力。所以PA-X的功能在不同的毒株以及不同的宿主上存在特异性,可能是因为其在维持病毒复制和病毒对宿主致病性间的平衡发挥着重要作用。
总之,H9N2禽流感病毒PA-X蛋白能够调节其宿主细胞的基因表达,并影响病毒自身的复制,在流感病毒的复制周期中发挥着重要作用。
