核桃球蛋白的分离纯化、鉴定及抗氧化性分析
2022-09-13陈洲王青华韩盼盼李思霆马爱进贾英民展远蓉
徐 倩,陈洲,王青华,韩盼盼,李思霆,马爱进,贾英民,展远蓉
(北京工商大学食品与健康学院,北京 100048)
核桃(L.)属斗科目胡桃科胡桃属植物,是世界四大坚果之一。我国核桃栽培历史悠久,种植面积及总产量已远超美国,截至2018 年底,我国核桃种植面积为816.57 万m,核桃年产量383 万t。核桃仁营养价值很高,其蛋白质含量达15%~20%,核桃经压榨制油后会产生大量的饼粕,其蛋白质含量更是可达50%,是一种优质的蛋白质资源。然而,目前核桃粕大多只被用作动物饲料、植物肥料,甚至直接丢弃,其附加值利用率较低。因此,如何研究开发核桃粕蛋白的应用价值对实现核桃粕的综合利用、提高其附加值具有重要意义。
国内外对核桃蛋白的研究集中在蛋白的提取、理化性质及其活性多肽方面的研究。根据溶解性的不同,核桃蛋白可分为清蛋白、球蛋白、醇溶蛋白和谷蛋白,其中,清蛋白和球蛋白的溶解性最佳,其中清蛋白的溶解度61.23%、球蛋白的溶解度可达近25%,目前相关研究也最多。清蛋白约占核桃总蛋白6.81%,它也是核桃蛋白研究热点的最主要对象,包括清蛋白的提取、酶解制备多肽的工艺条件以及清蛋白和酶解肽生物活性的探究等。相比之下,球蛋白的含量更高,约占17.57%,但针对球蛋白的科学研究却较少。现有研究中,关于球蛋白的报道主要集中在蛋白提取、功能特性和过敏性测定等方面,韩海涛等利用Osborne 法制备冷榨核桃球蛋白,并对其功能性质进行研究。Blankestijn 等纯化得到核桃11S 球蛋白Jug r4,并对其进行SDS-PAGE 印迹分析,以鉴定其是否为核桃过敏原蛋白;Downs 等鉴定和表征了来自核桃7S 种子储存球蛋白原蛋白N 末端区域的一系列肽,表明成熟的7S 球蛋白和新表征的7S 球蛋白N 端肽是两种不同类型的过敏原。而对球蛋白的组成信息、生物活性的探究等方面的研究却很少,这一定程度上限制了它的开发与应用。
本研究即以榨油后核桃粕为对象,提取其中球蛋白组分,通过纯化获得球蛋白主要组分,进一步探究球蛋白及其纯组分的功能活性,以期为脱脂核桃粕的深度开发以及核桃蛋白的研究提供基础数据和参考,具有积极的现实意义。
1 材料与方法
1.1 材料与仪器
核桃粕(北方香玲核桃)由河北养元智汇饮品股份有限公司提供;乙腈(质谱级)、二硫苏糖醇、碘乙酰胺(分析纯)Fisher Chemical 公司;测序级胰蛋白酶(酶活力14742 U/mg)Promega 公司;HiTrapCaptoQ、SephacrylS-100 High Resolution 柱料美国GE 公司;丙烯酰胺(纯度≥99.9%)、甲叉双丙烯酰胺(纯度≥98%)北京拜尔迪生物技术有限公司;ABTS(纯度≥98%)北京博奥拓达科技有限公司。
Ultimate 3000 毛细管高效液相色谱仪、Q Exactive™ Hybrid Quadrupole-Orbitrap™ Mass Spectrometer 电喷雾-组合型离子阱、Orbitrap 质谱仪 美国Thermo Fisher Scientific 公司;Allegra X-30R 型高速冷冻离心机 美国贝克曼公司;Alpha 2-4 LD Plus 型冷冻干燥机 德国Christ 公司;INFINITE Spark 10M 型多功能酶标仪 瑞士TECAN 公司;Cary 60 型紫外可见分光光度仪 Agilent 公司;BS-100A 型自动部分收集器、BT-100 型恒流泵、TH-500梯度混合器 上海泸西分析仪器厂有限公司。
1.2 实验方法
1.2.1 样品处理 核桃粕经粉碎后过80 目筛,在4 ℃条件下,用正己烷(m:V=5:1)处理1 h后抽滤得到滤饼,滤饼用正己烷再次处理,直至滤液呈无色为止,收集滤饼,于通风橱中挥干剩余溶剂,在4 ℃贮存。
1.2.2 核桃球蛋白提取 球蛋白根据改进的Osborne法制备:将脱脂粉与蒸馏水按1:10(w/v)的比例混合,然后在恒温水浴摇床中保温振荡,离心弃上清液。对沉淀进行两次上述操作,收集沉淀加入一定体积1 mol/L NaCl 溶液,充分混匀,在37 ℃保温振荡提取1 h 后,4 ℃、8000 r/min 离心30 min 取上清液,再重复提取2 次。收集上清液于4 ℃条件下用滤纸滤去不溶物后用蒸馏水透析,冷冻干燥获得球蛋白粗提物。蛋白含量依据GB 5009.5-2016测定,氮换算为蛋白质的系数为6.25。球蛋白提取率,公式(1):

1.2.3 球蛋白等电点测定 参照李婷等的方法进行改进,取4 mL 核桃球蛋白提取液6 份,初步调节pH 分别为3、4、5、6、7、8,静置后10000 r/min 离心5 min,在280 nm 下测定上清液吸光度。根据上述结果,参考訾艳等的方法,再在吸光度最低时的pH 附近均衡选择5 个点,间隔为0.2,重新准备5 份蛋白提取液,按此条件分别调节每管的pH。静置后10000 r/min 离心5 min,测定上清液中蛋白质含量,蛋白含量测定采用BCA 试剂盒法,蛋白含量最低点对应的pH 即为球蛋白的等电点。
1.2.4 球蛋白纯化
1.2.4.1 HiTrapCaptoQ 离子交换层析 采用HiTrapCaptoQ 作为固定相,纯化的色谱条件为:先用平衡缓冲液(25 mmol/L pH8.5 的Tris-HCl溶液)平衡离子交换柱后,步骤1.2.2 提取得到球蛋白粗提物用平衡缓冲液溶解,经4 ℃、8000 r/min 离心5 min 后取上清液,上清液过0.45 μm 滤膜后上柱,再用初始浓度0 mol/L、最高浓度2 mol/L 氯化钠的25 mmol/L pH8.5 的Tris-HCl 缓冲液进行线性梯度洗脱,流速为1.0 mL/min,1 mL/管分管收集。收集后测定每管溶液的A值,绘制洗脱曲线,分别将各峰收集后用SDS-PAGE 电泳分析,然后分别于4 ℃截留分子质量为3500 Da 的透析袋中透析72 h。透析完毕后收集蛋白溶液,于4 ℃条件下保存备用,以待进一步纯化。
1.2.4.2 SephacrylS 100HR 凝胶过滤层析 用含有0.3 mol/L NaCl 的PBS(50 mmol/L,pH7.4)平衡SephacrylS 100HR 柱(1.6 cm×120 cm),上一步离子交换层析纯化得到峰1 蛋白样品经过3 kDa 滤膜超滤浓缩后过0.45 μm 滤膜后上柱,再用相同的缓冲液进行洗脱,流速为1 mL/3 min,采用自动部份收集器收集洗脱液测定A值,绘制洗脱曲线。分别将各峰收集后用SDS-PAGE 电泳分析,收集得到各峰的蛋白溶液分别于4 ℃截留分子质量为3500 Da的透析袋中透析72 h 后收集蛋白溶液,−80 ℃冷冻过夜后真空冷冻干燥,收集冻干粉于−20 ℃条件下保存备用。
1.2.5 蛋白表征
1.2.5.1 SDS-PAGE 分析 制备12.5%分离胶、4.5%浓缩胶,电极缓冲液为0.025 mol/L Tris-HCl、0.1%SDS、0.192 mol/L 甘氨酸的缓冲溶液。样品在浓缩胶中电压为80 V,进入分离胶之后将其增至110 V。电泳完毕后染色30 min,最后脱色至背景透明。(Maker:鸡蛋清溶菌酶14.4 kDa、人生长素22.0 kDa、牛碳酸酐31.0 kDa、兔肌动蛋白43.0 kDa、牛血清白蛋白66.2 kDa、兔磷酸化酶97.4 kDa,标准蛋白的标准曲线为y=−1.1608x+2.0666,=0.9807)。
制备15.5%分离胶、10%夹层胶、4%浓缩胶,阳极缓冲液为pH8.9、2 mol/L Tris-HCl 溶液、阴极缓冲液为0.1 mol/L Tris-HCl、0.1% SDS、0.239 mol/L甘氨酸的缓冲溶液。样品在浓缩及夹层胶中电压为30 V,进入分离胶之后将其增至110 V。电泳完毕后考马斯亮蓝染色30 min,最后脱色至背景透明(Maker:3.3、5.8、7.8、14.4、20.1 kDa,标准蛋白的标准曲线为y=−1.8612x+2.4,=0.9574)。
1.2.5.2 Native-PAGE 分析 1.2.4.2 步骤中得到峰1 蛋白用水溶解,然后与缓冲溶液按体积比为1:2混合,缓冲溶液中含有30%甘油、12.5%Tris-HC1(0.5 mol/L,pH6.8)和2%质量浓度为0.5%溴酚兰,充分混合后参照文献[28]方法进行Native-PAGE检测。
1.2.6 蛋白分析与鉴定
1.2.6.1 胰蛋白酶酶解 将Native-PAGE 上的目的条带切成1 mm的胶粒,分别装入1.5 mL 塑料离心管中,加入含有50%乙腈-50% 50 mmol/L NHHCO的脱色液进行脱色,静置10~30 min 后除去脱色液,重复此操作至胶粒无色。每管各加入100 μL 纯乙腈溶液,放置30 min,待胶粒呈白色索至团状,弃去乙腈,室温放置干燥。然后每管各加入100 μL 10 mmol/L的DTT,于56 ℃水浴条件下还原1 h 后,除去DTT,之后再按照100 μL/管的比例加入55 mmol/L 的IAA,室温避光反应1 h,除去溶剂。之后再加脱色液(50%乙腈-50% 50 mmoL/L NHHCO)洗一遍,除去溶剂后,加入100 μL 纯乙腈,放置30 min,待胶粒呈白色索至团状,弃去乙腈,室温放置干燥。用50 mmol/L NHHCO溶液配制得到浓度为0.22113 U/μL 的酶液,按照7~10 μL/管的量加入酶液,于4 ℃条件下孵育40 min 后取出,每管补加5~10 μL 50 mmol/L NHHCO溶液,密封于37 ℃水浴条件下反应16 h。然后每管加100 μL 提取液(5%甲酸-50%乙腈-45%水,于37 ℃条件下水浴1 h后,超声5 min,离心5 min,将提取液移入另一新离心管中,重复提取一次,将提取液合并,真空离心干燥。酶切后的肽段使用自填脱盐柱脱盐,于45 ℃真空离心浓缩仪中挥干溶剂备用以待下一步质谱检测。
1.2.6.2 LC-MS/MS 检测 将上述处理好的样品在流动相A(0.1%甲酸,2%乙腈/水)中溶解后使用自填脱盐柱脱盐,在线LC-MS/MS 分析。LC-MS/MS过程参数设置为:
毛细管液相色谱分离条件:流动相A 为含有体积分数0.1%甲酸,2%乙腈的超纯水,流动相B 为含有体积分数0.1%甲酸,19.9%超纯水的乙腈溶液,预柱为packed with Acclaim PepMap RPLC C(100 Å,5 μm,300 μm×5 mm),流速为600 nL/min。经过反复多次的试验,最终采用线性梯度洗脱程序为:开始0 min,4% B;0~2 min,4%~8% B;2~45 min,8%~28%;45~55 min,28%~40% B;55~56 min,45%~95% B;56~66 min,95% B。
质谱条件:一级质谱参数:Resolution:70000;AGCtarget:3e6;MaximumIT:40ms;Scanrange:300 to 1800 m/z;二级质谱参数:Resolution:17500;AGCtarget:1e5;MaximumIT:60ms;TopN:20;NCE/steppedNCE:27。
质谱原始文件使用Maxquant(1.6.2.10)分别检索目标蛋白数据库,检索参数如下:固定修饰:脲基(C);可变修饰:氧化(M),乙酰基(Protein N-term);酶:胰蛋白酶;肽段/碎片离子质量数:单同位素;显著性阈值:0.01。
1.2.7 核桃球蛋白抗氧化能力测定 ABTS 法参考汪小玉等的方法:先制备ABTS 工作液,测定时将球蛋白和纯化得到蛋白主要组分加水制成质量浓度为400、200、100、50、25、12.5、6.25、3.125 μg/mL的待溶液,吸取待测溶液各20 μL,置于96 孔板中,每孔加入工作液200 μL,混匀,静置10 min,于734 nm 波长处测定吸光度。以维生素C 为阳性对照,按下式计算ABTS自由基清除率,利用SPSS 软件分别计算IC、IC,并计算其抗坏血酸当量,用AEAC 表示,ABTS自由基清除率按式(2)进行计算,样品的抗坏血酸当量按式(3)进行计算:
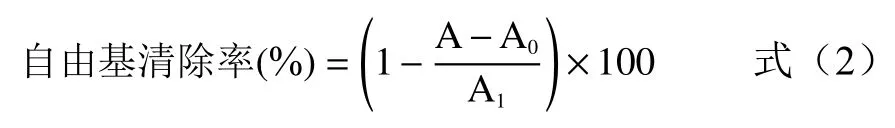
式中:A 为样品溶液+ABTS 的吸光度;A为水+ABTS 的吸光度;A为样品溶液+水的吸光度。

式中:IC为维生素C 对ABTS 阳离子自由基的半数抑制浓度,IC为样品对ABTS 阳离子自由基的半数抑制浓度。
1.3 数据处理
本实验所有数据均重复三次,结果用±标准差表示,数据利用Excel 2019、Origin 来绘制图形,SPSS软件进行方差及显著性分析。
2 结果与分析
2.1 核桃球蛋白的提取制备
本研究以冷榨脱油后的核桃粕为原料,经二次脱脂处理后核桃粕的蛋白含量从39.90%提高至47.10%(表1)。韩海涛等研究表明冷榨的“清香”核桃饼中蛋白含量为48.64%,脱脂后蛋白含量提高至60.05%,略高于本研究的结果,可能是因为原料存在差异和提取工艺的不同。

表1 不同物质的蛋白含量Table 1 Protein contents of different substances
脱脂核桃粕进一步提取获得了球蛋白粗提物,其蛋白含量可达51.53%,占核桃总蛋白的15.3%,此结果与毛晓英等研究新疆和田核桃的结果基本一致。而王晓飞等制备得到蛋白含量为80.71%的球蛋白,高于本研究的结果,一方面可能是提取液种类不同;另一方面可能是考虑到硫酸铵盐析纯化蛋白时,蛋白溶液中引入硫酸铵不利于后续处理,所以本研究在制备球蛋白时没有进行硫酸铵盐析这一操作步骤所致。
2.2 核桃球蛋白等电点测定结果
如图1 所示,pH 为4 时,上清液吸光度最小,因此,初步确定核桃球蛋白等电点在4 左右。继续研究pH4 左右的核桃球蛋白等电点(图2),发现该蛋白在pH3.8 时上清液中的蛋白含量最少,而随着pH 低于或者高于3.8 时蛋白含量又呈现明显的上升,这表明其等电点为pH3.8。核桃球蛋白的等电点与其他植物来源的球蛋白的等电点值相近,如花生粕、米糠、谷子中球蛋白的等电点分别为4.6、4.0 和3.6,他们也与大多数食品蛋白质一样属于典型的酸性蛋白质,而对于核桃蛋白等电点的解析也是为后续该蛋白的纯化提供了基础数据。
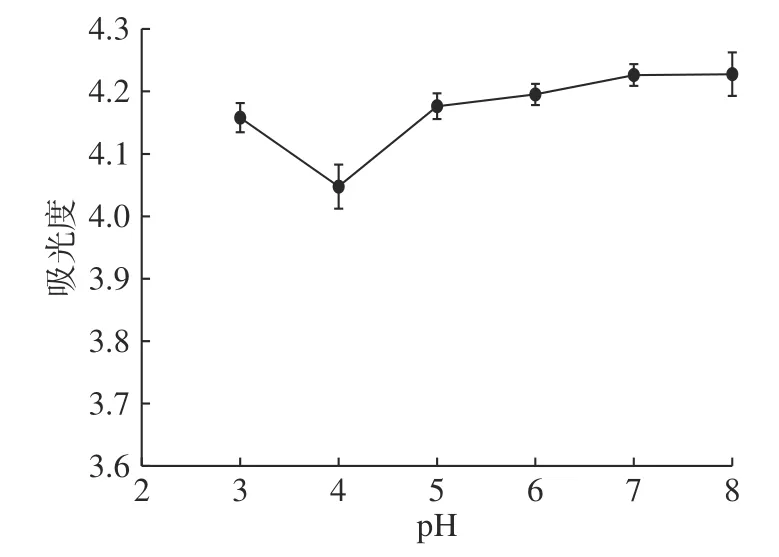
图1 不同pH 下离心后上清液蛋白吸光度Fig.1 Protein absorbance of supernatant after centrifugation at different pH
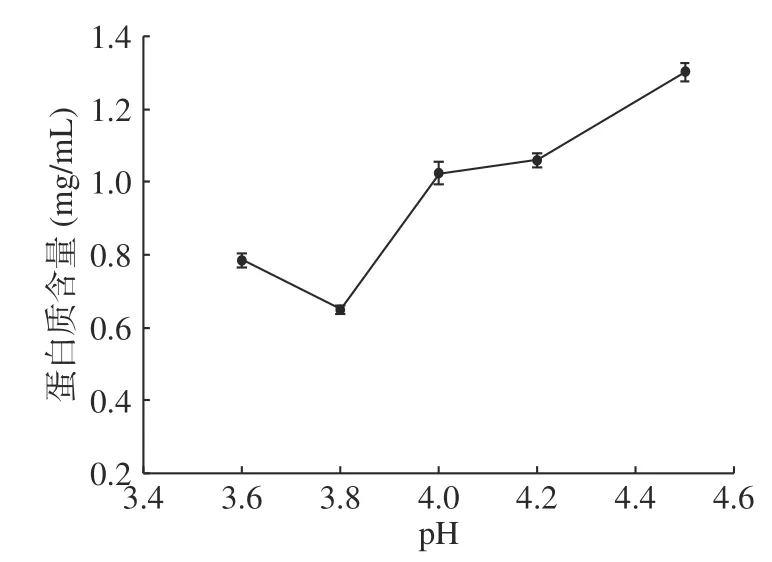
图2 不同pH 下离心后上清液蛋白含量Fig.2 Protein content of supernatant after centrifugation at different pH
2.3 核桃球蛋白纯化结果
球蛋白粗提物先经离子交换层析色谱纯化,获得两部分蛋白分离物(图3),采SDS-PAGE 分析各部分的蛋白条带分布情况(图4),其中峰1 的分离效果更好,继续进行后续纯化。采用凝胶过滤层析进一步分离峰1 中的蛋白,共得到2 个峰(图5)。其中,首先收集到的蛋白经SDS-PAGE 分析后证实为球蛋白中10.1 kDa 大小的主要蛋白(图6),其纯度可达电泳级纯。再经Native-PAGE 电泳分析该组分,它由两个活性蛋白条带组成,后续分别对两个蛋白条带进行蛋白鉴定。
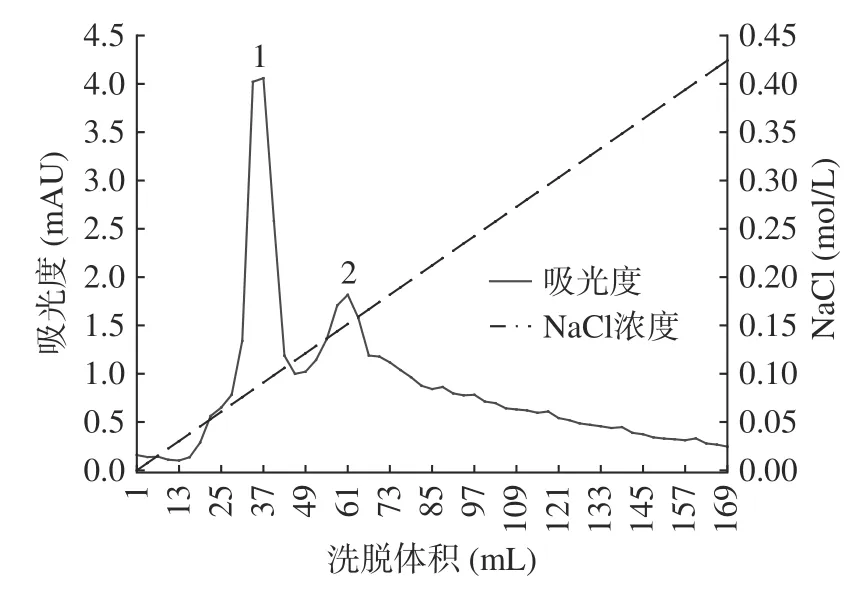
图3 脱脂核桃粕球蛋白离子交换层析Fig.3 Ion exchange chromatography of globulin from degreased walnut meal
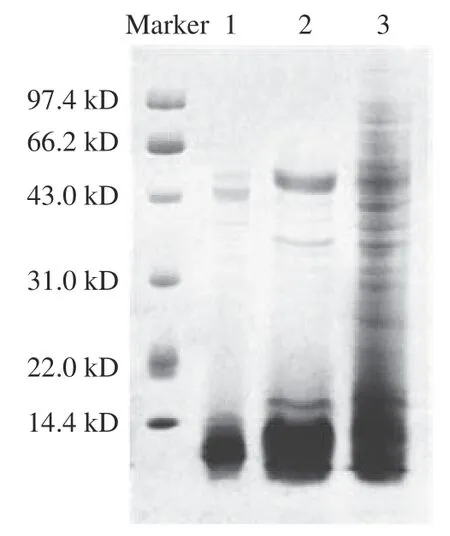
图4 脱脂核桃粕球蛋白SDS-PAGE 电泳图Fig.4 SDS-PAGE electropherogram of defatted walnut meal globulin

图5 脱脂核桃粕球蛋白凝胶过滤层析Fig.5 Gel filtration chromatography of degreased walnut meal globulin
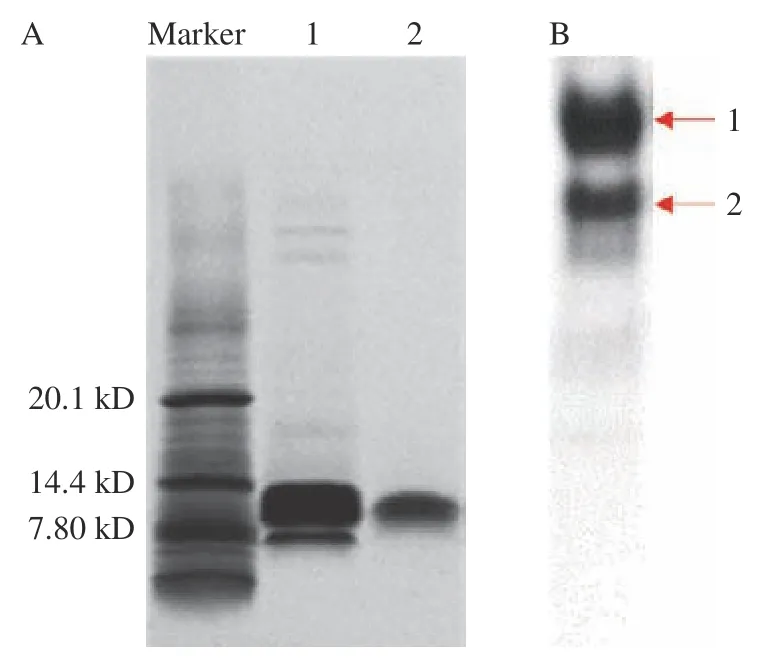
图6 球蛋白SDS-PAGE 电泳(A)和纯化得到主要蛋白Native-PAGE(B)电泳分析Fig.6 Globulin SDS-PAGE electrophoresis (A) and purification of the main protein Native-PAGE (B)electrophoresis analysis
脱脂核桃粕球蛋白粗提物由多种蛋白组成,其中含有2 个主要条带(图6),其分子量分别为7.8 和10.1 kDa(图6)。而Mao 等研究发现新疆核桃的球蛋白显示出九个条带,其中两个主要条带的分子量为20.1 和35.0 kDa,这可能是由于核桃品种不同而造成的差异。
2.4 蛋白的质谱鉴定结果
2.4.1 条带1 蛋白的鉴定结果 LC-MS/MS 检测结果显示,Native-PAGE 电泳图上的条带1 蛋白经液相色谱分离后,在质谱中检测到的肽段数量与丰度较高(图7),共检测到145 条肽段,其中的98 条肽段均在其对应的蛋白质组中是唯一的。质谱采集结果经软件MaxQuant(1.6.2.10)数据库检索,得到鉴定蛋白的比对结果,仅列出得分较高的前5 个蛋白比对结果(表2)。综合蛋白的得分和含量结果表明该蛋白为vicilin Car i 2.0101,属于7S 种子储存蛋白家族,是一种7S 球蛋白。这也与Regina 等报道的结果一致,其发现7S 球蛋白通常由大量多肽组成,其分子质量范围在10~70 kDa,不存在二硫键。

表2 条带1 蛋白的鉴定结果Table 2 Identification results of band 1 protein

图7 条带1 蛋白的LC-MS/MS 总离子流图Fig.7 LC-MS/MS total ion chromatogram of band 1 protein
2.4.2 条带2 蛋白的鉴定结果 LC-MS/MS 检测结果显示,Native-PAGE 电泳图上条带2 蛋白经液相色谱分离后,在质谱中检测到的肽段数量与丰度较高(图8),共检测到177 条肽段,其中的127 条均在其对应的蛋白质组中是唯一的。质谱采集结果经过软件MaxQuant(1.6.2.10)数据库检索,得到鉴定蛋白的对比结果,仅列出得分较高的前5 个蛋白对比结果(表3)。综合蛋白的得分和含量结果表明该蛋白为2S 清蛋白。这也与Downs 等报道的结果一致,他们表明2S 清蛋白是一类结构紧凑,半胱氨酸残基结构保守的低分子量蛋白,其分子质量范围在10~15 kDa 之间。另有,Spiric 等从山核桃中提纯得到由5 和12 kDa 的主要条带及16 kDa 蛋白条带共同组成的天然的2S 清蛋白,与本研究得到的结果有所不同。本文通过Osborne 法制得核桃球蛋白,在对其进行纯化后得到2S 清蛋白,这与郭彦飞报道结果不同,他们证明苦荞中属于2S 清蛋白家族的16 kDa 过敏原仅存于苦荞种子清蛋白中,推测这可能是由于采用此方法提取核桃清蛋白和球蛋白时,两种蛋白很难绝对分开,导致出现交叉的现象。

表3 条带2 蛋白的鉴定结果Table 3 Identification results of the band 2 protein

图8 条带2 蛋白的LC-MS/MS 总离子流图Fig.8 LC-MS/MS total ion chromatogram of Band 2 protein
2.5 核桃球蛋白抗氧化效果
ABTS被广泛应用于测定抗氧化剂的总抗氧化能力(图9,表4)。核桃球蛋白、球蛋白纯化得到主要蛋白组分蛋白以及维生素C 对ABTS自由基的清除能力均与其质量浓度呈正相关,其强弱依次为维生素C>纯化得到主要蛋白组分>核桃球蛋白,同浓度下球蛋白纯化得到蛋白组分对 ABTS自由基的清除率显著高于核桃球蛋白。核桃球蛋白和球蛋白纯化得到主要蛋白组分的IC值分别为0.302、0.075 mg/mL,两者之间存在显著性差异,后者IC值仅为前者的1/4。同时球蛋白纯化得到主要蛋白组分的抗氧化能力弱于对照品维生素C,但与之相比也是具有较好的清除ABTS自由基的能力。本试验的结果表明,球蛋白及从球蛋白中纯化得到主要蛋白组分均具有较高的总抗氧化能力,可以利用这一性质,将其添加到肉汤、火腿等食品中,提高产品的货架期。

表4 不同蛋白对ABTS+自由基的IC50、AEACTable 4 IC50,AEAC of different proteins to ABTS+ free radicals

图9 不同质量浓度蛋白对ABTS+自由基的清除率Fig.9 Scavenging rate of ABTS+ free radicals by protein at different mass concentrations
3 结论
本文以改进的Osborne 法制备脱脂核桃粕球蛋白粗提物,球蛋白粗提物蛋白含量达51.53%,占核桃总蛋白的15.3%,其等电点为3.8;经离子交换层析和凝胶过滤层析两步纯化获得大小为10.1 kDa 的球蛋白;该蛋白在活性状态下呈现出两条条带,经HPLCMS 分析表明条带1 为vicilin Car i 2.0101,是一种7S 球蛋白,条带2 为2S 清蛋白。研究发现,核桃球蛋白粗提物和纯化的球蛋白均具有良好的抗氧化能力,而纯化后球蛋白的抗氧化效果是粗提蛋白的4 倍,其IC值可低至0.075 mg/mL。通过以上研究,可为深入了解与开发核桃球蛋白组分与功能提供一定的理论基础。
