盐度对隐秘小环藻生长、沉降及藻壳物理性质的影响❋
2022-09-05程云飞王路路朱葆华潘克厚
程云飞, 王路路, 李 赟, 朱葆华, 潘克厚
(海水养殖教育部重点实验室(中国海洋大学), 山东 青岛 266003)
盐度是影响微藻生长的重要因素之一[1]。在海洋环境中,特别在河口和海岸地区,盐度波动很大,这对浮游藻类的代谢反应和分布模式影响极显著,这也是影响河口和沿海湿地多数硅藻分布的重要因素[2-4]。Pseudo-nitzschiaaustralis和Ditylumbrightwellii的细胞密度和生长速率的增加与盐度的增加直接相关[5-6],而Thalassiosirapseudonana和Cyclotellameneghiniana的最大生长速率均在较低盐度条件下出现,从最适盐度向最适盐度的两端生长速率持续下降[7]。不仅如此,盐度还显著影响微藻的形态,如T.weissflogii[8]、C.meneghinia-na[7]和T.pseudonana[9]的细胞体积随盐度增大而减小,Actinocyclusnormanii[10]细胞体积则随盐度增大而增大。多数微藻的蛋白质、脂质和碳水化合物含量受盐度水平的影响,调控盐度是生产具有高附加值产物的有效手段[11-12],如低盐度时T.weissflogii和Chaetoceroscf.wighamii的多糖、脂质和蛋白质含量较高[13-14];C.vulgaris和A.obliquus增加盐度(氯化钠)后不仅提高了脂肪酸含量,也改变了脂肪酸组成[15],盐度(氯化钠)对Naviculasp.的脂质和脂肪酸组成也产生了影响,随着盐度增加其脂质含量增加,但盐度超过一定值后其脂质含量逐渐下降[16]。在大规模微藻培养过程中,由于持续地蒸发及频繁地添加营养盐,培养液的盐度普遍出现增高趋势,有必要广泛分析盐度增加对微藻的形态特征、生长以及生化组分的影响。
隐秘小环藻(Cyclotellacryptica)是隶属于圆筛藻科小环藻属的单细胞硅藻,细胞呈圆柱状,盐度适应性强,生长快速,富含岩藻黄素[17]和不饱和脂酸,其藻壳具有显著的止血能力[18],是开发新型止血剂的理想材料,其开发前景广阔。我们在实验室条件下研究了不同盐度条件对隐秘小环藻生长状况的影响,发现不同盐度下细胞沉降能力有明显差别,为探究引起差别的原因,本文研究不同盐度对隐秘小环藻细胞大小以及硅藻壳特性的影响。本研究可为隐秘小环藻藻种的培养以及综合利用提供依据。
1 材料与方法
1.1 隐秘小环藻培养及盐度梯度设置
隐秘小环藻来自中国海洋大学应用微藻生物学实验室藻种库,f/2培养液用水为青岛沿海区域海水,pH为8.0±0.3,盐度为30,用0.45 μm混合纤维素酯膜过滤,高温灭菌(20 min,121 ℃)后加入f/2培养基母液[19],按照1 000∶1的比例进行混合。藻种培养温度为20 ℃,光照强度为25 μmol·m-2·s-1,光暗周期为L∶D=12 h∶12 h。
结合预实验结果,调整海水、淡水(RO)比例,设置5个盐度梯度5、10、20、30和40,每一梯度设置3个平行组,将盐度30条件下培养的藻细胞接种到灭菌后的各盐度梯度f/2培养液(500 mL三角锥瓶加300 mL培养液)中,培养期间每天定期摇匀藻液。
1.2 生长、光合潜力及生物量测定
每个盐度梯度设置3个平行,实验期间每天定时取1 mL藻液,使用紫外分光光度计(U-3310,日本)测定藻液OD750值,采用相对生长速率[20]计算公式 μ=(lnNt-lnN0)/t计算不同盐度条件下隐秘小环藻的相对生长速率,式中Nt为第t天细胞OD750值,N0为初始细胞OD750值。
每天同一时间各取2 mL藻液,暗处理7 min,使用脉冲振幅调制式荧光计(Water-PAM fluorometer, Walz, Effeltrich, Germany)测定叶绿素荧光参数Fv/Fm(PSⅡ的最大光能转化效率)和Y(Ⅱ)(PSⅡ的实际光能转化效率)。
在实验周期末(第7天)进行生物量的测定。取各盐度3个平行组的摇匀后的藻液10 mL(V),使用提前烘至恒重(m0)的GF/C膜(WhatmanTM)抽滤藻细胞,并使用蒸馏水冲洗2~3次,60 ℃烘至恒重后进行称量(m1),采用下式计算生物量(g/L),生物量=(m1-m0)÷V×1 000。
1.3 细胞大小测定
在实验周期第3天取出摇匀后的各盐度培养条件下若干体积的藻液,该藻液用于细胞大小的测量,使用光学显微镜(CX22LED,OLYMPUS,日本)目微尺测量35个藻细胞的高度(h)和直径(D),将细胞视为圆柱体来计算细胞体积(V)。
1.4 沉降率测定
为比较盐度对试验微藻沉降速率的影响,待藻细胞培养到平台期时,每一盐度水平各准备12支玻璃试管,每支试管加入摇匀藻液4 mL,之后将藻液放置于静置环境中使其自然沉降。实验初始保持各盐度水平细胞密度一致(OD750值),分别静置1、2、4和7 h后取样,于每个取样时间点在试管固定位置取1 mL藻液,使用紫外分光光度计(U-3310,日本)测定取样藻液OD750值。沉降率计算方法如下:沉降率=(OD750值(初始)-OD750值(t))÷OD750值(初始),式中OD750值(初始)为初始时藻液吸光值,OD750值(t)为第t小时藻液吸光值。
1.5 藻壳物理性质测定
将培养至一定浓度的隐秘小环藻离心(4 000 r/min,5 min,5840R,Eppendorf,Germany)并弃上清,用于提取藻壳。具体方法为:藻泥中加入20 mL浓硫酸,60 ℃水浴1 h,然后加入等体积浓硝酸于60 ℃水浴24 h,筛绢(2 500目)过滤、无水乙醇洗涤,烘干后观察藻壳形态及分析物理特性[18]。使用冷场发射扫描电子显微镜(日立S-4800,日本)观察藻壳形态。使用自动气体吸附分析仪(Autosorb-IQ,Konta,美国)进行N2-解吸等温线测量藻壳比表面积、孔容和孔径[18],随后根据吸脱附数据进行自动计算。
1.6 数据分析
首先计算每个处理的三次重复平均值和标准误差。用Excel 2019绘图。使用SPSS 25进行单向方差分析(One-way ANOVA),在方差分析结果显著或极显著时(P<0.05或P<0.01),采用多重比较(LSD法)进行组间的显著性比较。
2 结果
2.1 盐度对隐秘小环藻的生长、光合系统及生物量的影响
5个盐度水平下培养的隐秘小环藻的相对生长速率见表1。表1显示,不同盐度(5、10、20、30和40)培养条件下最大相对生长率的差异并不显著(P>0.05),但达到最大相对生长率所需的时间不同,与接种前培养液的盐度(30)相差越大,达到最大相对生长率所需的时间就越长。

表1 不同盐度培养条件下隐秘小环藻的相对生长率
与相对生长率的比较结果不同,初始盐度为5、10、20、30和40时,隐秘小环藻第0天的Fv/Fm分别为0.273、0.340、0.510、0.634和0.478,One-way ANOVA表明不同盐度组的Fv/Fm差异极显著(P<0.01,见图1a)。经过2 d的适应后,盐度5、10、20和40条件下Fv/Fm逐渐达到最大值,随后各盐度培养下微藻的Fv/Fm均逐渐下降。整个培养期间各盐度条件下试验微藻的Y(Ⅱ)一直呈下降趋势(图1b)。至培养末期,各实验组Fv/Fm值和Y(Ⅱ)均差异极显著(P<0.01),盐度5、盐度10组均显著高于盐度20、盐度30、盐度40组。
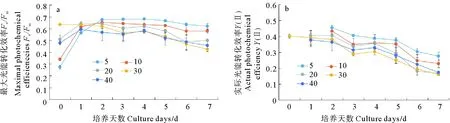
图1 不同盐度培养条件下隐秘小环藻叶绿素荧光参数变化
隐秘小环藻的生物量随培养环境盐度的增加而增大。结果如图2所示,盐度5~40水平下隐秘小环藻的生物量分别为0.170、0.223、0.250、0.343和0.367 g/L,One-way ANOVA分析表明各盐度组藻细胞生物量差异极显著(P<0.01)。

(图中字母为多重比较结果,盐度水平间字母相同为差异不显著、字母不同为差异显著。The letters represent the multiple comparison results, representing not significantly when same letter exists between the salt levels and significantly when no same letter.)
2.2 盐度对隐秘小环藻沉降性能的影响
图3显示不同盐度培养条件下隐秘小环藻沉降率的变化。在细胞密度一致的条件下静置1 h,盐度40实验组的细胞沉降率为33.2%,其他实验组细胞并未沉降,相反存在因扩散导致沉降率下降的现象(数据未列出)。静置2 h,盐度40实验组沉降率已达到60%以上,其他盐度实验组才开始沉降,但沉降率最大也未超过20%。从静置4 h开始,各实验组均开始快速沉降,随着试验组盐度的升高,试验微藻的沉降率也越高。这说明高盐度可以促进试验微藻的快速沉降。

(字母为多重比较结果,同一取样时间下盐度水平间字母相同为差异不显著,字母不同为差异显著。The letters represent the multiple comparison results, representing not significantly when same letter exists between the salt levels and significantly when no same letter at same sampling time.)
2.3 盐度对隐秘小环藻细胞大小的影响
隐秘小环藻细胞大小随培养环境盐度水平增加而增大。统计测量结果如表2所示,盐度5实验组与盐度40实验组的相比较,藻细胞的高(h)增加约2.1 μm、直径(D)增加约2.5 μm、体积(V)增加约487 μm3。对盐度5~40条件下的藻细胞大小进行One-way ANOVA分析表明,藻细胞的高、直径、体积均差异极显著(P<0.01)。

表2 不同盐度培养条件下隐秘小环藻细胞大小
2.4 盐度对隐秘小环藻藻壳物理性质的影响
扫描电镜显示,隐秘小环藻壳面呈圆盘形(见图4a1—a5),平均直径约为10 μm(盐度30左右时),表面由壳孔区、中心区、肋以及管状突出结构等组成。藻壳局部(见图4b1—b5)清晰显示,壳孔区所有孔都呈径向有序排列,大小与形状存在一定差异,相邻孔区之间有呈放射状分布的肋,多数肋在壳面边缘具有管状突出结构,壳面中心部分相对平整,具有一个或两个管状突出结构。局部进一步放大(见图4c1—c5)显示,藻壳具有两层结构,内层孔径比外层小。比较发现,盐度并未明显影响隐秘小环藻壳面的形态特征。

(a,b,c分别代表壳面整体、局部、局部放大;1,2,3,4,5分别代表盐度5,10,20,30,40。a,b,c represent the frustules entirety, part, partial enlargement respectively; 1, 2, 3, 4, 5 represent salinity 5, 10, 20, 30, 40 respectively.)
为进一步分析盐度对隐秘小环藻硅质壁物理性质的影响,本研究选取盐度5和40这两个盐度差别最大的实验组,对这两个实验组的微藻硅质壁的3个物理参数进行比较,比较结果如表3所示,虽然这两个盐度下硅质壁的平均孔径没有差别,但盐度40实验组中藻壳的孔容为0.47 cm3/g,是盐度5实验组中藻壳孔容(0.15 cm3/g)的3倍以上,说明高盐度下藻壳的孔数量大幅增加。由于孔数量增加,盐度40实验组微藻硅质壁的比表面积为256.31 m2/g,也是盐度5实验组藻壳比表面积(83.40 m2/g)的3倍左右。

表3 盐度5和40培养条件下隐秘小环藻藻壳物理性质
3 讨论
通常认为盐度是决定河口硅藻分布的一个重要因素,对盐度变化的耐受性是河口和沿海湿地多数硅藻生存的先决条件[4]。已有的研究表明[21],有些微藻可耐受广泛的盐度,并表现出对较低盐度的偏好。我们的实验结果表明,本研究的隐秘小环藻藻株具有广泛的盐度适应性,对低盐度(5、10、20)表现出更好的适应性。当细胞从接种前盐度30转移到各设定盐度时,受盐度变化的影响,在恢复生长前需要一定时间的代谢调整,实验盐度与接种前盐度30相差越大,适应时间越长。伴随着盐度适应期,可见到接种微藻初始光合能力受到显著影响。这说明长期适应自然环境变化的隐秘小环藻具有突出的应对盐度波动的调节能力[22-23]。在本实验盐度条件设置范围内,隐秘小环藻的生物量随盐度梯度增加而增高。
有研究表明,T.pseudonana和T.weissflogii细胞随盐度升高而减小[9,14],而A.normanii则随盐度升高而增大[10],这说明盐度对微藻细胞体积的影响存在藻种的差异性。本实验测量了各实验盐度下35个藻细胞的高度、直径和体积,发现均具有随培养环境盐度增加而增大的现象,其中盐度水平差别最大(5和40)的两组细胞的这三项指标分别相差0.25、0.34和1.26倍,根据多重比较(LSD法)结果分析,可将差异来源分为三组,即盐度5、盐度10和20、盐度30和40。细胞大小作为微藻的基本特征之一,从营养获取到光合生理特征都随细胞大小而变化[24-25],由于水生食物网在很大程度上是由被捕食者(如微藻)形态大小决定的,初级生产者形态大小的改变可能会影响能量向更高营养水平的传递[26-27]。
对于细胞大小与藻细胞沉降的关系,本研究发现隐秘小环藻的沉降率随着盐度增加而增大。在实验第4 h时,盐度40组沉降率为88.9%,盐度5组则仅为12.4%。这说明隐秘小环藻的大小似乎与藻细胞的沉降存在一定的关系。一般来说,下沉速率是随着细胞大小的增加而增大[28]。培养微藻的沉降特性的重要性仅次于生长速率,沉降率不仅决定微藻的采收效率,也是微藻与环境相互作用、与其他群落营养联系的关键生理生态参数[29]。为了满足对光照和营养的需求,沉降是浮游微藻在整个生命周期及其面对不同生态环境不断调整其浮游状态的重要方式[30]。除细胞大小外,在实验期间我们发现,沉降前细胞先在一定时间内聚集成絮团,随后以絮团的形式沉降,且在高盐度下容易形成絮团。由于细胞表面许多官能团都是电负性的,已有研究通过外加成分,提高培养液的电子强度从而加快藻细胞的沉降[31]。我们推测培养液盐度的增加,提高了培养液的电子强度,中和了细胞表面的电负性,使得高盐度下藻细胞更容易形成絮团。
对于多数硅藻,其原生质体外有刚性的、具有一定厚度的硅质壁保护[32],可以推断硅藻细胞大小的变化必然影响硅质壁的性质,这说明环境条件变化(如盐度),会影响硅藻的硅化作用。对T.punctigera和T.weissflogii的研究表明,不同盐度培养条件下外部离子强度可改变硅藻生物二氧化硅纳米结构,认为外部离子浓度是影响生物硅形成的重要非生物因素[33]。众多实验研究[34-37]表明盐度变化能够改变许多硅藻的壳面形态。隐秘小环藻体表具有硅质细胞壁,细胞大小发生变化后硅质细胞壁也应该会发生改变。但本研究的结果显示,在本实验盐度水平下隐秘小环藻藻壳的壳面特征几乎无显著变化,对硅质壁进行N2-解吸等温线测量表明盐度虽没有影响孔径大小,但盐度40条件下该藻藻壳的比表面积和孔容均显著大于盐度5条件下的藻壳。有关藻壳特征与藻细胞沉降的关系尚未见报道,根据本研究结果推测,由比表面积增大导致的藻细胞表面吸附力增强可能是高盐度下隐秘小环藻藻细胞容易沉降的原因。
4 结语
本文主要研究了不同盐度培养条件对隐秘小环藻的生长、沉降和藻壳物理性质的影响。研究结果表明,隐秘小环藻对盐度的适应性相当强,实验盐度对其相对生长率未产生显著影响,但同时也看到不同盐度条件下,隐秘小环藻的光合潜能存在显著变化,表明该藻株的光合系统具有应对盐度变化的调适能力。不同盐度培养条件下,隐秘小环藻的沉降率表现出随盐度增加而增快的现象。虽然通过扫描电镜观察并未发现藻壳表面物理特征发生明显改变,但藻细胞体积、藻壳总孔体积、藻壳比表面积均随着盐度的增加而显著增大,这表明高盐度造成的藻细胞体积变大及藻壳物理性质变化是隐秘小环藻藻细胞容易下沉的原因。
