鸭疫里默氏杆菌贵州流行株蜂胶灭活疫苗制备
2022-08-23马光强刘丽娟陈国权吴良涛刘军泽李潇蒙潘成文周碧君
马光强,刘丽娟,陈国权,吴良涛,杨 均,刘军泽,李潇蒙,潘成文,周碧君
(1.黔南民族职业技术学院,都匀 558000;2.都匀市农业农村局,都匀 558000;3.贵州大学动物科学学院,贵阳 550025)
鸭疫里默氏杆菌(Riemerellaanatipestifer,RA)在世界各水禽养殖地区均有流行,该病原感染引起的雏鸭发病率和死亡率高,且近年来在中国呈上升趋势,防控形势愈发严峻,给中国养鸭业造成了巨大的经济损失[1-5]。RA易对多种抗菌药物产生耐药性,临床治疗中抗菌药物的滥用致使其耐药性增强,对人类食品卫生安全造成威胁,因此,疫苗免疫被认为是防控该病的主要措施。RA血清型复杂,各血清型之间缺乏有效的交叉免疫保护,且不同养殖地区流行的RA血清型相差较大,需根据各地流行血清型制备灭活疫苗进行免疫防控[6-10]。
蜂胶(propolis)是蜜蜂从植物中采集的树脂与自身分泌物混合而成的一种胶状固体物,含维生素、脂肪酸、多糖等多种生物活性物质,具有抗氧化、抗微生物功能,可激活机体自身免疫系统,增加免疫细胞数量,增强机体免疫功能[11-14]。郭宇飞[15]研究对比了蜂胶佐剂、油佐剂和铝胶佐剂对RA四价灭活疫苗的免疫效果,表明蜂胶佐剂疫苗具有保护力和抗体产生速度快、保护持续时间长等优势。刘帅[16]研究对比了蜂胶佐剂和弗氏完全佐剂对杀鲑气单胞菌灭活疫苗的免疫效果,表明蜂胶佐剂诱导机体产生的免疫效果更佳且产生的毒副作用更低。以上研究结果表明,蜂胶佐剂是一种效果良好的免疫佐剂,可用于灭活疫苗制备。本试验用贵州省三穗县分离的RA贵州流行株(RA-SS-8株)作为试验菌株,以蜂胶为佐剂,进行灭活疫苗研制,以期为有效控制该地区鸭疫里默氏杆菌病奠定基础,同时为蜂胶灭活疫苗制备和动物免疫试验提供资料。
1 材料与方法
1.1 材料
1.1.1 试验动物和菌株 1日龄未经免疫的清洁级麻鸭购自贵州同兴农牧发展有限公司。试验RA贵州流行株(RA-SS-8株),2019年7月分离于贵州省三穗县某规模化养鸭场,已鉴定为RA血清2型,由贵州省动物疫病与兽医公共卫生重点实验室保存。
1.1.2 主要试剂及仪器 无菌脱纤维绵羊血(南京便诊生物科技有限公司);胰酪大豆胨液体培养基(TSB,杭州微生物试剂有限公司);新生牛血清(浙江天杭生物科技有限公司);酵母粉和胰蛋白胨(OXOID公司);鸭传染性浆膜炎二价灭活疫苗(1型Raf 63株+2型Raf 34株,天津瑞普生物技术股份有限公司);蜂胶(黄酮含量为17%,上海源叶生物科技有限公司);甲醛(含量为38%,西陇科学股份有限公司)。
紫外可见分光光度计(尤尼柯(上海)仪器有限公司);恒温水浴振荡器(上海新苗医疗器械制造有限公司);漩涡混匀器(SCILOGEX公司);电热恒温培养箱(上海一恒科学仪器有限公司);全温培养摇床(上海新苗医疗器械制备有限公司)。
1.2 方法
1.2.1 RA贵州流行株的复苏及生长曲线测定 取冻存的RA贵州流行株(RA-SS-8株),无菌操作下用接种环蘸菌液接种于巧克力琼脂培养基上,于37 ℃、5% CO2培养箱内培养16~24 h,复苏后观察菌落特征做初步鉴定。挑取菌落形态典型的单个菌落接种于TSB培养基(含5%新生牛血清)进行增菌培养,经纯化扩繁后作为种子菌液置于4 ℃保存。
分光光度法测定细菌生长曲线:将种子菌液按1∶100比例接种于LB培养基(含5%新生牛血清),置于37 ℃、180 r/min恒温振荡培养。初期每隔1 h在超净工作台中无菌取样,在波长600 nm处测定光密度值(D600 nm值),当D600 nm值呈明显上升后改为每0.5 h测定1次,在D600 nm值趋于稳定后改为每1 h测定1次,连续测定16 h,每个时间点重复测量3次后取平均值,每次取样应留样做好标记用于细菌平板计数,根据D600 nm值绘制标准曲线。
平板计数法测定细菌生长曲线:取不同时间段已测D600 nm值的备用菌液,混匀后用无菌PBS依次做10倍倍比稀释(即100 μL待测菌液+900 μL无菌PBS),选取10-5、10-6、10-7和10-84个稀释度,各取菌液100 μL涂布于巧克力琼脂培养基上。每个梯度重复3次,待菌液完全吸收后于37 ℃、5% CO2恒温箱内培养16 h。记录每个平板上的菌落数,菌落数在30~300的平板计数有效,取有效计数值的平均值,根据相应的D600 nm值计算与活菌数的相关关系。
1.2.2 RA菌液制备 一级种子的增殖及鉴定:取鸭疫里默氏杆菌候选菌株,接种于含 5%新生牛血清的LB液体培养基中,37 ℃培养 16~22 h,划线接种于含 5%新生牛血清的TSB培养基上,在含 5% CO2条件下,37 ℃培养 24~48 h,选 5~10 个圆形、凸起、透明、呈露珠样的典型菌落,分别划线接种于含 5%新生牛血清的TSB营养琼脂斜面若干,37 ℃培养 24~48 h,作为一级种子,置 2~8 ℃保存,使用期不超过 7 d。二级种子的增殖及鉴定:取一级种子接种于含5%新生牛血清的LB液体培养基中,37 ℃培养 18~22 h,取样用含 5 %新生牛血清的TSB营养琼脂平板做纯粹检验和活菌计数。置 2~8 ℃保存,使用期不超过 2 d。
1.2.3 RA贵州流行株蜂胶灭活疫苗的制备
1.2.3.1 灭活条件筛选 以浓度为38%的甲醛溶液作为灭活剂,采用化学灭活法对RA-SS-8株进行灭活处理。试验分5个组,每个组4支试管,每支试管含5 mL菌液。各组分别用终浓度为0、0.1%、0.2%、0.3%和0.4%的甲醛溶液进行处理,分别于处理后6、12、18和24 h时各取100 μL涂布于巧克力琼脂培养基上,于37 ℃、5% CO2的恒温箱内培养24 h,根据结果确定最终的甲醛使用浓度。
1.2.3.2 蜂胶佐剂制备 将蜂胶置于-20 ℃冰箱冷冻24 h以上,取1 g蜂胶使其充分粉碎,溶于4 mL、95%乙醇中,于25 ℃恒温水浴振荡器中浸提72 h,期间漩涡振荡数次。以5 000 r/min离心10 min,取上清过滤,用无菌PBS调整使其干物质含量为20 mg/mL,密封保存于4 ℃备用。
1.2.3.3 蜂胶疫苗制备 将灭活检验合格的菌液用无菌PBS重悬洗涤3次,并用无菌PBS调整菌液浓度为7.6×109CFU/mL。取制备的灭活菌液与蜂胶乙醇浸提液按1∶1(V/V)混合,搅拌至黄褐色混悬液获得蜂胶灭活疫苗,无菌分装于玻璃瓶内,经无菌检验合格后密封保存于4 ℃备用。
1.2.4 RA贵州流行株蜂胶灭活疫苗的检验
1.2.4.1 疫苗无菌检验 取制备好的蜂胶灭活疫苗100 μL涂布于巧克力琼脂培养基上,于37 ℃、5% CO2恒温箱内培养24 h,设置3个重复,观察培养基中有无菌落生长,并做好记录。
1.2.4.2 疫苗安全性检验 取菌液浓度为3.8×109CFU/mL的灭活疫苗,以2倍免疫剂量采用颈部皮下接种方式免疫10只雏鸭,记录2周内免疫雏鸭的健康状况及存活情况,在观察期结束后随机剖解免疫鸭进行大体病变观察。
1.2.5 免疫鸭攻毒保护性试验 将140只1日龄健康雏鸭饲养至7日龄以适应环境,将其随机分成4组,35只/组。分别设为蜂胶灭活疫苗组、二价灭活疫苗组、PBS对照组和空白对照组,试验动物分组与免疫见表1。对饲养至7日龄的健康雏鸭进行初免,2周后(即21日龄)对雏鸭进行二次免疫。各组接种量均为0.3 mL/只。将RA贵州流行株(RA-SS-8株)采用腿部肌内注射方法接种二免后14 d(35日龄)的试验鸭,进行攻毒保护试验(2×108CFU/(0.5 mL·只)),10只/组,隔离饲养,连续观察7 d,记录各组试验鸭攻毒后的发病和死亡情况。取各组攻毒7 d后的试验鸭心脏和肝脏组织,按常规方法制作组织切片进行组织病理学分析,对比各组免疫保护效果与其病理变化关系。

表1 试验动物分组与免疫
2 结 果
2.1 RA贵州流行株生长曲线
2.1.1 RA贵州流行株生长曲线 通过分光光度法测定RA-SS-8株菌液随培养时间变化的D600 nm值,由图1可知,0~3 h时,细菌增殖缓慢,表明细菌生长处于迟缓期;3~10 h时,细菌增殖趋势明显增大,提示此时段细菌处于对数生长期;10 h以后,细菌增殖逐渐趋于平缓,表明细菌在向平稳期发展,随着培养时间的延长,细菌最终进入衰亡期。通过分析细菌D600 nm值与培养时间的相关性可知,D600 nm值与时间的回归方程在3~6 h时为y=0.085 6x-0.024 7(R2=0.994);3.5~6 h时为y=0.089 6x+0.043 4(R2=0.997);3.5~5.5 h时为y=0.093 5x+0.034 3(R2=0.9995)。其中以3.5~5.5 h时D600 nm值与时间的回归方程的斜率最大,D600 nm值增长趋势最明显,相关系数R2最大,准确度最高(图2)。

图1 分光光度法测定RA生长曲线Fig.1 RA growth curve determined by spectrophotometry
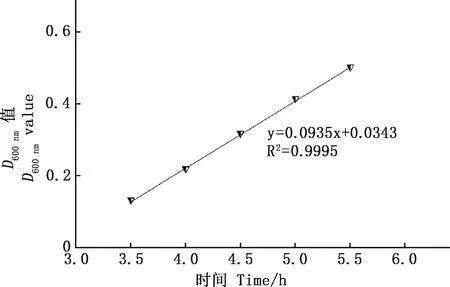
图2 RA在3.5~5.5 h内D600 nm值与培养时间的线性关系Fig.2 The linear relationship between the D600 nm value of RA and the culture time in 3.5-5.5 h
2.1.2 RA贵州流行株D600 nm值与活菌数的相关性分析 通过平板计数法测定上述D600 nm值所对应的RA活菌数,建立RA在无菌PBS溶液中的D600 nm值与其活菌数的相关性曲线。结果显示,RA菌液D600 nm值在0.1~0.8之间,D600 nm值与活菌数呈现出良好的线性关系,其回归方程为y=490.26x-12.319(R2=0.997)(图3)。在此区间,RA处于对数生长期,且D600 nm值与活菌数呈现良好的线性关系,是用作灭活疫苗制备的最佳时期。
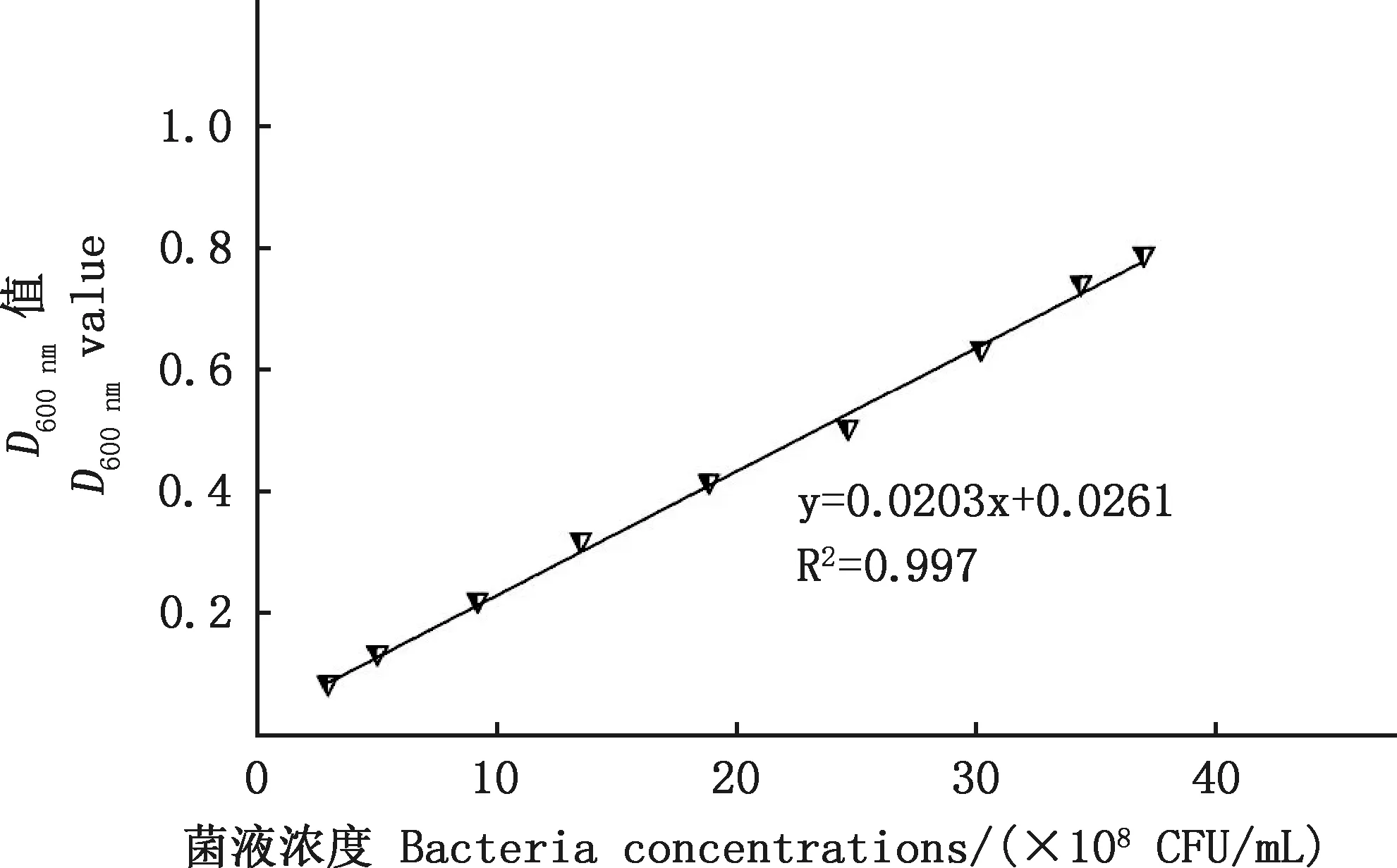
图3 D600 nm值与RA活菌数相关性曲线Fig.3 Correlation curve between D600 nm value and number of RA viable bacteria
2.2 RA菌液制备
在实验室条件下分别制备 3 批疫苗用菌液,纯粹检验均合格,活菌计数结果显示 3 批鸭疫里默氏杆菌贵州流行株(RA-SS-8株)菌液浓度分别为1.25×1010、1.27×1010和1.29×1010CFU/mL。
2.3 RA贵州流行株蜂胶灭活疫苗的制备
2.3.1 RA贵州流行株灭活条件筛选 由表2可知,未加甲醛处理组在各检测时间段都有大量细菌生长;使用甲醛的各处理组在6 h后均未在巧克力琼脂培养基上培养出细菌,表明RA灭活完全。为确保RA灭活完全,最终使用灭活条件为:甲醛终浓度0.2%,37 ℃、160 r/min灭活12 h。

表2 疫苗灭活条件筛选结果
2.4 RA贵州流行株蜂胶灭活疫苗的检验
将制备的灭活疫苗接种至巧克力琼脂培养基上,于37 ℃、5% CO2的恒温箱内培养24 h,观察到所接种培养基上均无菌落生长,表明疫苗无菌检验合格。疫苗安全性检验中使用制备好的RA灭活疫苗通过2倍免疫剂量接种雏鸭,在随后的2周观察期中,接种鸭均未表现出不良反应,其摄食和运动功能无异常,且精神状态良好;大体病变观察未见明显病变,表明所制备的疫苗安全性检验合格。
2.5 免疫鸭攻毒保护性试验
2.5.1 攻毒保护率分析 免疫鸭攻毒保护试验结果显示,PBS对照组鸭从攻毒后第1天最先出现死亡,在攻毒后第3天全部死亡;蜂胶灭活疫苗组鸭从攻毒后第2天开始出现死亡,攻毒后第2~3天为死亡高峰期,耐受至攻毒后第4天后各试验鸭均未再出现死亡;二价灭活疫苗组鸭未出现死亡。蜂胶灭活疫苗组和二价灭活疫苗组对RA-SS-8株的攻击都具有良好的免疫保护作用,其中蜂胶灭活疫苗组保护率为70%,二价灭活疫苗组保护效果最佳,保护率可达100%(表3)。

表3 免疫鸭攻毒保护试验结果
2.5.2 组织病理学分析结果 对攻毒后第7天各组试验鸭病变较为严重的心脏和肝脏进行组织切片制作。心脏组织病理学观察显示,在免疫组中,纤维素性渗出物明显减少,其中蜂胶灭活疫苗组与二价灭活疫苗组相比,前者除有极少量纤维素性渗出外,其余形态结构与后者相似,未见明显病理变化(图4A、4B);PBS对照组试验鸭心外膜增厚,表面附有大量的纤维素性渗出物,有大量异嗜性粒细胞、单核细胞和淋巴细胞弥漫性浸润(图4C);空白对照组未见明显病理变化(图4D)。肝脏组织病理学观察表明,在免疫组中,纤维素性渗出物明显减少,其中蜂胶灭活疫苗组与二价灭活疫苗组相比,前者除有极少量纤维素性渗出外,其余形态结构与后者相似,未见明显病理变化(图4E、4F);PBS对照组试验鸭肝脏被膜增厚,表面附有大量粉红色网状纤维素渗出,其间混有大量的淋巴细胞和异嗜性粒细胞浸润,肝索结构紊乱,肝细胞肿胀变性(图4G);空白对照组未见明显病理变化(图4H)。结果表明,蜂胶灭活疫苗和二价灭活疫苗对试验鸭心脏和肝脏组织均具有良好的保护效果。

A~D,分别为蜂胶灭活疫苗组、二价灭活疫苗组、PBS对照组和空白对照组心脏;E~H,分别为蜂胶灭活疫苗组、二价灭活疫苗组、PBS对照组和空白对照组肝脏A-D,Heart of propolis inactivated vaccine,bivalent inactivated vaccine,PBS control and blank control groups,respectively;E-H,Liver of propolis inactivated vaccine,bivalent inactivated vaccine,PBS control and blank control groups,respectively图4 试验鸭心脏、肝脏组织病理变化(HE,200×)Fig.4 Histopathological changes in heart and liver of the test ducks (HE,200×)
3 讨 论
目前,世界上已报道的RA血清型有20多种,而国内证实已存在的RA血清型共有18种,其中血清1型、2型、3型、4型在全国范围内均有分布,其他血清型主要分布在西南和东北地区。近年来,贵州省除三穗县外其他地区对RA血清型鲜有报道,傅心亮等[17]对贵州地区RA分离株进行血清型鉴定,结果发现以血清2型RA为主要流行菌株。吴征卓等[7]对贵州省三穗县RA进行分离鉴定,结果证实6株RA分离株中4株为血清2型,2株为血清11型。雷云等[18-19]对分离自贵州省三穗地区某鸭场25日龄左右病死鸭的18株RA进行血清型鉴定,结果证实其中有11株鉴定为血清2型,4株鉴定为血清1型,1株血清6型和2株未定型。以上文献资料证实血清2型RA为贵州地区主要流行菌株,鉴于此,本试验选取血清2型RA分离株为试验菌株,以蜂胶为佐剂成功研制灭活疫苗,为有效防控该病奠定基础,同时对促进贵州省三穗麻鸭的健康养殖具有重要意义。
常用于研制RA灭活疫苗的免疫佐剂主要有油乳佐剂、铝盐佐剂和蜂胶佐剂。油乳佐剂能诱导机体产生有效的体液免疫和细胞免疫,但对机体的毒副作用较强;铝盐佐剂作为人类疫苗唯一使用的免疫佐剂,其毒副作用小,但佐剂活性较油乳佐剂低。蜂胶佐剂能增强机体的免疫功能且具有药用价值。2008年,李淑娜[20]研制的RA、大肠杆菌二联多价蜂胶疫苗安全性好、无副作用,二免后7 d进行RA攻毒保护试验,其保护率可达90%。本试验选用蜂胶作为RA贵州流行血清2型菌株佐剂研制蜂胶灭活疫苗,同时,将制备的RA蜂胶灭活疫苗以2倍免疫剂量采用颈部皮下接种方式免疫雏鸭并观察2周,结果显示,接种鸭均未表现出不良反应,同时,本试验将制备的蜂胶灭活疫苗和商品化的二价油乳剂灭活疫苗分别免疫雏鸭,商品化疫苗组在注射部位发生局部炎症反应,而蜂胶组无明显异常现象,表明蜂胶灭活疫苗安全性更好,这与刘帅[16]研究结果相符。
本试验还通过攻毒保护试验评价蜂胶灭活疫苗组对RA人工感染的保护力,结果显示,其免疫保护率为70%,较商品化疫苗组(100%)偏低,这与郭宇飞[15]和刘帅[16]的研究结果不符,原因可能是蜂胶灭活疫苗中抗原含量较商品化疫苗低从而诱导的免疫应答较差;其次是蜂胶灭活疫苗制备过程中乳化不完全,导致蜂胶颗粒与抗原粒子未能较好的相互交联形成类免疫刺激复合物结构,从而影响免疫效果。但组织病理变化分析结果显示,蜂胶灭活疫苗组和商品化疫苗组免疫鸭心脏、肝脏组织均未出现明显病变,表明蜂胶灭活疫苗能为免疫鸭提供较为有效的保护力。
4 结 论
本试验选取RA血清2型贵州流行株(RA-SS-8株)为基础菌株,以蜂胶为佐剂制备灭活疫苗,成功制备了RA贵州流行株蜂胶灭活疫苗,可为蜂胶灭活疫苗制备和动物免疫试验奠定基础。
