牛病毒性腹泻病毒E0蛋白的原核表达及多克隆抗体制备
2022-08-23韩慧慧丁乃峥何成强
王 炜,韩慧慧,丁乃峥,何成强
(山东师范大学生命科学学院,山东省动物抗性重点实验室,济南 250014)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)作为牛病毒性腹泻(bovine viral diarrhea,BVD)的病原体,可引起牛腹泻、胃肠道炎症、呼吸系统疾病、生殖障碍等一系列临床症状[1],对畜牧养殖业造成严重的经济损失[2]。在中国,BVD作为一种瘟疫性传染病,被列为三类动物疫病中的牛病之一[3]。BVDV可以感染野生及家养动物[4],尤其是被感染的妊娠母牛产下的持续性感染(persistent infection,PI)小牛,能不断从鼻眼部分泌物及排泄物中排出具有传染性的BVDV,这种持续性病毒来源,成为驱动BVDV流行的关键因素,使得BVDV的清除具有较高难度[5-6]。
BVDV属于黄病毒科中的瘟病毒属[7],长度约12.3 kb,是正义RNA病毒,主要分BVDV-1和BVDV-2[8-9]。BVDV具有较高的流行率,牛群中抗体阳性率较高[10-11]。BVDV感染后,糖蛋白E2作为BVDV感染后免疫反应的主要目标之一,被广泛应用于BVDV疫苗的研制[12-13]。但E2蛋白的突变率高,往往导致免疫的失败[14-15]。BVDV的包膜蛋白E0(Erns)由约228个氨基酸组成,大小约26 ku,具有RNA酶活性,可降解BVDV RNA[16],是瘟病毒编码蛋白中保守性相对较高、参与病毒摄取细胞及感染性病毒粒子有效组装的重要结构蛋白[17],较E2抗原多样性少,也是宿主抗体应答的主要靶标之一[18-19]。E0作为BVDV免疫原性蛋白具有很高的抗原保守性[20],对于阻断宿主对病毒感染的反应较为重要[21],通过阻断干扰素(IFN)的合成来颉颃宿主的先天免疫防御,从而建立长期感染[22]。针对BVDV E0的抗体能有效结合细胞及其培养物中的BVDV。目前,E0蛋白因其独特的免疫学特点逐渐成为抗原蛋白免疫法制备相应抗体的候选抗原。
本研究通过PCR扩增E0基因,构建pET28a-E0原核表达载体,通过大肠杆菌表达系统诱导表达E0蛋白,采用亲和层析纯化E0蛋白,将其免疫小鼠收集血清制备BVDV E0多克隆抗体。然后通过Western blotting、细胞免疫荧光试验、ELISA等试验检测多克隆抗体的特异性,为BVDV E0蛋白的结构和功能研究及BVDV的检测提供了理论依据。
1 材料与方法
1.1 材料
BVDV Singer_Arg株(GenBank登录号:DQ088995.2)、大肠杆菌DH5α感受态细胞、大肠杆菌BL21(DE3)感受态细胞、乳仓鼠肾细胞系BHK-21、牛肾细胞系MDBK、BVDV感染性RNA表达载体pMC18-BVDV和pET-28a(+)均由山东师范大学生命科学学院动物生殖发育与疾病实验室保存;6~8周龄ICR小鼠购自济南朋悦实验动物繁育有限公司。
1.2 主要试剂
DMEM、PBS、FBS(VivaCell)均购自上海逍鹏生物科技有限公司;限制性内切酶、T4 DNA Ligase(2011A)均购自宝日医生物技术(北京)有限公司;ApexHF HS DNA Polymerase FS MasterMix(AD12202)购自湖南艾科瑞生物工程有限公司;PAGE凝胶快速制备试剂盒12.5%(PG113)购自上海雅酶生物医药科技有限公司;His标签鼠单克隆抗体(AB0002)、beta-Actin Antibody(AB0035)、辣根过氧化物酶(HRP)标记的羊抗鼠IgG(AB0102)、HRP标记的羊抗兔IgG(AB0101)和Alexa荧光488标记的羊抗鼠IgG(AB0142)均购自泊湾生物科技有限公司;弗氏佐剂(F5881/F5506)购自上海懋康生物科技有限公司;Ni NTA beads(SA004100)购自常州天地人和生物科技有限公司;全自动倒置荧光显微成像系统(型号DMi8)购自徕卡仪器有限公司;酶标仪(型号Spectra Max M5)购自Molecular Devices 美谷分子仪器(上海)有限公司。
1.3 方法
1.3.1 引物设计与合成 根据BVDV Singer_Arg株(GenBank登录号:DQ088995.2)的E0基因序列,利用DNAMAN软件设计E0基因的上、下游引物:BVDV-E0-F:5′-CGGAATTCATAACACAGTGGAACCTACAAGAC-3′(下划线处为EcoRⅠ识别位点);BVDV-E0-R:5′-AATCTCGAGCTAGGGGGAAGCCGCGTAT-3′(下划线处为XhoⅠ识别位点),预期扩增片段大小为684 bp。引物由青岛擎科梓熙生物技术有限公司合成。
1.3.2 原核表达载体pET28a-E0的构建 以实验室保存的pMC18-BVDV质粒为模板,PCR扩增E0基因片段。PCR反应体系25 μL:ApexHF HS DNA Polymerase FS MasterMix 12.5 μL,上、下游引物各1 μL,模板1 μL,灭菌ddH2O 9.5 μL。PCR反应程序:98 ℃预变性5 min;98 ℃变性30 s,65 ℃退火 30 s,72 ℃延伸45 s,共30个循环;72 ℃延伸8 min;4 ℃保存。PCR产物进行1.0%琼脂糖凝胶电泳检测,回收目的产物并纯化,将E0片段和pET-28a(+)载体经EcoRⅠ和XhoⅠ 37 ℃水浴酶切2.5 h,然后使用T4 DNA Ligase 16 ℃连接过夜,将连接产物转化大肠杆菌DH5α感受态细胞,经菌落PCR筛选阳性克隆,提取重组质粒经EcoRⅠ和XhoⅠ双酶切鉴定后,由青岛擎科梓熙生物技术有限公司测序。
1.3.3 原核表达载体pET28a-E0的诱导表达 将测序成功的pET28a-E0和pET-28a(+)转化大肠杆菌BL21(DE3)感受态细胞,培养菌液D600 nm为0.6~0.8时,添加1 mmol/L的IPTG在37 ℃条件下诱导4 h,收集菌体进行12.5%的SDS-PAGE,经考马斯亮蓝染色,脱色液脱色后观察E0蛋白的表达情况。因重组质粒带有His标签,以His标签鼠单克隆抗体为一抗,Western blotting检测诱导蛋白。
1.3.4 可溶性分析 取诱导表达E0蛋白的pET28a-E0菌体,8 000 r/min离心10 min收集菌体沉淀,加入PBS重悬菌体沉淀,冰水浴条件下超声破碎菌体:30 min,功率400 W,开4 s,关6 s,8 000 r/min离心2 min取上清和沉淀,通过12.5%的SDS-PAGE分析E0蛋白的可溶性。
1.3.5 E0蛋白的纯化及鉴定 依据步骤1.3.3和1.3.4大量诱导pET28a-E0重组菌体,超声破碎后离心收集沉淀,采用Ni NTA beads亲和层析纯化蛋白,经上柱结合、洗涤缓冲液洗涤杂蛋白、洗脱缓冲液洗脱目的蛋白等步骤纯化E0蛋白,将纯化后的E0蛋白处理后通过12.5%的SDS-PAGE分析蛋白纯化情况。以His标签鼠单克隆抗体(1∶2 000)为一抗,1∶5 000稀释的HRP标记的羊抗鼠IgG为二抗,Western blotting检测蛋白纯化结果。
1.3.6 免疫小鼠 将纯化的E0蛋白使用BCA蛋白浓度测定试剂盒测定浓度后与弗氏佐剂等体积混合超声乳化成油乳状,背部皮下多点注射免疫4只6~8周龄ICR小鼠(50~100 μg/只)。免疫前鼠尾采血收集血清备用,每次免疫间隔2周进行。第1次使用弗氏完全佐剂,第2、3次免疫使用弗氏不完全佐剂,3次免疫后均采血收集血清备用。
1.3.7 BVDV E0多克隆抗体特异性检测 将纯化的E0蛋白与蛋白上样缓冲液按4∶1的比例混合后沸水煮8 min,将其作为抗原通过Western blotting检测BVDV E0多克隆抗体与E0蛋白的特异性结合。蛋白样先经12.5%的SDS-PAGE分离,然后转移至PVDF膜,将PVDF膜用封闭液封闭2 h,将4只小鼠的BVDV-E0多克隆抗体和免疫前血清以1∶1 000比例稀释分别作为一抗,4 ℃孵育过夜,TBST清洗后以1∶5 000稀释的HRP标记的羊抗鼠IgG为二抗,室温孵育2 h,TBST清洗后显色并拍照。将pET28a-E0质粒转化大肠杆菌BL21感受态细胞,收集菌体细胞裂解提取蛋白,如上述处理后作为抗原,将BVDV-E0多克隆抗体和免疫前血清1∶1 000稀释作为一抗,通过Western blotting检测BVDV E0多克隆抗体的特异性。
1.3.8 BVDV检测 将BHK-21细胞铺于6孔细胞培养板,待细胞长至75%时,将BVDV感染性RNA表达载体pMC18-BVDV转染至BHK-21细胞,48 h后收集包装的病毒上清并感染MDBK细胞,培养48 h后,收集细胞裂解提取蛋白,以制备的BVDV E0多克隆抗体(1∶1 000)为一抗,1∶5 000稀释的HRP标记的羊抗鼠为二抗,Western blotting检测BVDV感染性RNA表达载体pMC18-BVDV在BHK-21细胞内的表达和包装病毒在MDBK细胞内的复制,其中试验组和BHK-21/MDBK空白细胞阴性对照组分别做2个重复。通过细胞免疫荧光检测多克隆抗体的应用效果,将MDBK细胞爬片并培养至贴壁状态、将BVDV病毒液接种细胞,感染培养24 h,PBS清洗3次后用4%的多聚甲醛固定8 min,PBS清洗3次,透膜液37 ℃透膜30 min,PBS清洗3次后用5%的BSA室温封闭1 h,然后将BVDV E0多克隆抗体稀释400倍作为一抗,37 ℃孵育1 h,PBS再次清洗后以1∶200稀释的 Alexa荧光488标记的羊抗鼠IgG为二抗,37 ℃孵育1 h,PBS清洗3次,DAPI染核液染核5 min,最后PBS清洗3次后封片,然后镜检并拍照。通过双抗夹心法ELISA检测BVDV,将免疫前小鼠血清和BVDV E0多克隆抗体倍比稀释后4 ℃过夜包被酶标板,PBST清洗3次后用10%的马血清37 ℃封闭2 h,PBST清洗3次,然后滴加病毒感染复数(MOI)为0.1~0.5的BVDV病毒液,37 ℃孵育2 h,再次PBST清洗3次后加入HRP标记的羊抗鼠IgG(1∶5 000),37 ℃孵育2 h,PBST清洗3次后每孔加入100 μL的TMB显色液,室温避光显色10 min,最后每孔加入100 μL终止液终止反应,用酶标仪测定D450 nm值并分析结果,以阳性血清D450 nm值/阴性血清D450 nm值(P/N值)>2的抗体稀释度定义为抗血清效价。
1.3.9 BVDV E0多克隆抗体效价测定 通过ELISA法检测4只小鼠的抗血清效价,将纯化的E0蛋白稀释至4 μg/mL后包被酶标板,用10%的马血清37 ℃封闭2 h,TBST清洗3次后以4只小鼠免疫前血清(阴性对照)和BVDV E0多克隆抗体分别倍比稀释为一抗,37 ℃孵育2 h,PBST清洗3次后,以1∶5 000稀释的HRP标记的羊抗鼠IgG为二抗,37 ℃孵育2 h,PBST清洗3次后每孔加入100 μL的TMB显色液,室温避光显色10 min,终止反应后用酶标仪测定D450 nm值并进行结果分析。
2 结 果
2.1 pET28a-E0载体的构建
使用EcoR Ⅰ和XhoⅠ对pET28a-E0重组质粒进行双酶切鉴定(图1),在5 369和684 bp处出现与预期相符的载体条带和目的条带,经测序比对分析,原核表达载体pET28a-E0构建成功。
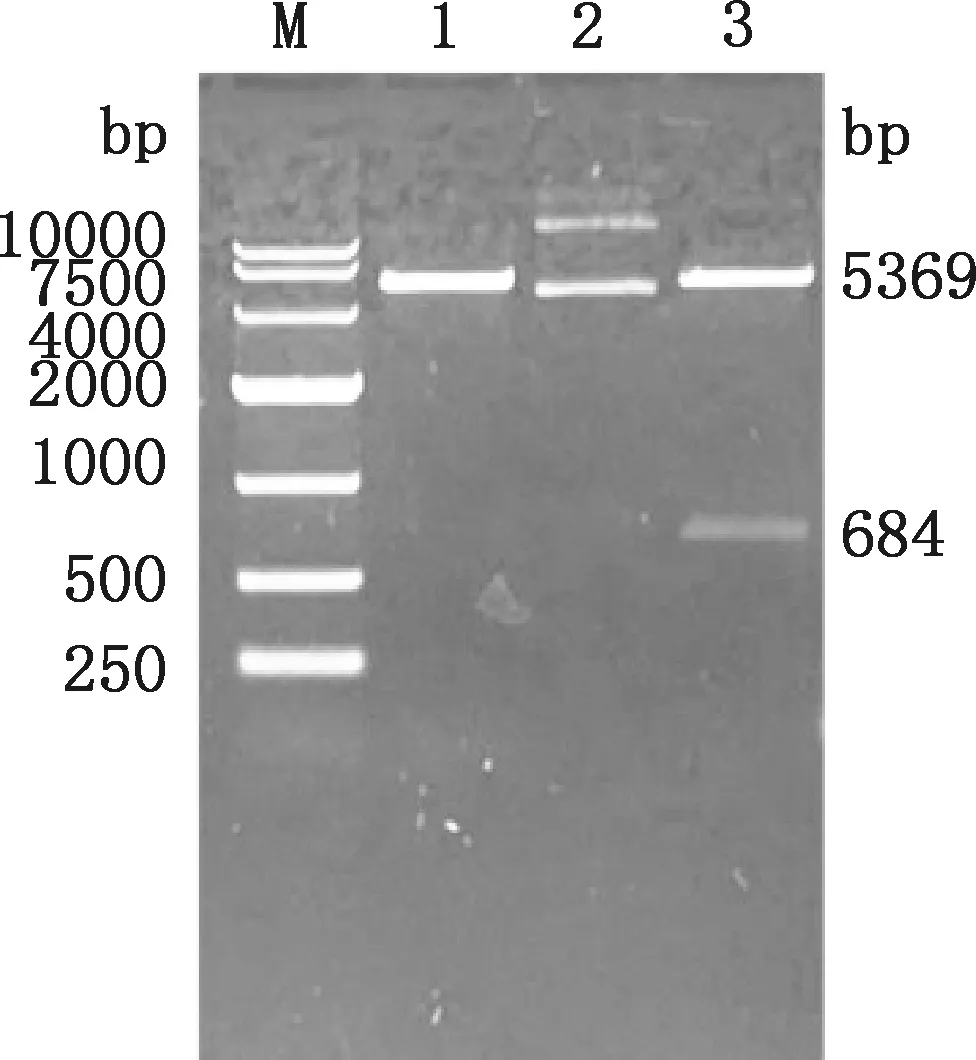
M,DL10000 DNA Marker;1,空载质粒双酶切;2,pET28a-E0重组质粒;3,pET28a-E0重组质粒双酶切M,DL10000 DNA Marker;1,Double digestion of empty vector plasmid;2,Recombinant plasmid pET28a-E0;3,Double digestion of recombinant plasmid pET28a-E0图1 重组质粒的双酶切鉴定Fig.1 Double digestion identification of recombinant plasmid
2.2 E0蛋白的表达、可溶性分析、纯化及鉴定
通过12.5%的SDS-PAGE观察发现,经1 mmol/L的IPTG在37 ℃条件下诱导的pET28a-E0重组质粒在26 ku处出现BVDV E0目的条带,而pET-28a(+)空载质粒和未诱导的重组质粒处未出现(图2A)。可溶性分析发现,E0蛋白主要存在于沉淀中,即其在大肠杆菌中主要以包涵体形式存在(图2A)。取诱导表达E0蛋白的pET28a-E0菌体,超声破碎离心后通过Ni NTA breads亲和层析纯化目的蛋白,经12.5%的SDS-PAGE分析发现纯化出杂蛋白较少、浓度较高的E0蛋白(图2A)。以His标签鼠单克隆抗体为一抗,HRP标记的羊抗鼠IgG为二抗,经Western blotting检测,诱导蛋白(图2B)和纯化蛋白(图2C)在26 ku处均出现目的条带,表明BVDV E0蛋白已成功诱导纯化,且纯化蛋白特异性良好,可用于后期免疫试验。
2.3 BVDV E0多克隆抗体特异性检测
如图3所示,E0纯化蛋白免疫前采集的4只小鼠血清(免疫前血清)均未能检测出目的条带(图3A),而E0纯化蛋白免疫后采集的小鼠血清(BVDV E0多克隆抗体)则能特异性检测出纯化后的E0蛋白(图3B);免疫前血清在pET-28a(+)和pET28a-E0均未检测出目的条带(图3C)。BVDV E0多克隆抗体在pET28a-E0检测出目的条带(图3D),而在pET-28a(+)未检测出。证明BVDV E0多克隆抗体具有良好的免疫特异性,可特异性识别BVDV E0蛋白。
2.4 BVDV检测
Western blotting检测BVDV感染性RNA表达载体pMC18-BVDV在BHK-21细胞内的表达和包装病毒在MDBK细胞内的复制,结果显示均在26 ku处出现目的条带(图4A和4B),即为BVDV E0蛋白大小,证明该多克隆抗体可特异性识别细胞表达的E0蛋白。通过细胞免疫荧光检测BVDV,结果如图4C所示,E0多克隆抗体组出现荧光,而免疫前血清对照组未出现荧光,表明本试验制备的多克隆抗体可用于BVDV的免疫荧光检测。通过双抗夹心法ELISA检测BVDV,结果如图4D所示,在1∶500至1∶32 000抗血清稀释比范围内,BVDV检测均为阳性,且随着稀释比的升高,P/N值呈上升趋势。以上结果表明,本试验制备的BVDV E0多克隆抗体可特异性识别BVDV E0蛋白,用于BVDV的检测。

①A,SDS-PAGE检测诱导和纯化蛋白;B、C,Western blotting检测诱导和纯化蛋白。②M,蛋白质分子质量标准;1,pET-28a(+)未经IPTG诱导;2,pET-28a(+)经IPTG诱导4 h;3,pET28a-E0未经IPTG诱导;4,pET28a-E0经IPTG诱导4 h;5,上清;6,沉淀;7,流出液;8,洗脱液;9,E0纯化蛋白;10,E0诱导蛋白;11,E0纯化蛋白①A,Detection of induced and purified proteins by SDS-PAGE;B and C,Detection of induced and purified proteins by Western blotting.②M,Protein Marker;1,pET-28a(+) was not induced by IPTG;2,pET-28a(+) was induced by IPTG for 4 h;3,pET28a-E0 was not induced by IPTG;4,pET28a-E0 was induced by IPTG for 4 h;5,Supernatant;6,Precipitation;7,Effluent;8,Eluent;9,E0 purified protein;10,E0 induced protein;11,E0 purified protein图2 E0蛋白的表达、可溶性分析、纯化及鉴定Fig.2 Expression,solubility analysis,purification and identification of E0 protein

①A、B,分别为免疫前血清和BVDV E0多克隆抗体作为一抗Western blotting检测E0纯化蛋白;C、D,分别为免疫前血清和BVDV E0多克隆抗体作为一抗Western blotting检测大肠杆菌BL21表达的总蛋白。②M,蛋白质分子质量标准;1~4,耳标号A851、A852、A853、A795小鼠免疫前血清;5~8,耳标号A851、A852、A853、A795小鼠免疫后血清。9、11,pET-28a(+)诱导蛋白;10、12,pET28a-E0诱导蛋白①A and B,Pre-immune serum and BVDV E0 polyclonal antibody were used as primary antibodies to detect E0 purified protein by Western blotting,respectively;C and D,Pre-immune serum and BVDV E0 polyclonal antibody were used as primary antibodies to detect the total protein expressed by E.coli BL21 by Western blotting,respectively.②M,Protein Marker;1-4,Pre-immune serum of mice with ear number A851,A852,A853,A795;5-8,Post-immune serum of mice with ear number A851,A852,A853,A795;9 and 11,pET-28a(+) induced protein;10 and 12,pET28a-E0 induced protein图3 BVDV E0多克隆抗体特异性检测Fig.3 Specific detection of BVDV E0 polyclonal antibody

①A、B,Western blotting检测BVDV E0分别在BHK-21和MDBK细胞中的表达;C,细胞免疫荧光检测被BVDV感染的MDBK细胞(100×);D,双抗夹心法ELISA检测BVDV。②M,蛋白质分子质量标准;1~3,转染pMC18-BVDV质粒的BHK-21细胞;4,空白BHK-21细胞,5~7,包装病毒感染的MDBK细胞;8,空白MDBK细胞①A and B,The expression of BVDV E0 in BHK-21 and MDBK cells by Western blotting;C,Cellular immunofluorescence detection of MDBK cells infected with BVDV (100×);D,Detection of BVDV by double antibody sandwich ELISA.②M,Protein Marker;1-3,BHK-21 cells transfected with pMC18-BVDV plasmid;4,Blank BHK-21 cells; 5-7,MDBK cells infected with packaging virus;8,Blank MDBK cells图4 BVDV E0多克隆抗体检测BVDVFig.4 Detection of BVDV by BVDV E0 polyclonal antibody
2.5 BVDV E0多克隆抗体效价测定
利用ELISA法检测制备的BVDV E0多克隆抗体的效价,如图5所示,A851小鼠免疫后血清(BVDV E0多克隆抗体)以1∶64 000比例稀释时P/N值仍在2倍以上,并且检测发现4只免疫小鼠抗血清效价均高于1∶32 000。结果证明,本试验制备的BVDV E0多克隆抗体效价较高。

图5 BVDV E0多克隆抗体效价测定Fig.5 Titer determination of BVDV E0 polyclonal antibody
3 讨 论
BVDV在世界范围内被称为感染反刍动物的非典型瘟病[23],可引起牛慢性持续性感染和急性致死性疾病,死亡率较高[24],对畜牧养殖业造成巨大的经济损失。因此快速准确的诊断方法是防控BVDV的关键。BVDV抗原ELISA和实时荧光定量PCR是检测感染动物的两种最可靠、最灵敏的方法,实时荧光定量PCR在转录水平检测目的基因,涉及RNA合成过程,操作较复杂;ELISA作为蛋白的定量检测,灵敏度高,操作方式灵活,是检测BVDV最具成本效益的方法[25]。在准确检测BVDV的基础上,研发易于制备且高效价的检测抗体尤为重要。BVDV疫苗和检测抗体研究的主要靶点为E0和E2蛋白,BVDV的包膜蛋白E0作为宿主抗体应答的主要靶标之一,已逐渐成为抗原蛋白免疫法制备ELISA检测等抗体的候选抗原蛋白[18-19]。BVDV E0蛋白是病毒颗粒的重要组成部分,表现出RNase活性,是BVDV毒力因子形成的关键[26]。E0蛋白通过长的两性螺旋附着在膜上,属于膜锚定的,但没有跨膜肽[17],因此在BVDV各结构蛋白中,E0蛋白具有较高的保守性[20]。E0蛋白大小约为26 ku,突变率低,结构稳定,较易表达和纯化,是ELISA检测中理想的包被抗原蛋白。
目前原核表达系统广泛应用于各类病原微生物蛋白的表达[27-28],操作简单且高效,多克隆抗体制备简单、成本低、应用广泛,已有BVDV E2等蛋白多克隆抗体的制备。但对于BVDV E0蛋白相关抗体的制备报道较少,因此,本研究选用BVDV E0蛋白,将其在原核表达系统中表达纯化,免疫小鼠制备BVDV E0多克隆抗体。以纯化的E0蛋白作为包被抗原,该多克隆抗体可用于BVDV的ELISA检测,同时也可应用于组织及细胞培养中BVDV感染的检测。BVDV E0多克隆抗体虽然没有单克隆抗体的特异性好,但能与多株BVDV发生结合反应,在一定程度上克服了BVDV不同毒株之间抗原多样性问题,检测范围更广。
本研究首先利用PCR技术扩增出BVDVE0基因片段,将其克隆至pET-28a(+)载体,成功构建pET28a-E0原核表达载体,然后将pET28a-E0转化至大肠杆菌表达菌株BL21(DE3),并成功诱导表达E0蛋白,大小约26 ku,与制备兔抗BVDV E0多克隆抗体研究中[29]表达出大小约30 ku的BVDV E0蛋白的结果基本符合。经可溶性分析发现,BVDV E0蛋白主要以包涵体的形式存在。采用Ni NTA beads亲和层析纯化E0蛋白,并将纯化的E0蛋白与弗氏佐剂混合乳化后免疫小鼠,结果表明,制备的BVDV E0多克隆抗体具有良好的免疫特异性,可用于Western blotting、免疫荧光试验、ELISA等试验检测BVDV,为后期研制BVDV ELISA检测试剂盒提供了抗体。并且在双抗夹心法ELISA检测BVDV时发现,BVDV MOI在0.2~0.4范围内检测效果较好,推测MOI=0.1时病毒粒子较少,而MOI=0.5时病毒粒子已经过饱和。值得注意的是,现如今中国的BVDV防控状况仍十分艰巨,需要高效的疫苗免疫和有效的检测抗体。本研究制备的BVDV E0多克隆抗体为BVDV的检测奠定了基础,但该多克隆抗体还未进行临床应用,具体使用情况还需进一步研究。
4 结 论
本研究利用原核表达系统在37 ℃,1 mmol/L IPTG条件下成功诱导表达BVDV E0蛋白,纯化蛋白免疫小鼠制备出BVDV E0多克隆抗体,该多克隆抗体能特异性识别BVDV及其在细胞内表达的E0蛋白,免疫特异性良好且效价较高,为研究BVDV E0蛋白的结构和功能及BVDV的检测提供了抗体。
