Circ_HECTD1调节miR-135a-5p/TP53INP1轴对OGD/R诱导的海马神经元损伤的影响
2022-08-09张文敏
逯 琴, 张文敏, 赵 敏
脑卒中是一种严重的心脑血管疾病,主要包括缺血性脑卒中和出血性脑卒中,其中缺血性脑卒中主要表现为脑血管破裂或阻塞导致血流量减少,引起神经功能受损,最终导致脑部病变,发病率、致死致残率均极高[1,2]。缺血性脑卒中的发生机制复杂,多种因素导致神经元损伤与凋亡,如代谢异常、氧化应激及钙离子超载等[3],目前临床上对于脑卒中仍缺少有效的治疗药物。环状RNA(circular RNA,circRNA)是一种单链环状、共价闭合的非编码RNA,可通过调控多种信号通路参与多种疾病的发生发展[4~6]。环状RNA含HECT结构域的E3泛素连接酶1(circRNA HECT domain E3 ubiquitin ligase 1,Circ_HECTD1)在缺血脑组织中表达升高,抑制Circ_HECTD1表达能够显著改善脑梗死,减轻神经元损伤[7]。研究发现,miR-135a-5p在氧葡萄糖剥夺/复氧(oxygen-glucose deprivation/reoxygenation,OGD/R)诱导的PC12细胞中表达减少,过表达miR-135a-5p能够显著改善OGD/R诱导产生的氧化应激反应,抑制炎症反应,减少细胞凋亡[8]。肿瘤蛋白53诱导型核蛋白1(tumor protein 53-induced nuclear protein 1,TP53INP1)是一种促凋亡蛋白,参与多种肿瘤引起的细胞应激反应,可诱导细胞生长停滞,引起细胞凋亡[9,10]。生物信息学网站预测可知TP53INP1是miR-135a-5p的靶基因。本研究通过进行体外OGD/R诱导海马神经元损伤,观察Circ_HECTD1对HT22细胞增殖、凋亡的影响以及对miR-135a-5p/TP53INP1轴的调控机制。
1 材料和方法
1.1 细胞与主要试剂 HT22小鼠海马神经元细胞由中科院细胞生物研究所提供。胎牛血清(FBS,10099-141)、Lipofectamine 2000转染试剂盒(BT11668-019)均购自美国赛默飞公司;青链霉素(R3470)购自北京康纳瑞生物公司;si-Circ_HECTD1、miR-135a-5p模拟物(miR-135a-5p)、anti-miR-135a-5p及其阴性转染物(si-NC、miR-NC、anti-miR-NC)、Circ_HECTD1野生型质粒(Circ_HECTD1-WT)与突变型质粒(Circ_HECTD1-MUT)、TP53INP1野生型质粒(TP53INP1-WT)与突变型质粒(TP53INP1-MUT)均购自北京六合华大基因公司;TRIzol试剂盒(SH-2366)购自北京凯诗源生物公司;荧光定量PCR检测试剂盒(BK2100)购自百奥迈科生物公司;MTT细胞增殖检测试剂盒(M1020)购自北京索莱宝生物公司;Annexin V-FITC/PI凋亡试剂盒(K201-100)购自北京博迈斯科技公司;双荧光素酶报告基因实验检测试剂盒(AAT-12518)购自美国AAT Bioquest公司;Bax抗体(ab182733)、Bcl-2抗体(ab196495)、TP53INP1抗体(ab202026)、羊抗兔二抗(ab6721)购自英国Abcam公司。
1.2 主要仪器 JD-CW16实时荧光定量PCR仪购自山东竞道光电科技有限公司;EXFLOW系列流式细胞仪购自北京达科为生物技术公司;LONZA ELx808酶标仪购自美国LONZA公司;Azure Biosystems C150凝胶成像系统购自美国Azure公司。
1.3 细胞培养与分组转染 常规培养复苏HT22细胞,并培养于含10% FBS,1%青链霉素双抗的正常DMEM培养基中,置于37 ℃、5%CO2恒温培养箱中进行传代培养,待细胞融合≥80%后采用Lipofectamine 2000转染试剂盒将si-NC、si-Circ_HECTD1、miR-NC、miR-135a-5p、si-Circ_HECTD1+anti-miR-NC、si-Circ_HECTD1+anti-miR-135a-5p分别转染至HT22细胞中,依次作为si-NC组、si-Circ_HECTD1组、miR-NC组、miR-135a-5p组、si-Circ_HECTD1+anti-miR-NC组、si-Circ_HECTD1+anti-miR-135a-5p组,另将未进行转染的细胞作为Con组、OGD/R组。
1.4 模型建立 除Con组外,其它7组建立OGD/R模型:弃去原来的培养液,PBS冲洗细胞,加入不含FBS的无糖DMEM培养基,置于常规恒温培养箱中培养2 h,转移至含有94%N2、5%CO2、1%O2的缺氧培养基中培养6 h,然后更换正常DMEM培养基,转移至常规恒温培养箱中继续培养12 h。
1.5 qRT-PCR法检测Circ_HECTD1、miR-135a-5p、TP53INP1 mRNA表达 收集各组HT22细胞,采用TRIzol试剂提取各组细胞总RNA,逆转录得到cDNA,采用荧光定量PCR检测试剂盒检测Circ_HECTD1、miR-135a-5p、TP53INP1 mRNA表达,以GAPDH和U6为内参,采用2-△△Ct法计算目的基因相对表达量。qRT-PCR所需引物:Circ_HECTD1上游引物5’-CACGTGTTATCAGGGGCCTT-3’,下游引物5’-CGCCACCCTTGCTTTTCATC-3’;miR-135a-5p上游引物5’-ACAGCCTCCATGGGAATGGAAGCAGGTTGA-3’,下游引物5’-TGGAGTGTGGCGTTCG-3’;TP53INP1上游引物5’-TGGCACTTATTTCCGCCTGTA-3’,下游引物5’-CGTGGCTGGAAGAAGTAGTGA-3’;U6上游引物5’-CGCTTCGGCAGCACATATAC-3’,下游引物5’-TTCACGAATTTGCGTGTCAT-3’;GAPDH上游引物5’-GAAGGTGAAGGTCGGAGTC-3’,下游引物5’-GAAGATGGTGATGGGATTTC-3’。
1.6 MTT检测细胞活性 收集各组HT22细胞,将细胞密度调整为1×105个/ml,接种至96孔板,每孔加入100 μl细胞悬液,待细胞铺满孔底,每孔加入5 mg/ml MTT溶液10 μl,37 ℃培养4 h,弃去培养液,每孔加入DMSO 150 μl,摇床上震荡10 min,使结晶充分溶解,使用酶标仪于570 nm波长处测定吸光度值(OD值),计算各组细胞存活率:细胞存活率(%)=实验组OD值/Con组OD值×100%。
1.7 流式细胞术检测细胞凋亡 收集各组HT22细胞,调整细胞浓度为5×105个/ml。取500 μl细胞悬液,加入5 μl Annexin V-FITC溶液和5 μl PI溶液,孵育10 min,混匀后采用流式细胞仪检测细胞凋亡率。
1.8 双荧光素酶报告基因实验验证miR-135a-5p与Circ_HECTD1、TP53INP1的靶向关系 根据miR-135a-5p与Circ_HECTD1、TP53INP1序列间的互补结合位点,构建Circ_HECTD1、TP53INP1野生型和突变型质粒载体(Circ_HECTD1-WT与Circ_HECTD1-MUT、TP53INP1-WT与TP53INP1-MUT),并将其分别与miR-NC和miR-135a-5p共转染至HT22细胞中,转染48 h后,采用双荧光素酶报告基因实验检测试剂盒检测荧光素酶活性,以萤火虫荧光素酶活性与海肾荧光素酶活性的比值作为相对荧光素酶活性。
1.9 Western blot法检测Bax、Bcl-2、TP53INP1蛋白表达 收集各组HT22细胞,加入RIPA裂解液提取总蛋白,采用BCA法检测蛋白浓度,进行SDS-PAGE电泳,转移至PVDF膜上,5%脱脂牛奶37 ℃封闭2 h,加入Bax、Bcl-2、TP53INP1一抗,4 ℃孵育过夜,再加入HRP标记的二抗,37 ℃孵育2 h,ECL显色后使用凝胶成像系统获取图像并分析条带灰度值,以β-actin为内参,计算目的蛋白的相对表达量。

2 结 果
2.1 Circ_HECTD1、miR-135a-5p、TP53INP1在OGD/R诱导的HT22细胞损伤中的表达 与Con组比较,OGD/R组Circ_HECTD1与TP53INP1 mRNA表达均上调,miR-135a-5p表达下调(P<0.05)。结果(见表1)。
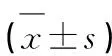
表1 各组HT22细胞中Circ_HECTD1、miR-135a-5p、TP53INP1 mRNA表达比较
2.2 沉默Circ_HECTD1表达对OGD/R诱导的HT22细胞损伤及miR-135a-5p、TP53INP1表达的影响 与Con组比较,OGD/R组HT22细胞存活率和Bcl-2蛋白表达降低,凋亡率和Bax蛋白表达升高(P<0.05);与OGD/R组、si-NC组比较,si-Circ_HECTD1组Circ_HECTD1、TP53INP1 mRNA和蛋白表达降低,miR-135a-5p表达升高,存活率和Bcl-2蛋白表达升高,凋亡率和Bax蛋白表达降低(P<0.05)。结果(见图1、图2和表2、表3)。
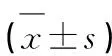
表2 各组HT22细胞Circ_HECTD1、miR-135a-5p、TP53INP1 mRNA表达存活率、凋亡率比较
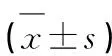
表3 各组HT22细胞中TP53INP1、Bax、Bcl-2蛋白表达比较

图1 各组HT22细胞凋亡流式图

A:Con组;B:OGD/R组;C:si-NC组;D:si-Circ_HECTD1组图2 各组HT22细胞中TP53INP1、Bax、Bcl-2蛋白表达
2.3 Circ_HECTD1与miR-135a-5p、miR-135a-5p与TP53INP1的靶向关系 生物信息学网站(https://starbase.sysu.edu.cn/index.php)预测可知,Circ_HECTD1与miR-135a-5p、miR-135a-5p与TP53INP1序列间均具有互补结合位点(见图3)。与转染miR-NC比较,转染miR-135a-5p的HT22细胞中Circ_HECTD1-WT以及TP53INP1-WT的相对荧光素酶活性降低(P<0.05);但对Circ_HECTD1-MUT和TP53INP1-MUT的相对荧光素酶活性无显著影响(P>0.05)。结果(见表4)。
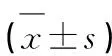
表4 双荧光素酶报告基因实验

图3 Circ_HECTD1与miR-135a-5p、miR-135a-5p与TP53INP1结合位点
2.4 过表达miR-135a-5p对OGD/R诱导的HT22细胞损伤及TP53INP1表达的影响 与Con组比较,OGD/R组TP53INP1 mRNA和蛋白表达均升高(P<0.05);与OGD/R组、miR-NC组比较,miR-135a-5p组miR-135a-5p表达升高,TP53INP1 mRNA和蛋白表达均降低,细胞存活率和Bcl-2蛋白表达升高,凋亡率和Bax蛋白表达降低(P<0.05)。结果(见图4、图5和表5、表6)。
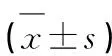
表5 各组HT22细胞miR-135a-5p、TP53INP1 mRNA表达、存活率与凋亡率比较
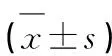
表6 各组HT22细胞中TP53INP1、Bax、Bcl-2蛋白表达比较

图4 各组HT22细胞凋亡流式图

A:Con组;B:OGD/R组;C:miR-NC组;D:miR-135a-5p组图5 各组HT22细胞中TP53INP1、Bax、Bcl-2蛋白表达
2.5 抑制miR-135a-5p逆转沉默Circ_HECTD1表达对OGD/R诱导的HT22细胞损伤的影响 与si-Circ_HECTD1+anti-miR-NC组比较,si-Circ_HECTD1+anti-miR-135a-5p组miR-135a-5p表达降低,TP53INP1 mRNA和蛋白表达升高,细胞存活率和Bcl-2蛋白表达降低,细胞凋亡率和Bax蛋白表达升高(P<0.05)。结果(见图6、图7和表7、表8)。
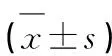
表7 各组HT22细胞miR-135a-5p、TP53INP1 mRNA表达、存活率与凋亡率比较
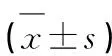
表8 各组HT22细胞TP53INP1、Bax、Bcl-2蛋白表达比较
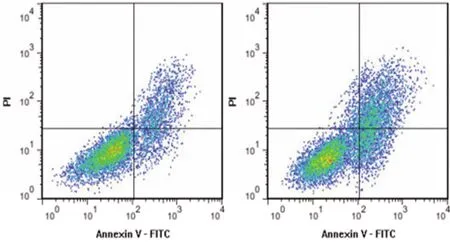
si-Circ_HECTD1+anti-miR-NC组;si-Circ_HECTD1+anti-miR-135a-5p组图6 各组HT22细胞凋亡流式图

A:si-Circ_HECTD1+anti-miR-NC组;B:si-Circ_HECTD1+anti-miR-135a-5p组图7 各组HT22细胞TP53INP1、Bax、Bcl-2蛋白表达
3 讨 论
近年来脑卒中的发病率与死亡率逐年升高,目前临床上对于脑卒中的治疗药物主要是神经保护类药物,其靶点单一,易出现耐药性,寻找新的治疗靶点是脑血管疾病的研究重点[11,12]。细胞凋亡是缺血性脑卒中神经元损伤的主要形式,缺血后脑组织中大量氧自由基的产生导致促炎因子释放,最终引起细胞损坏和凋亡[13,14]。海马区是脑缺血后最易受损的区域[15],本实验采用小鼠海马神经元HT22细胞建立OGD/R诱导细胞损伤体外模型,结果显示,OGD/R诱导后HT22细胞存活率降低,凋亡率升高,Bax表达升高,Bcl-2表达降低,提示海马神经元HT22细胞受损,细胞发生凋亡,与袁美玲等[16]研究结果一致。
研究发现[17],沉默Circ_HECTD1表达可有效降低癫痫模型小鼠海马神经元凋亡,减轻炎症反应。另有研究证实[18],Circ_HECTD1敲除后,通过调节miR-27a-3p/FSTL1轴,减轻OGD/R诱导HT22细胞损伤,为脑梗死的治疗提供新的靶点。本研究发现沉默Circ_HECTD1可通过抑制细胞凋亡减轻HT22细胞损伤,与Zhang等[18]研究结果一致,但具体作用机制尚不完全清晰。
miR-135a-5p已被证实在脑缺氧/复氧损伤中发挥关键作用[19]。研究发现,M2小胶质细胞来源的miR-135a-5p表达上调,抑制神经元自噬,减轻缺血性脑损伤[20]。TP53INP1影响OGD/R诱导的神经元细胞活力,促进神经元中炎症与氧化应激的发生,诱导细胞凋亡[21,22]。本研究结果显示,HT22细胞中TP53INP1上调,miR-135a-5p下调;双荧光素酶报告基因检测证实TP53INP1是miR-135a-5p的靶基因;且过表达miR-135a-5p可通过下调TP53INP1表达减轻HT22细胞损伤。另外,双荧光素酶报告基因检测证实,miR-135a-5p是Circ_HECTD1的靶基因;且沉默Circ_HECTD1可显著上调miR-135a-5p表达,下调TP53INP1表达,而抑制miR-135a-5p表达能够显著逆转沉默Circ_HECTD1对HT22细胞损伤的保护作用。以上研究结果提示Circ_HECTD1可通过调控miR-135a-5p/TP53INP1信号轴发挥对海马神经元损伤的保护作用。
综上所述,沉默Circ_HECTD1表达能够有效减少细胞凋亡,促进细胞增殖,保护OGD/R诱导的海马神经元损伤,且其作用机制可能与调节miR-135a-5p/TP53INP1信号轴有关。但目前缺血性脑卒中发病机制复杂,Circ_HECTD1在缺血性脑卒中的研究尚少,其具体影响机制还需进一步深入探索。
