香蕉根际及非根际土壤细菌群落特征及共性规律研究
2022-08-09黄穗萍金德才李其利韦绍龙唐利华黄素梅郭堂勋罗述名莫贱友
黄穗萍,金德才,李其利,韦绍龙,唐利华,黄素梅,郭堂勋*,罗述名,莫贱友
(1广西农业科学院植物保护研究所/广西作物病虫害生物学重点实验室,广西南宁 530007;2中国科学院生态环境研究中心环境生物技术重点实验室,北京 100085;3广西农业科学院生物技术研究所,广西南宁 530007;4广西农业科学院花卉研究所,广西南宁 530007)
0 引言
【研究意义】香蕉(spp.)隶属于芭蕉科(Musaceae)芭蕉属植物,最早发现于东南亚,目前在世界130多个国家广泛种植。香蕉是全球重要的经济作物,也是仅次于水稻、小麦、玉米的第4大粮食作物(张静等,2018)。我国是世界上最早种植香蕉的国家之一,也是世界香蕉主产国,香蕉已成为我国热带亚热带地区的重要经济作物(李玉萍和方佳,2008)。植物根际土壤微生物是植株根际微生态的重要组成部分,在植物的生长发育、营养吸收、抗病特性以及耐受逆境胁迫等方面发挥着至关重要的作用。研究健康香蕉根际微生物群落的特征,以及土壤理化特性对土壤微生物丰度和多样性的影响,可为香蕉根际土壤微生物的调控提供理论基础,对促进香蕉植株持续健康生长具有重要意义。【前人研究进展】土壤微生物多样性水平对土壤功能的开展和实施至关重要(Nannipieri et al.,2020)。研究发现,土壤微生物多样性与土壤及植株健康、生态系统的可持续性有着不可分割的关系(Abawi and Widmer,2000;樊芳芳等,2020)。稳定的土壤微生物群落有利于植物的生长,较高的微生物多样性可促进生态系统和微生物功能的稳定性(Deng et al.,2016;杨满元等,2019),提高植株对营养物质的吸收,促进植株生长,增强防治土传病害的能力(Köberl et al.,2015;Luan et al.,2015)。健康土壤中的微生物多样性与群落结构对防治土传病害非常关键,微生物多样性高的土壤能挤占病原菌的生存空间使其难以入侵(Benizri et al.,2005;张明宇等,2020)。而土壤微生物多样性水平和群落结构受多种因素影响,如土壤理化性质(Zhou et al.,2017)、农业栽培管理制度(Venter et al.,2016;徐胜涛等,2020)、根际分泌物(Kowalchuk et al.,2002)等。根际释放的物质能作用于根际微生物区系,如通过分泌特定的分泌物来招募有益微生物种群,以应对外界病原体,抵御土传病原微生物,从而有利于植物生长和繁衍后代(Yu‐an et al.,2018),常见的根系分泌物包括糖类、氨基酸、有机酸、维生素和脂肪酸等(Dakora and Phillips,2002)。香蕉通过根际分泌物影响根际微生物群落结构,同时香蕉的生长和抗病能力受土壤微生物多样性及种群类型的影响。近几年,研究发现可通过增施生物有机肥、覆盖种植等方式调控香蕉根际微生物群落结构,从而提高香蕉产量和抗病力(Patti‐son et al.,2014;Huang et al.,2019;Shen et al.,2019)。此外,Zhou等(2019)通过对香蕉枯萎病患病和不患病土壤的细菌16S rRNA基因序列和真菌内转录间隔区(Internal transcribed spacer,ITS)序列分析发现,不患病土壤的芽胞杆菌属()、乳球菌属()和假单胞菌属()群落丰度比患病土壤的高。Kaushal等(2020)分析了患香蕉枯萎病和不发病的香蕉根际土壤中微生物群落结构的差异,发现是否患病是影响土壤真菌群落组成的最主要驱动因素。【本研究切入点】微生物受生态环境的影响巨大,即使在同一片果园不同的农事操作亦可造成土壤微生物群落结构的差异。除研究发病与不发病香蕉根际土壤微生物群落的差异外,还需要探究健康香蕉根际土壤微生物群落的共性结构特征以及影响微生物群落主要驱动的土壤理化因子,为香蕉根际微生物调控提供理论参考。目前,关于香蕉塑造其根际微生物区系及与非根际土壤微生物差异性的共性特征研究鲜见报道。【拟解决的关键问题】从广西香蕉主产区东、中、西3个方位(浦北县、隆安县和龙州县)各选取1个香蕉种植园为研究对象,以健康植株为目标,采用Illumina MiSeq高通量测序技术对土壤细菌群落进行分析,比较香蕉根际与非根际土壤细菌种类和多样性的差异,分析土壤理化特性对土壤微生物丰度和多样性的影响,以探究不同气候和耕作条件下香蕉根际细菌的共性结构特征,探寻影响香蕉根际细菌群落结构的主要土壤理化因子,为深入理解香蕉根际微生物群落特征及制定调控策略提供理论基础。
1 材料与方法
1.1 样品采集
2018年8 月,在广西香蕉主产区东、中、西3个方位(浦北县、隆安县和龙州县)各选取1个香蕉种植园,香蕉种植园信息见表1。选择健康的香蕉植株(AAA Cavendish),在香蕉植株附近采用多点采样混合法,用采样器采集0~10 cm土壤样品作为非根际土壤;采用抖动法采集供试香蕉根际土壤,用铁锹将离地面10 cm左右的香蕉根系挖出,抖落大土块,收集附着在根系上的土壤作为根际土壤。采集的土壤样品立即用无菌袋密封放进冰盒中带回实验室;每个地区的香蕉根际和非根际土壤均取8份作为8个重复,共采集48份样品,所取土壤样品置于-80 ℃超低温冰箱冷冻保存。将采集的土壤样品分成2份,1份于2 d内用于土壤微生物DNA的提取和测序分析,另1份冷冻干燥后研磨,用于土壤各理化指标的测定。样品LZ1(LZ1_1、LZ1_2、LZ1_3、LZ1_4、LZ1_5、LZ1_6、LZ1_7、LZ1_8)和LZ2(LZ2_1、LZ2_2、LZ2_3、LZ2_4、LZ2_5、LZ2_6、LZ2_7、LZ2_8)分别代表采集自龙州县的香蕉根际和非根际土壤样品,每个样品8个重复。样品PB1(PB1_1、PB1_2、PB1_3、PB1_4、PB1_5、PB1_6、PB1_7、PB1_8)和PB2(PB2_1、PB2_2、PB2_3、PB2_4、PB2_5、PB2_6、PB2_7、PB2_8)分别代表采集自浦北县的香蕉根际和非根际土壤样品,每个样品8个重复。样品LN1(LN1_1、LN1_2、LN1_3、LN1_4、LN1_5、LN1_6、LN1_7、LN1_8)和LN2(LN2_1、LN2_2、LN2_3、LN2_4、LN2_5、LN2_6、LN2_7、LN2_8)分别代表采集自隆安县的香蕉根际和非根际土壤样品,每个样品8个重复。

1.2 土壤理化性质测定
土壤经冷冻干燥后,研磨过100目筛,称取10 g于100 mL离心管中,加入50 mL蒸馏水以搅拌器搅拌1 min,使土粒充分分散,放置30 min后进行测定。土壤pH通过多参数电导率仪进行测定。全氮(TN)和全磷(TP)含量采用过硫酸钾氧化法测定,总有机质(SOM)含量采用重铬酸钾氧化—铁盐滴定法测定,速效磷(AP)含量采用钼锑抗比色法测定;硝态氮(NN)和铵态氮(AN)含量用2 mol/L KCl溶液浸提法测定;速效钾(AK)含量采用火焰光度计法(NH4OAc浸提)测定(刘欣等,2018)。
1.3 DNA提取、PCR扩增及扩增子测序
土壤样品测序步骤:称取0.5 g土壤,使用FastD‐NASpin Kit for Soil试剂盒提取土壤总DNA。利用引物515F(5'-GTGCCAGCMGCCGCGGTAA-3')/806R(5'-GGACTACHVGGGTWTCTAAT-3')进行16S rRNA扩增,每对正、反向引物均加不同的12 bp的barcode(Wang et al.,2020)。PCR 反应体系50.0 µL:10×PCR Buffer 5.0 μL,dNTPs 4.0 μL,5 U/μL的DNA聚合酶0.5 μL,10 μmol/L正、反向引物各1.0 μL,DNA模板(20~30 ng/μL)1.0 μL,ddHO补足至50.0 µL。PCR扩增程序:94 °C预变性1 min;94 ℃20 s,57 ℃25 s,72 ℃45 s,进行30个循环;72 ℃延伸10 min。通过琼脂糖凝胶电泳回收PCR产物,并用E.Z.N.A.TM Gel Extraction Kit试剂盒进行纯化。纯化的PCR产物浓度利用Nanodrop Spectro‐photometer测定。每个PCR纯化产物按150 ng的含量混合,样本建库后采用广东美格基因科技有限公司的Illumina Miseq平台测序完成。
1.4 测序数据分析
测序的原始数据在中国科学院生态环境研究中心的环境宏基因组分析平台上完成(http://mem.rcees.ac.cn:8080)(Feng et al.,2017;Kong et al.,2018)。分析步骤:通过barcodes对原始序列进行样本分选,然后去除序列上的引物片段,再将上、下游序列进行拼接(Magoč and Salzberg,2011),将拼接后长度低于200 bp的序列去除。利用UPARSE算法检查并去除嵌合体(Edgar,2013)。以97%为划定阈值,将16S rRNA基因序列划分为操作分类单元(Operational Taxonomic Units,OTU)。代表序列与RDP数据库进行比对,进行物种注释(Wang et al.,2007)。为避免由于不同测序深度带来的影响,依据最低测序条带数的样本,对所有样本进行重抽,使所有样本具有相同序列数量。重抽后的OTU表用于进一步的分析。根据样本OTU组成之间的unweighted unifrac距离矩阵,采用主坐标分析(Principal Coordi‐nates Analysis,PCoA)对细菌群落间的相似性进行分析。
1.5 统计分析
运用SPSS 26.0对环境因子与土壤细菌进行相关性分析。利用检验算法比较2组样品土壤环境因子、多样性指数及物种丰度之间的差异性。采用多因素方差分析(ADONIS)、相似性分析(ANOSIM)和多反应排列法(MRPP)分析组间细菌群落结构的差异水平。采用Mantel test分析确定影响细菌群落结构的重要环境因子。采用DPS 7.05分析土壤理化性质与细菌多样性指数的差异显著性。采用Excel 2011和Origin 8.0进行数据处理及绘图。
2 结果与分析
2.1 香蕉根际和非根际土壤理化性质差异分析结果
从表2可知,3个地区香蕉种植园的土壤样品除LZ2样品显中性外,其余5个样品均显酸性,其中,来源于浦北县香蕉种植园的土壤pH最低,且3个地区的根际与非根际土壤pH均差异显著(<0.05,下同)。除pH外,其他的土壤理化性质在3个地区表现不一,如TN、TP和SOM含量等在LN的香蕉根际与非根际土壤中差异显著,但在PB的香蕉根际与非根际土壤中却差异不显著(>0.05,下同)。总体上,根际改变了土壤的部分理化性质,其中pH最明显。

2.2 土壤细菌多样性分析结果
高通量测序结果显示,各样品细菌测得的序列数为28361~138215个。按28361条序列重抽后,进行后续的OTU划分和物种注释等分析。基于OTUs水平,利用多样性指数进一步分析比较3个地区香蕉种植园的根际与非根际土壤微生物群落多样性差异。在土壤样品Alpha多样性分析中,Chao1指数和Rich‐ness指数值越高,反映群落的丰富度越高;Shannon指数和InvSimpson指数值越大,说明群落多样性越高。由表3可看出,不同地区的香蕉根际与非根际土壤细菌群落中的菌群多样性存在一定差异,在群落多样性指数上,来源于LZ的根际与非根际土壤细菌差异显著,但LN和PB的样品细菌差异不显著;在群落丰富度指数上,来源于PB的根际与非根际土壤细菌差异显著,但LN和LZ的样品细菌差异不显著。换言之,根际环境在LZ地区影响了细菌的多样性指数,在PB地区影响了细菌的丰富度指数。

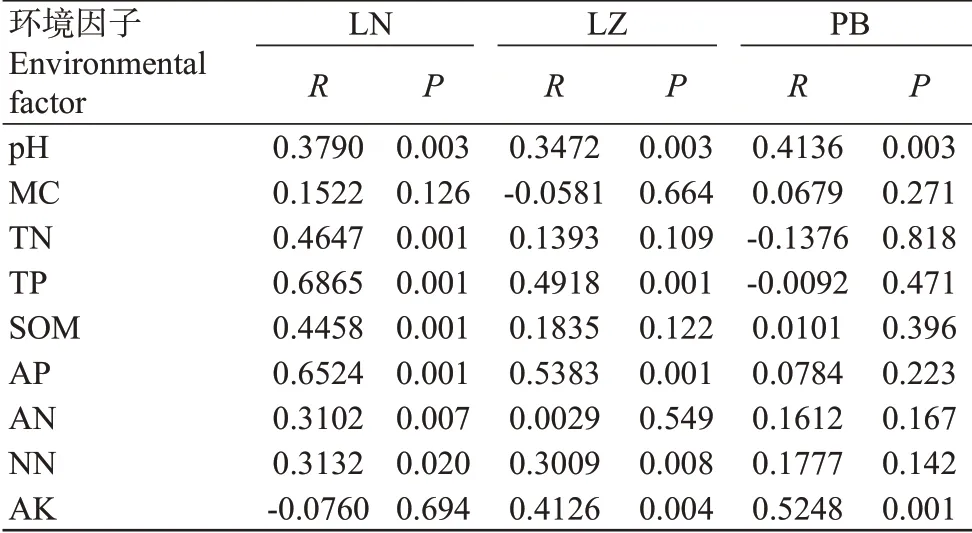
利用Pearson相关性分析研究土壤理化性质与Alpha多样性相互变化关系,得到两两之间的相关性和显著性值,结果见表4。从表4可看出,在LN样品中,TN含量与4个细菌Alpha多样性指数均呈显著正相关;TP含量仅与InvSimpson指数呈极显著正相关(<0.01,下同);SOM和AP含量仅与InvSimpson指数呈显著正相关;NN含量与Shannon指数和Chao1指数呈显著正相关、与InvSimpson指数和Richness指数呈极显著正相关。在LZ样品中,pH与InvSimpson指数呈显著负相关;TN含量与Shannon指数呈显著正相关、与InvSimpson指数呈极显著正相关;TP含量与InvSimpson指数呈极显著正相关;AP、NN和AK含量与Shannon指数呈显著正相关、与InvSimpson指数呈极显著正相关。在PB样品中,仅pH与Richness指数呈显著正相关、与Chao1指数呈极显著正相关。以上结果说明,环境因子在不同地区的香蕉种植园对细菌的Alpha多样性影响不一,表现出地区特异性。

2.3 香蕉根际和非根际土壤细菌物种丰度分析结果
由图1可看出,在所有土壤样品中,共有11个可注释到的优势门被检出(丰度大于1%),包含变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、奇古菌门(Thaumarchaeota)、浮霉菌门(Planctomycetes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicro‐bia)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmati‐monadetes)和硝化螺旋菌门(Nitrospirae),其中奇古菌门为古细菌。变形菌门和酸杆菌门为最占优势的2个门,变形菌门在所有样品中的丰度为17.25%~37.83%,酸杆菌门在所有样品中的丰度为13.45%~23.03%,其中变形菌门在根际土壤中的丰度明显高于非根际土壤,在LN、LZ和PB的根际土壤中的丰度分别为37.82%、29.19%和25.70%,在非根际土壤中的丰度分别为19.96%、17.25%和25.72%,同样被富集的门包括放线菌门、芽单胞菌门和硝化螺旋菌门;酸杆菌门的丰度在根际土壤中被过滤,丰度明显少于其在非根际土壤,在LN、LZ和PB的根际土壤中的丰度分别为14.02%、14.74%和13.45%,在非根际土壤中的丰度分别为22.03%、19.80%和23.03%,同样被过滤的门还有浮霉菌门。

在属分类水平上,相对丰度排名前10的菌属分别为未分类菌属(Unclassified)、酸杆菌属()Gp6、亚硝化球菌属()、、芽单胞菌属()、Subdivision3 genera incertaesedis、酸杆菌属Gp2、酸杆菌属Gp4、酸杆菌属Gp1和酸杆菌属Gp3。所有的样品中,40.10%~46.84%的序列为Unclassified,丰度排名前25的菌属中,在3个地区的香蕉根际均被富集的细菌属为芽单胞菌属、硝化螺旋菌属()、红游动菌属()、鞘氨醇单胞菌属()、土微菌属()、、链霉菌属()和。被根际过滤的有酸杆菌属Gp6、亚硝化球菌属、酸杆菌属Gp2和酸杆菌属Gp3(图2)。

2.4 香蕉根际和非根际土壤细菌群落及其与环境因子的相关分析结果
采用非参数检验方法ADONIS、ANOSIM 和MRPP分析3个地区香蕉种植园的根际与非根际土壤细菌群落结构的差异,结果(表5)显示,3个地区香蕉种植园的根际与非根际土壤细菌群落结构均差异极显著,说明香蕉根际均对土壤细菌有一定的塑造作用。
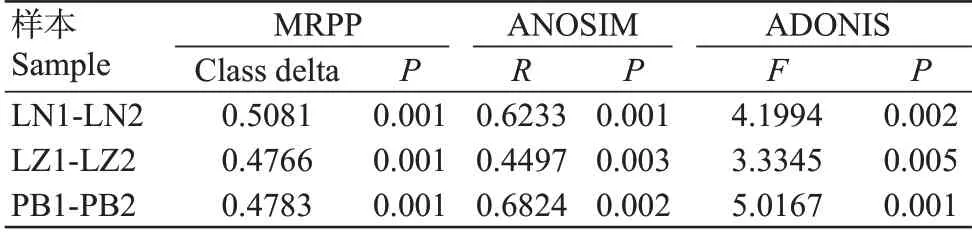
为探明不同地区香蕉种植园土壤细菌群落结构的影响因子,本研究利用Mantel test分析了pH、欲含水量(MC)、SOM、TN、TP、AP、NN、AN和AK与群落结构的相关性,结果(表6)显示,在参与分析的9个环境因子中,LN地区的土壤细菌群落受影响的环境因子最多,pH、SOM、TN、TP、AP、NN和AN均与细菌群落显著或极显著相关;LZ地区的土壤细菌群落受影响的环境因子次之,受pH、TP、AP、NN和AK的显著影响;PB地区的土壤细菌群落受影响的环境因子最少,仅与pH和AK极显著相关。由此可见,不同地区的香蕉种植园土壤细菌受不同的理化性质调控,而3个地区的香蕉种植园土壤细菌均主要受pH的极显著影响。
2.5 香蕉根际和非根际土壤细菌生态功能的共性规律分析结果
根据物种分类结果,通过FAPROTAX数据库对香蕉种植园土壤细菌群落进行功能注释,除未鉴定类群外,细菌获得78种功能分组,丰度排名前20的功能分组见图3。其中,丰度大于1%的只有7种,除Others外,剩下6种是可注释的功能分组,分别为化能异养(Chemoheterotrophy)、好氧化能异养(Aero‐bic_chemoheterotrophy)、硝化(Nitrification)、好氧氨氧化(Aerobic_ammonia_oxidation)、动物寄生虫或共生体(Animal parasites or symbionts)和硝酸盐还原(Nitrate reduction)。其中化能异养和好氧化能异养是在根际土壤中最明显的富集类群,化能异养菌群在LN、LZ 和PB 的根际土壤中的丰度分别为9.67%、7.04%和8.47%,在非根际土壤中的丰度分别为4.77%、4.73%和4.33%;好氧化能异养菌群在LN、LZ和PB的根际土壤中的丰度分别为9.20%、6.57%和7.96%,在非根际土壤中的丰度分别为4.39%、4.40%和4.08%;同样被富集的功能包括掠食性或寄生性(Predatory or exoparasitic)和硝酸盐还原;相反,硝化和好氧氨氧化菌群在根际土壤中的丰度明显少于其在非根际土壤。

3 讨论
香蕉种植园中的土壤生活着大量微生物,微生物群落结构的组成及其改变不但与根际养分时效性及植物生长发育等密切相关,而且能影响土传病害的发生发展(漆艳香等,2019)。香蕉在与土壤微生物的长期互作过程中,香蕉能通过分泌根际分泌物等途径演化形成其根际圈土壤菌群,这些根际微生物在平衡植物激素、调节根的生长、促进营养吸收、阻止病害侵袭等方面发挥着重要的防线作用(贾利华等,2019)。因此,研究香蕉种植园土壤微生物群落结构、驱动因素及规律,对香蕉在实际生产过程中的管理调控具有重要的参考价值。
本研究发现在3个不同地区香蕉种植园的根际及非根际土壤微生物群落差异显著,在Chao1、Rich‐ness、Shannon和InvSimpson 4个多样性指数上,3个地区香蕉根际土壤细菌群落的丰富度与多样性均比非根际的更丰富,一般而言,较高的细菌多样性表示土壤具有更高的抗性,意味着健康的香蕉根际能对附着的细菌产生一定的调控作用,使细菌朝着有利于植物的方向演变,与葛应兰和孙廷(2020)的研究结果一致,他们发现马铃薯根际土壤细菌和真菌均匀度指数(Simpson)、多样性指数(Shannon-Wie‐ner)、ACE和Chao 1指数均显著高于非根际;然而,李怡等(2019)的研究结果表明,毛竹林地根际土壤细菌群落丰富度及多样性均低于非根际土壤。这些结果说明,不同的植物根际对土壤微生物多样性的影响表现出植物品种特异性。
在土壤细菌群落结构组成上,本研究发现,变形菌门(相对丰度为17.25%~37.83%)在3个香蕉种植地丰度最高,其次为酸杆菌门,与邓大豪等(2019)的研究结果类似,其以广西不同品种香蕉种植地土壤微生物为研究对象,发现丰度最高的变形菌门占比为17.947%~45.01%。Shen等(2015)对抑病型香蕉土壤微生物进行测序分析,同样发现变形菌门和酸杆菌门是丰度最高的2个门;Wang等(2020)发现在甘蔗根际微生物中,变形菌门也是最丰富的优势门。植物根际和非根际土壤中细菌群落结构的差异,归因于植物对微生物群落具有强烈的选择作用,而且微生物群落结构的变化与微生物功能类群息息相关,且能影响环境的生态功能(Fuhrman,2009)。前人多项研究表明,植物根际能招募有益于自身的微生物菌群来促进植物生长和抵抗病原菌的入侵,如被病原菌侵染的拟南芥可通过改变根系分泌物成分招募有益微生物群落,并促进后代植物对病原菌的抵抗力(Yuan et al.,2018);Liu等(2021)发现小麦根际能招募嗜根寡养单胞菌()(SR80),保护植物对抗病原体假禾谷镰孢菌()。本研究同样发现,3个地区的健康香蕉植株的根际能富集一些有益的微生物类群,在门的水平,变形菌门在3个地区的根际土壤中丰度均明显高于非根际土壤,而且差异显著,沈宗专(2015)发现抑病型土壤中变形菌门的丰度显著高于导病型土壤,同样被根际富集的放线菌门是环境中一类重要的微生物,在促进植物生长和防治病害方面发挥重要作用。在属的水平上芽单胞菌属、链霉菌属和鞘氨醇单胞菌的丰度在3个地区的香蕉根际土壤均高于非根际土壤,沈宗专(2015)发现施用生物有机肥能增加芽单胞菌属和鞘氨醇单胞菌属在香蕉种植园土壤中的丰度,并且它们的丰度与香蕉枯萎病发病率间呈负相关关系,表明它们的存在能起到抑制香蕉病害发生的作用。Yin等(2021)研究也发现土壤中的链霉菌和鞘氨醇单胞菌能抑制真菌病害的发生。此外,被富集的芽单胞菌属还具有降解根际土壤中的纤维素和木质素,增加土壤有机质含量和促进根际微生物固氮的作用(Xie et al.,2020;Hu et al.,2021)。Wang等(2020)的研究发现,施用除草剂氯吡嘧磺隆的土壤,其微生物群落结构和优势种群发生了明显改变,蓝藻细菌门(Cyanobacteria)和unclassified Chloroflexi种群数量明显增加并积极参与氯吡嘧磺隆生物降解过程。本研究通过FAPROTAX数据库功能注释发现,细菌功能较丰富,其中化能异养菌群和好氧化能异养菌群的占比较大,而且在根际土壤中的丰度明显高于非根际土壤,高比例的化能异养菌有助于香蕉种植园中有机质的分解利用,同样能促进植物的营养吸收和养分循环。未来的工作将结合根际代谢组学进一步揭示香蕉根际对微生物组构建的作用机制。
土壤理化性质与微生物群落组成和功能组成均具有紧密联系,本研究分析结果表明,3个地区香蕉种植园的土壤微生物群落均受到土壤理化性质的影响,但不同地区的土壤微生物群落受不同的土壤理化性质影响,除地理因素影响外,同一地区的香蕉种植园的土壤微生物群落均受pH的极显著影响。pH是对土壤微生物群落影响的最重要环境因子,如Shi等(2018)通过空间尺度分析243个土壤样本的细菌群落结构特征,发现pH是影响华北平原土壤微生物群落结构的最重要影响因子;葛应兰和孙廷(2020)发现土壤pH是马铃薯根际土壤微生物多样性的重要影响因子。除pH外,TN、TP和AN等对土壤微生物群落结构也有影响。以上结果证明,由于不同地区土壤具备不同的理化性质特点,从而对微生物群落的影响因素并不相同,但pH在3个地区均能极显著影响微生物的群落结构,是一个重要的调控因子。
4 结论
3个地区香蕉种植园根际土壤细菌群落多样性均高于非根际土壤,而两者间微生物群落结构也存在明显差异,根际能富集一些有益菌群并招募有益的功能细菌。土壤微生物群落多样性和组成在不同地区间的差异明显,每个地区的土壤微生物群落结构和多样性受不同的环境因子影响,与土壤理化性质密切相关,其中土壤pH对3个地区香蕉种植园的土壤细菌群落均起着重要的调节作用。
