不同秋眠类型紫花苜蓿根际与非根际土壤理化性质及化学计量特征
2022-04-25昝看卓阿山江伊米尼江何树斌王可珍龙明秀
昝看卓, 阿山江·伊米尼江, 刘 丛, 谭 凯, 白 婕, 何树斌, 王可珍, 屈 洋, 龙明秀*
(1. 西北农林科技大学草业与草原学院, 陕西 杨凌 712100;2. 宝鸡市农业科学研究院, 陕西 岐山 722400)
紫花苜蓿(Medicagosativa)是一种产量高、营养价值高、抗逆性强的多年生豆科牧草,具有“牧草之王”的美誉[1-2]。近年来,在“粮改饲”等国家战略支持下,紫花苜蓿栽培面积不断增加,《全国种植业结构调整规划》提出,到2020年饲草料种植面积发展到633.65万hm2,其中苜蓿种植面积要达到233.45万hm2[3]。在我国黄土高原地区,紫花苜蓿不仅为当地畜牧业发展提供了营养价值较高的优质饲草[4],且在防止水土流失,增加土壤肥力等方面发挥了重要作用[5]。紫花苜蓿的秋眠性(Fall dormancy)是指在北纬中高纬度地区随着秋季温度和光照变化而导致苜蓿植株形态类型和生活力发生变化的生长特性[6],按秋眠性强弱分为强秋眠(1~3级)、半秋眠(4~6级)和非秋眠(7~9级)3种类型。非秋眠苜蓿春季返青晚[7],但在秋季收割后再生速度快[8],产量要明显高于秋眠级低的品种,因此,在我国北方地区合理选择不同秋眠类型的苜蓿品种对苜蓿人工草地的建植极其重要。
根际是土壤—根系—微生物三者相互作用的场所,也是营养物质循环和能量流动的最活跃的区域,在生态系统养分分布与循环过程中发挥着重要作用[9-11]。研究表明根际土壤的物理、化学和生物学特征,如土壤有机碳(Soil organic carbon,SOC)、全氮(Total nitrogen,TN)、全磷(Total phosphorus,TP)及其参与营养物质循环的蔗糖酶(Sucrase,SUC)、脲酶(Urease,URE)、蛋白酶(Protease,PRO)、碱性磷酸酶(Alkaline phosphatase,ALP)等显著不同于非根际土壤[12-14]。因此,阐明根际和非根际土壤中C、N、P营养物质积累和循环的规律,对于土壤肥力、土壤质量及土壤健康的评价与管理具有指导意义[15-16]。春季再生期和冬季休眠期强秋眠、半秋眠和非秋眠紫花苜蓿在根系营养物质转运与贮藏、再生速度和产量等方面存在明显的差异[17],这是否会导致不同秋眠类型苜蓿在土壤根际微生态存在差异性,目前鲜有这方面的研究。因此,本研究测定了陕西关中地区种植5年的不同秋眠类型紫花苜蓿根际和非根际的土壤理化性质,有助于进一步探究不同秋眠类型紫花苜蓿土壤营养物质循环与生产力之间的关系以及根际土壤微生态。
1 材料与方法
1.1 样地概况
试验地设在陕西省宝鸡市农业科学研究院刘家塬试验站(34.5°N,107.5°E),位于关中平原西部,平均海拔669.6 m,属暖温带大陆性季风气候,四季分明,夏季高温多雨,冬季低温少雨,年平均气温12℃,极端最高温度36℃左右,极端最低温度-4℃左右,年平均日照时数2 064.8 h,平均无霜期214 d,年平均降水量623.8 mm[18],降雨分配不均,主要集中在7—9月。试验地土质为黄绵土、娄土,试验小区地势平坦,肥力均匀,光照充足,适于紫花苜蓿的生长。
1.2 样地设置与样品采集
本研究选用了WL298HQ(D)、雷霆(SD1)、前景(SD2)、赛迪7(ND1)和精英(ND2)[19-21]5个品种紫花苜蓿作为试验对象(表1),采用完全随机区组设计,每个小区长10 m,宽3 m,行间距30 cm。

表1 供试紫花苜蓿品种的休眠类型
在冬季休眠期和春季再生期分别采样,采用5点取样法(即分别选取样方4个顶点和中心位置)在每个小区采集土壤样品,根际土壤样品的采集参考Chaudhary的抖落法[22],挖取具有完整根系的土体(根系主要分布的范围),先轻轻抖落大块不含根系的土壤,取下附在根系周围的土壤,作为非根际土;然后用刷子刷下黏附在根系周围的土壤(距离0~5 mm),作为根际土[23],随后将每个样地5个点的根际与非根际土壤分别混匀为一份复合土壤样本,带回实验室;土壤样品用于土壤有机碳(SOC)、土壤全氮(TN)、土壤全磷(TP)及土壤酶活性的测定。
1.3 土壤理化性质分析
土壤有机质(SOC)用重铬酸钾容量法测定;土壤全氮(TN)用凯氏法消解,AA3型连续流动分析仪测定;土壤全磷(TP)用H2SO4-HClO4消解法测定;蔗糖酶(Sucrase,SUC)采用3,5-二硝基水杨酸比色法测定;脲酶(Urease,URE)用靛酚蓝比色法测定;蛋白酶(Protease,PRO)用茚三酮比色法;碱性磷酸酶(Alkaline phosphatase,ALP)用磷酸苯二钠比色法测定[24-25]。
1.4 数据统计与分析
利用Excel软件对数据进行整理并处理,SPSS19.0软件进行单因素方差分析(One-Way ANOVA)和最小显著差异(LSD)检验,用Origin2021软件作图。
2 结果与分析
2.1 休眠期和再生期不同秋眠类型紫花苜蓿根际与非根际土壤养分含量变化
在冬季休眠期,除强秋眠苜蓿(D)根际TN含量略低于非根际土壤(P>0.05)外,其余各秋眠类型苜蓿土壤SOC,TN,TP含量及C∶N,N∶P,C∶P整体上表现为根际土壤高于非根际土壤,且SOC、TN在根际土壤中显著富集(P<0.05),TP无显著差异(P>0.05)(图1,表2)。随着秋眠级递增,根际与非根际土壤的SOC、TN含量逐渐升高,即D 图1 休眠期不同秋眠类型紫花苜蓿根际与非根际土壤SOC,TN,TP含量 表2 休眠期不同秋眠类型紫花苜蓿根际与非根际土壤化学计量特征 在春季再生期,SOC,TN,TP含量及C∶N,N∶P,C∶P表现为根际土壤高于非根际土壤,且SOC、TN、C∶N、C∶P差异显著(P<0.05),TP,N∶P无显著差异(P>0.05)(图2,表3)。除D的TN含量低于SD2(P<0.05)外,强秋眠苜蓿(D)的根际与非根际土壤其余指标均高于半秋眠(SD)和非秋眠苜蓿(ND),且整体趋势为随着秋眠级数递增,土壤养分含量逐渐降低;根际与非根际土壤的C∶N,N∶P,C∶P在各秋眠类型之间普遍表现为D高于SD,ND。 图2 再生期不同秋眠类型紫花苜蓿根际与非根际土壤SOC、TN、TP含量 表3 再生期不同秋眠类型紫花苜蓿根际与非根际土壤化学计量特征 由图3、4可知在冬季休眠期和春季再生期,土壤酶活性整体表现为根际土壤显著高于非根际土壤(P<0.05)。就根际土壤而言,在休眠期,D的土壤脲酶活性高于ND,ND的蔗糖酶、蛋白酶及碱性磷酸酶活性均显著高于D(P<0.05);再生期苜蓿土壤脲酶、蔗糖酶、蛋白酶活性变化趋势与休眠期相反,即D的土壤脲酶活性低于ND,蔗糖酶、蛋白酶活性均为ND显著低于D(P<0.05);碱性磷酸酶活性依然为ND显著高于D(P<0.05)。冬季休眠期ND非根际土壤蔗糖酶显著高于D(P<0.05),再生期D与ND非根际土壤蔗糖酶、蛋白酶及碱性磷酸酶存在显著差异(P<0.05)。 图3 休眠期不同秋眠类型紫花苜蓿根际与非根际土壤酶活性变化 图4 再生期不同秋眠类型紫花苜蓿根际与非根际土壤酶活性变化 冬季休眠期,根际土壤SOC与TN正相关、与SUC极显著正相关(P<0.01),TN与SUC,PRO极显著正相关(P<0.01),与URE负相关;非根际土壤SOC与TN、SUC呈极显著正相关(P<0.01),与PRO,URE负相关,TN与SUC极显著正相关(P<0.01),与PRO,URE负相关。春季再生期根际土壤SOC与TN、URE正相关,与SUC、PEO极显著正相关(P<0.01),TN与SUC极显著正相关(P<0.01),与URE负相关(P>0.05);非根际土壤SOC与TN、PRO负相关,TN与URE、SUC正相关(P>0.05、P<0.01),与PRO负相关。 图5 休眠期与再生期不同秋眠类型紫花苜蓿根系养分与土壤养分之间的相关性分析 本研究中不论冬季休眠期还是春季再生期土壤的SOC,TN,TP含量整体都表现为根际土高于非根际,与前人的研究结果一致[26-28],这可能是由于植物根系分泌物向根表的迁移及其不断从外界摄取养分,使得根际微区域内的养分形态、浓度和分布等方面较为复杂,养分在根际周围表现出明显的根际正效应,根系与土壤在根际区共同构建了一个特殊的微生态系统[29-30]。本研究中的根际SOC,TN显著高于非根际土壤,可能是由于豆科作物的结瘤固氮作用增加了土壤N的有效性[31],且植物通过向根际释放信号物质,诱导根瘤菌侵染豆科根系,并利用豆科光合产物作为C源固定大气中的N素,进一步满足对N素的需求,另一方面植物还会以向根际分泌氨基酸以及根系脱落物腐解形式将N素释放到根际[32];植物根系分泌物中的可溶性糖作为一种C源参与根际养分循环,故而根际土的SOC,TN均高于非根际土壤[33]。根际与非根际土壤TP变化无显著差异,可能是由于P是一种沉积性矿物,在土壤中的迁移率较低,因此TP在整个空间中分布较为均匀[34]。 土壤酶作为土壤的组成部分,其活性的大小较敏感地反映了土壤养分循环和代谢活动的强度[35]。本研究紫花苜蓿根际土壤酶活性远远高于非根际土壤,与前人研究结果一致[14],这可能是由于植物根系分泌物作为信号物质招募微生物[36],而微生物数量是酶活性的影响因子之一[37],故而导致根际酶活性高于非根际土壤。蔗糖酶在土壤有机质的分解转化中起重要作用,能反映土壤的生物化学活性[38],蛋白酶是土壤有机氮水解为氨基酸过程中重要的酶,能够将蛋白质、肽类分解为氨基酸,参与调节生物的N素代谢,是促进土壤N循环的重要组分[39],研究表明土壤SOC和TN是调控酶的主要因子[40],本研究中根际土壤蔗糖酶和蛋白酶活性分别与SOC和TN呈正相关,与前人研究结果一致[41-42]。脲酶能促进土壤中尿素转化为植物生长所需的N素[43-44],土壤脲酶活性增大,N素含量增加[45-46],但本研究中根际与非根际土壤TN与URE负相关,可能是由于不论在冬季休眠期还是春季再生期,紫花苜蓿都不断吸收土壤内的氮素,使得底物浓度减少[47],故而土壤脲酶的活性降低。 土壤C∶N反映了C、N之间的平衡关系,是土壤有机质组成和质量程度的一个重要指标[48],能反映土壤N素的矿化能力和土壤有机质的分解速度[15]。较低的C∶N表明土壤有机质处于加速分解状态,土壤有机N处于矿化水平[49]。本研究中冬季休眠期苜蓿根际与非根际的C∶N均高于全国平均值(12.3)[50],表明研究区内根际土壤有机质的矿化速率较慢,由于此时土壤C和N多数来自凋落物的归还,故而根际和非根际的C∶N都较高。在春季再生期,苜蓿根际C∶N高于12.3,而非根际C∶N低于12.3,这可能是由于再生期紫花苜蓿的根系进行固氮从而导致有机氮的矿化速率变慢,此时非根际土壤的有机N矿化仍然较快。土壤N∶P可诊断N的饱和,同时也是预测土壤养分限制类型的重要指标之一[51],由土壤TN和TP含量共同决定[52],本研究中冬季休眠期和春季再生期根际土壤的N含量均较非根际高,而P含量根际与非根际无显著差异,故而N∶P总体表现为根际高于非根际且皆低于全国平均值(5.2)[50]。C∶P可判断土壤磷矿化水平的高低[53],本研究中休眠期和再生期的根际C∶P高于非根际土壤且远低于全国平均值(61.0)[50],表明该区土壤P分解较快,有效性较高,这可能是由于豆科植物进行固氮作用时会向根际释放大量的质子导致土壤酸化,从而改善了土壤中磷素的有效性[33]。 本研究中冬季休眠期根际与非根际土壤内SOC,TN,TP含量整体变化趋势表现为随着秋眠级数递增,养分含量逐渐升高,即强秋眠(D)<半秋眠(SD)<非秋眠(ND),而再生期的表现趋势正好相反,即强秋眠(D)>半秋眠(SD)>非秋眠(ND),这可能是由于当秋季日照长度变短、温度变低时,越冬能力强的品种的秋眠性将被触发而在初秋停止地上部分的生长,在秋季刈割之后,强秋眠苜蓿再生慢[8],到晚秋时地上部向地下部输送养分有限,为了保证安全越冬,根系从周围土壤中吸收养分[54],贮存营养以备越冬之用,使得土壤内养分含量降低;到春季再生期,强秋眠苜蓿返青早[7]且越冬时根系处于休眠[55],根内营养消耗少故再生时从土壤内吸收养分较少,而非秋眠苜蓿在秋季继续旺盛生长,而后常会在经历几次霜冻后消耗根系存储的养分,到春季再生时为了植株生长而吸收的土壤养分多,可能使得休眠期非秋眠苜蓿(ND)土壤养分高于强秋眠苜蓿(D),而再生期趋势相反。在冬季休眠期和春季再生期,紫花苜蓿的秋眠级数大小与土壤养分含量高低分别表现为负相关与正相关的关系,二者之间具体存在的机制调控,还需进一步研究探索。 本研究表明,紫花苜蓿根际土壤养分含量及土壤酶活性显著高于非根际土壤,具有明显的根际正效应;冬季休眠期土壤SOC、TN、TP含量整体变化趋势表现为随着秋眠级数递增,养分含量逐渐升高,即秋眠(D)<半秋眠(SD)<非秋眠(ND),而再生期的表现趋势正好相反。
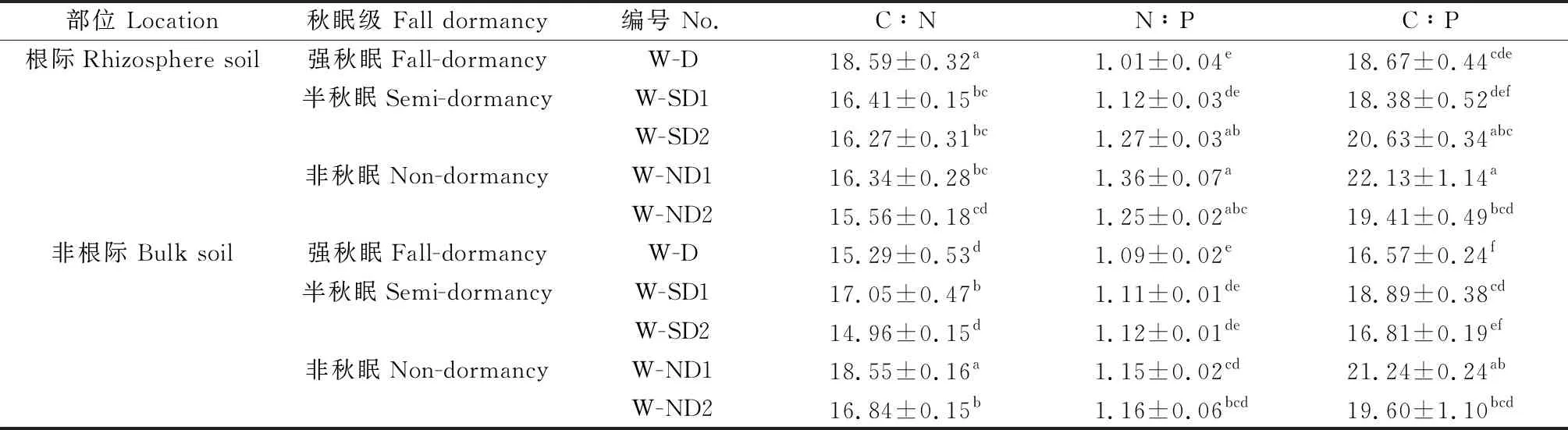


2.2 休眠期和再生期不同秋眠类型紫花苜蓿土壤酶活性变化

2.3 休眠期和再生期不同秋眠类型紫花苜蓿土壤养分与酶活性之间的相关性分析

3 讨论
3.1 休眠期和再生期紫花苜蓿根际与非根际土壤理化性质
3.2 休眠期和再生期根际与非根际土壤化学计量比变化特征
3.3 休眠期和再生期不同秋眠类型紫花苜蓿土壤养分变化
4 结论
