TGF-β3对成骨细胞的增殖和成骨能力的影响及其机制初探
2022-07-29艾力麦尔旦艾尼瓦尔木合塔尔霍加
艾力麦尔旦·艾尼瓦尔,木合塔尔·霍加,王 玲
创伤、肿瘤、炎症以及牙源性疾病引起的各类颌面部骨缺损严重影响患者的咬合、咀嚼功能和美观[1]。各类颌骨缺损的修复重建是临床难题。自体骨移植是目前被广泛接受的修复颌面部骨缺损的首选治疗方法,但其缺点如供区骨量不足、供区骨形态与受区不符、免疫排斥、创伤大等限制其应用和疗效。骨替代品如同种异体骨、异种异体骨和人工合成骨等虽然也是不错的选择,但也存在免疫排异、吸收率高、价格贵等缺点,从而影响其广泛应用[2]。所以近年来学者们尝试从组织工程的角度寻找通过自身骨组织再生来修复各类骨缺损的方案,其中各类生长因子和支架材料的联合应用下诱导有成骨分化能力的各类细胞使其加速成骨是近阶段主要的研究方向[3]。颅盖骨来源的成骨细胞与颌面部诸骨均来自于间充质细胞的增殖和分化,两者具有相同的胚胎发育起源,而且颅盖骨来源的成骨细胞易于获取和培养[4],是动物实验时研究颌面部骨组织再生比较理想的细胞。
转化生长因子-β3(transforming growth factor-β3, TGF-β3)是一类多效能生长因子,参与调控细胞的生物化学信息传递、增殖分化和凋亡过程[5]。TGF-β3在造血和免疫干细胞、癌细胞的功能调节方面发挥重要作用。TGF-β3介导的细胞信号传导多数是TGF-β与细胞膜上的Smad蛋白结合来实现,即经典的TGF-β-Smad依赖通路。课题组前期研究已用改良酶消化法和酶解组织块法成功分离培养兔颅盖骨来源的成骨细胞和牙髓干细胞并证实TGF-β3能够促进牙髓干细胞的增殖和成骨能力,其成骨诱导作用有TGF-β-Smad依赖通路的参与[4,6-7],而TGF-β3对成骨细胞的增殖和成骨影响至今相关报道甚少。本研究在前期研究的基础上,选取0.1~100 μg/L浓度的TGF-β3加入成骨细胞培养液中诱导培养,观察TGF-β3对成骨细胞的增殖和成骨能力的作用及其初步机制。
1 材料与方法
1.1 实验材料与试剂
1.1.1 实验动物 清洁级新西兰大白兔幼兔3只,1周龄,体重80~100 g,雌雄不限,由新疆医科大学实验动物中心提供。使用许可证编号:SYXK(新)2015-0001;生产许可证号:SCXK(新)2015-0004。动物的使用通过新疆医科大学第一附属医院动物伦理委员会批准(动物伦理审批号:IACUC-20190218-007)。
1.1.2 实验试剂与仪器 胎牛血清(fetal bovine serum, FBS)、磷酸盐缓冲液(phosphate buffer saline,PBS)、青链霉素、胰蛋白酶、高糖DMEM培养基 (Hyclone,美国),TGF-β3(Peprotech,美国),ALP活性测定试剂盒(南京建成公司),CCK-8试剂盒(日本同仁公司),二甲基亚砜(DMSO)(Amresco,美国),OCN一抗(Abcam,美国),COL-1A1一抗(Novus Biologicals,美国),Runx-2一抗(北京博奥森公司)二氨基联苯胺染色试剂盒(DAB)(北京中衫金桥公司),小鼠单抗β-actin、兔多抗Smad2/3(武汉博士德公司)定量PCR仪(Bio-Rad,美国),5%CO2恒温孵箱、离心机、酶标仪(Thermo,美国),倒置显微镜(Leica,德国)。
1.2 方法
1.2.1 成骨细胞的培养与纯化 参照本课题组前期方法[4],处死新西兰幼兔取出颅盖骨剔除表面的软组织后切成1 mm×1 mm×1 mm大小骨小块,2.5 g/L胰蛋白酶中预消化20 min,1 g/LⅠ型胶原酶在恒温摇晃器中摇晃40 min,终止消化后将悬液用200目细胞筛网过滤,将未通过筛网的组织块分离出来PBS冲洗后放入培养瓶中,加入完全培养液放入细胞培养箱中培养,每2~3 d换液1次,待细胞长满80%~90%后用差速贴壁法[4]纯化以得到高纯度的成骨细胞,纯化后的细胞每48 h换液1次,待细胞长满培养瓶80%~90%后传代。每次换液时显微镜下观察细胞生长情况并拍照。
1.2.2 成骨细胞的鉴定 分离培养并纯化的成骨细胞行形态学观察,碱性磷酸酶(alkaline phosphatase,ALP)活性检测,免疫细胞化学染色观察胶原蛋白-1A1(collagen-1a1, COL-1A1),Runt相关骨形成蛋白-2(runt-related transcription factor-2, Runx-2)以及骨钙素(osteocalcin, OCN)的表达情况,采用qPCR法行成骨标志基因ALP,骨桥蛋白(osteopontin, OPN),骨涎蛋白(bone sialoprotein, BSP),成骨细胞特异性转录因子(Osterix, Osx)检测,培养3周后茜素红染色观察成骨细胞形成的矿化结节。
1.2.3 茜素红染色 第3代成骨细胞常规培养21 d弃培养液,用质量浓度为4%的多聚甲醛固定40 min,弃固定液,PBS冲洗3次后加入1 mL质量浓度为1%的茜素红染液,37 ℃放置40 min后PBS冲洗染液,移置超净台内自然干燥后显微镜观察各组矿化结节形成情况并拍照。
1.2.4 实验分组 成骨细胞分为对照组和实验组,对照组为常规培养液(10%FBS+1%双抗的DMEM高糖培养液)培养的成骨细胞。实验组分4组,分别为在对照组培养液中加入0.1、1、10、100 μg/L浓度的TGF-β3。
1.2.5 CCK-8法测定细胞增殖 第3代成骨细胞以5×103个/孔接种于7块96孔板中,每板细胞分为5组,每组设4个复孔(其中1孔为空白对照),各组分别培养1、3、5、7、9、11、13 d后各取一块培养板弃培养液,根据CCK-8试剂盒操作步骤操作并在450 nm处测定各孔吸光度值,每组重复测3次并计算各组平均值,以培养天数为横轴,吸光度平均值为纵轴做生长曲线图。
1.2.6 ALP含量测定 第3代成骨细胞以1×104个/孔浓度接种到24孔板中,每组设3个复孔,分别培养7、14 d后按照ALP试剂盒操作步骤操作,酶标仪490 nm处检测各组细胞吸光度值,每组重复测3次取平均值并计算各组ALP含量(金氏单位)。
1.2.7 免疫细胞化学染色 第3代成骨细胞以1×104个/孔细胞浓度接种于4块24孔板中,每板设5组,分别在分组培养第1、3、5、7天取一块培养板弃液,4%多聚甲醛固定1 h,PBS洗3次,进口羊血清封闭40 min后滴加以合适比例稀释的鼠抗兔OCN、COL1-A1和Runx-2一抗,根据抗体说明书操作步骤操作,最后DAB显色,苏木素复染,镜下观察染色情况并拍照,每组实验重复3次。染色后胞质棕染判定为阳性。阳性判定具体方法参照课题组前期实验方法[4],各组细胞显微镜( ×100)下随机取中段5个视野,用cellSens Dimension 软件分析每个视野中阳性面积所占比例,阳性率为20%以下则判定为阴性,阳性率30%~50%为弱阳性,阳性率50%~80%为阳性,阳性率>80%则判定为强阳性。
1.2.8 实时定量PCR(real-time quantitative PCR,qPCR) 第3代成骨细胞以1×106个/孔接种于2块6孔板中,随机分为5组培养,培养7、14 d后,每组细胞用Trizol法提取细胞总RNA,逆转录试剂盒逆转录成cDNA,逆转录反应条件如下。25 ℃:5 min,50 ℃:15 min,85 ℃:5 min,4 ℃:10 min,将β-actin作为内参对照。逆转录后的RNA用实时荧光定量PCR测定各组细胞ALP、OPN、BSP、Osx和Smad4基因的表达量,PCR反应条件为:50 ℃,2 min;95 ℃,10 min;95 ℃,30 s,60 ℃,30 s,40个循环,根据结果绘制溶解曲线,数据用2-ΔΔCt进行分析,用GraphPad Prism 7.0软件进行绘图。引物设计合成:广州天一辉远公司(表1)。

表1 本研究中PCR基因引物序列Tab.1 Primer sequences for qPCR
1.2.9 Western blotting检测 细胞接种和分组方法同上,分组培养7 d后先用全蛋白提取试剂盒提取各组细胞总蛋白,BCA试剂盒定量并测定蛋白浓度,加热变性后冷却至室温,放入-20 ℃保存。各组取20 μg蛋白进行凝胶电泳后转移至PVDF膜上,加入封闭液封闭2 h,滴加Smad2/3一抗(稀释比例1∶500) 4 ℃孵育过夜,洗去一抗后加入用封闭液稀释(稀释比例1∶50 000)的二抗将PVDF膜浸泡于二抗孵育液中室温摇床孵育2 h,洗去二抗TBST洗涤PVDF膜,滴加ECL工作液,待荧光带明显后覆保鲜膜,胶片压片后依次放入显影液、定影液,冲洗晾干后扫描胶片,用BandScan分析胶片灰度值。
1.3 统计学处理方法

2 结 果
2.1 细胞鉴定结果
2.1.1 细胞形态学观察结果 组织周围48 h即可观察到爬出的成骨细胞(图1A),贴壁生长,约8~11 d后细胞长满培养瓶80%~90%。差速贴壁法纯化和传代后的细胞形态趋于单一呈三角形或多角形,细胞形态特征符合典型的成骨细胞形态(图1B)。

A:贴壁培养48 h后可见组织块儿周围爬出的成骨细胞( ×50);B:第3代成骨细胞( ×100);C:成骨细胞培养21 d后茜素红染色可见矿化结节( ×50)
2.1.2 成骨细胞标志物检测结果 成骨细胞的表面标志物ALP(表2),COL-1A1、Runx-2和OCN蛋白(图2)和OPN、BSP(图3)均有明显的表达,成骨细胞常规培养后细胞外基质内形成矿化结节(图1C)。以上结果均表明所分离培养的细胞为成骨细胞。

表2 各组细胞ALP活性(金氏单位)Tab.2 ALP activity of each group
2.2 CCK-8测定结果
成骨细胞在对数增长期1~100 μg/L TGF-β3能明显促进细胞增殖(P<0.05),10 μg/L TGF-β3组细胞活性在细胞对数增长期过后的平台期仍高于对照组(P<0.05)(图4)。

A、D、G:对照组第一天(阴性对照);B、E:对照组第3天;C、F:10 μg/L TGF-β3组第3天;H:对照组第5天;I:10 μg/L TGF-β3组第5天

图4 各组细胞生长曲线Fig.4 Growth curve of cells in each group
2.3 ALP活性测定结果
10 μg/L TGF-β3组ALP测定值始终较对照组高(P<0.05),100 μg/L TGF-β3组ALP表达第6天后高于对照组,其余组ALP含量与对照组无统计学差异(P>0.05)(表2)。
2.4 免疫细胞化学染色结果
COL-1A1染色对照组第3天出现弱阳性而10、100 μg/L TGF-β3组则均出现强阳性;Runx-2染色对照组第3天弱阳性、第5天强阳性,10、100 μg/L TGF-β3组第3天即出现强阳性;对照组OCN染色第5天出现弱阳性第7天阳性,10、100 μg/L TGF-β3组第3天出现弱阳性,第5天即出现强阳性(图2)。
2.5 qPCR结果
10 μg/L、100 μg/L TGF-β3组在第7、14天时ALP、OPN、BSP基因的表达含量均较对照组高,差异有统计学意义(P<0.05);10 μg/L TGF-β3组第7天时ALP、OPN、Osx表达量明显高于对照组(P<0.01);10 μg/L TGF-β3组Smad4基因表达在第7、14天时均较对照组高,差异有统计学意义(P<0.05),100 μg/L TGF-β3组Smad4基因则仅在第7天较对照组高(P<0.05)(图3)。

各组计量资料采用ANOVA 分析,组间多重比较采用LSD,与对照组比较,a: P<0.05,b: P<0.01
2.6 Western blotting结果
1、10 、100 μg/L TGF-β3组Smad2/3蛋白的表达量高于对照组(P<0.05),其中10 μg/L TGF-β3组Smad2/3蛋白表达量显著高于对照组(P<0.01)(图5)。
3 讨 论
TGF-β3是TGF-β家族的一个亚型,其在组织创伤修复、软骨愈合、瘢痕修复、纤维组织形成等方面发挥重要调控作用,其相关研究也较成熟[8-9]。近年来随着生物支架材料的不断更新换代,TGF-β3在生物支架材料的支撑下促进和诱导间充质来源的成体干细胞的增殖和成骨、软骨向分化方面的研究愈来愈深入[10-12],特别是在成骨的早期阶段其作用比较显著[13-14],但TGF-β3的最佳诱导浓度存在较大的分歧。TGF-β3诱导牙周膜干细胞成骨分化最佳浓度为500 μg/L[15],作用于骨髓间充质干细胞向成骨诱导最佳浓度为25 μg/L[16],而诱导牙髓干细胞成骨向分化的最佳作用浓度为80 μg/L[6-7]。TGF-β3对细胞的增殖和分化的诱导效果随TGF-β3浓度和诱导时间发生变化,有研究发现TGF-β3的成骨诱导作用在成骨早期比较明显。本研究选取0.1~100 μg/L浓度的TGF-β3创新探索其对成骨细胞的细胞增殖和矿化作用的影响,结果显示TGF-β3对成骨细胞增殖和成骨能力较优诱导浓度范围为10~100 μg/L。
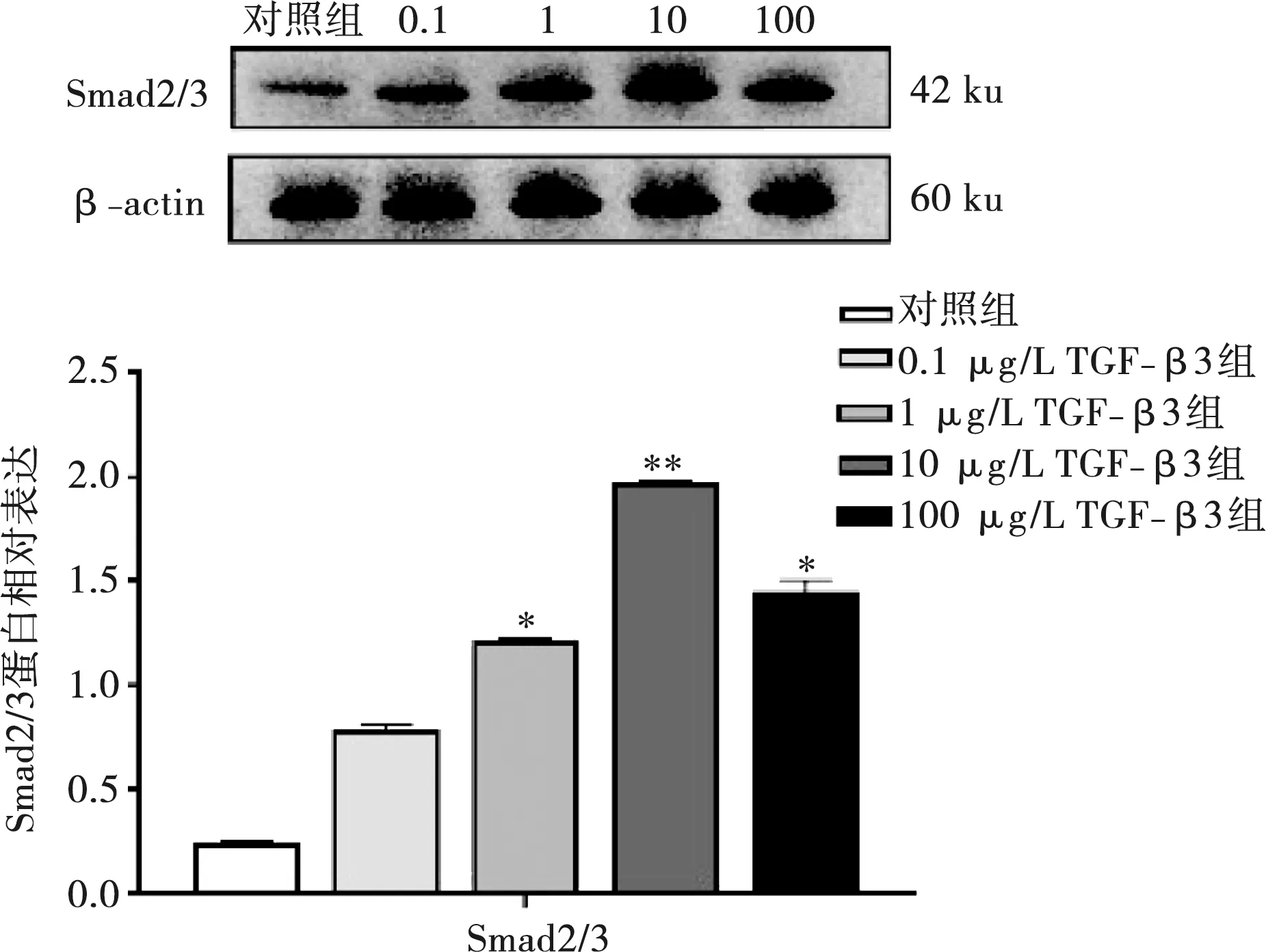
与对照组比较,*:P<0.05,**:P<0.01
TGF-β3对颅盖骨来源的纯成骨细胞的增殖和矿化能力国内外至今未见相关报道,而其在各类药物和毒素作用下增殖能力发生变化的研究较多。有研究发现同样是TGF-β家族成员的BMP-2能促进小鼠颅骨来源成骨细胞的增殖能力[17]。李若涵等[18]报道25 μg/L浓度的肝细胞生长因子(HGF)对小鼠成骨细胞系MC3T3-E1细胞的增殖有显著促进作用。有研究证实1 μg/L浓度的TGF-β对小鼠成骨细胞系MC3T3-E1细胞的增殖作用最显著[19],但此研究并未阐明具体是TGF-β的哪个亚型。本研究发现10 μg/L浓度的TGF-β3增殖能力较其余组强,此作用在成骨细胞对数增长期尤为明显。
ALP是成骨细胞典型标志酶,成骨细胞成骨早期即在细胞基质内分泌丰富的ALP,本实验结果显示10 μg/L浓度的TGF-β3组ALP表达活性始终明显高于对照组,100 μg/L TGF-β3组ALP表达第6天后高于对照组,qPCR结果也发现10~100 μg/L浓度范围的TGF-β3组ALP基因表达含量始终高于对照组。COL-1A1也是成骨细胞重要的特异性蛋白。Runx-2在成骨分化早期活跃表达,其下游基因是Osx和OPN,而OCN和BSP则在成骨晚期表达明显[20]。本研究免疫细胞化学染色结果显示10 μg/L的TGF-β3能够加速成骨细胞的COL-1A1、Runx-2和OCN蛋白的表达时间,qPCR结果也显示在10~100 μg/L浓度范围内TGF-β3组OPN、BSP、Osx基因的表达含量均高于对照组,说明10~100 μg/L浓度范围的TGF-β3均能缩短成骨细胞成骨所需的时间,10 μg/L的TGF-β3对成骨细胞成骨作用较100 μg/L组显著。
TGF-β3对细胞的作用是通过与细胞膜的特异性受体结合来实现。大部分细胞表面都有TGF-β受体,目前发现的TGF-β受体有三种,即TGF-β受体Ⅰ、Ⅱ、Ⅲ(T-βRⅠ、T-βRⅡ和T-βRⅢ)[5,21]。TGF-β信号通路包括TGF-β-Smad依赖(典型路径)和TGF-β-Smad不依赖的通路。Smad蛋白是参与TGF-β信号传导的一类蛋白,目前哺乳动物体内发现有8个Smad,即Smad1~Smad8(Smad9又被称为Smad8)[5,22]。TGF-β-Smad不依赖的通路包括ERK、JNK、p-p38介导的MAPK通路和PI3K/Akt信号通路[23]。TGF-β-Smad依赖的通路作用机制是受体信号开始时TGF-β3首先结合到细胞膜上的T-βRⅡ,然后招募和激活T-βRⅠ并磷酸化,随后被T-βRⅠ磷酸化的TGF-β3与细胞核内的Smad2和Smad3蛋白结合并与Smad4结合形成聚合物并转导信号从而完成目的基因的表达[21-22,24]。TGF-β-Smad不依赖的信号传导过程没有Smad蛋白的参与和表达。Smad家族中与细胞成骨相关的是Smad1、5、9,但不管与成骨相关与否,以上Smad都需要磷酸化后与Smad4结合形成聚合物并进入到细胞核内以后才能完成目的基因的转录和表达[22-25],所以Smad4和其前体Smad2、3是在TGF-β-Smad依赖通路的激活和转录过程中发挥重要作用的Smad蛋白。Smad2和Smad3因其分子生物学组成结构和作用非常相似,多数研究以Smad2/3复合物的形式进行检测和描述[25]。本实验结果显示10 μg/L的TGF-β3诱导成骨细胞后Smad4基因以及Smad4的前体Smad2/3蛋白的表达量均高于对照组,提示TGF-β3诱导的成骨细胞促成骨作用有TGF-β-Smad依赖通路的激活,而其上游的Smad1、5、9等是否参与到TGF-β3诱导的成骨过程需要后期实验进一步探索。TGF-β3诱导的促成骨过程中TGF-β-Smad依赖通路的激活和具体作用需要后期进行信号通路阻断实验来进一步验证。
综上所述,TGF-β3在10~100 μg/L浓度范围内对成骨细胞的增殖和成骨具有一定的促进作用,其中10 μg/L的TGF-β3成骨促进效果最明显,其促成骨作用可能通过TGF-β-Smad依赖的通路实现的。本研究为利用生长因子促进成骨并将其运用到临床骨组织缺损的修复治疗提供了一定的理论依据。
