咬合改变和束缚应激中小鼠全脑神经激活的比较研究
2022-07-29刘伟才
徐 明,李 娟,刘伟才,张 琪
临床中有一类与焦虑症有关的现象,以“无法被客观检查证实的咬合异常”为主诉症状[1-2],患者表现出对咬合和咬合治疗的高意识性且通常认为异常咬合的产生与牙科操作相关[3]。研究人员认为这种症状是由中枢神经系统的变化造成的。Marbach等[4]推断其病因为中枢神经系统中神经矩阵(neuromatrix)的变化;Clark等[5]、Tsukiyama等[6]认为是三叉神经系统的功能异常导致上述症状的产生;然而关于其病因学的假设均局限于个人判断和有限的临床观察,在病例解释中具有一定的局限性[3]。
既往研究中利用啮齿类动物的咬合升高模型(磨牙粘接树脂或粘接金属冠)发现,在咬合升高后下丘脑-垂体-肾上腺(HPA)轴被激活、血清皮质酮水平增加且动物表现出焦虑样行为[7-8]。通过对神经元活性标志物cfos蛋白进行免疫化学染色发现咬合升高手术后海马[9]、杏仁核和臂旁核[10]中激活的神经元数目显著增加。但咬合升高中全脑神经元激活情况目前尚不可知。本研究将观察小鼠咬合升高后全脑神经元的激活情况,并与常用的致小鼠焦虑行为的束缚刺激进行对照,分析两种刺激中共同激活的部位。
1 材料与方法
1.1 实验模型构建
1.1.1 咬合升高小鼠模型构建 选择12周龄C57BL/6J清洁级雄性小鼠(雷根生物科技有限公司,中国),体质量为(30±5)g(伦理编号:SL2021DW17)。小鼠在2%浓度的异氟烷中诱导麻醉,起效后转至1%浓度异氟烷面罩持续麻醉。将小鼠固定于小鼠固定器中,暴露上颌磨牙,棉球干燥牙面,涂布树脂水门汀(Kerr,美国),光固化灯固化20 s,在咬合面充填0.1~0.2 mm的光固化树脂层,光固化40 s。
1.1.2 束缚刺激小鼠模型构建 将小鼠置于50 mL离心管中(离心管上烙制数十个通风孔),当动物进入后用垫料填塞剩余空间,便于根据不同小鼠的大小限制小鼠活动。2 h后将小鼠用于免疫荧光染色实验。
1.2 行为学测试
将小鼠随机分为2组:咬合升高组(OVR组)和假手术组(Sham组)。OVR组小鼠按1.1.1处理,Sham组小鼠采用同样的操作流程,但是不涂布树脂水门汀、不充填光固化树脂。
1.2.1 旷场测试 测试于咬合升高后第7天进行。使用40 cm×40 cm×40 cm的方形不透明实验箱,测试前1 h将小鼠从饲养间转移至测试房间适应,降低动物对新环境的不安情绪。实验前用75%的酒精清洁实验箱,确保实验箱清洁无味道,将动物从饲养笼中轻轻取出,置于箱子中央,摄像机记录10 min。每只动物实验结束后均需用75%乙醇再次清洁实验箱。使用ANY-MAZE软件(Stoelting,美国)分析视频数据,在软件中设置24 cm×24 cm的中心区域,中心区域外为边缘区域,输出小鼠在中心区域内的停留时间、运动距离、进入次数等。
1.2.2 高架十字迷宫测试 测试于咬合升高后第8天进行。使用包括35 cm×5 cm×16 cm的4个臂(两个相对的闭合臂和两个相对的开放臂,开放臂与中心区域相对的臂不封闭)和5 cm×5 cm×16 cm的正方形中央区域的实验装置,固定于离地面50 cm的金属制十字架上。测试前1 h将小鼠从饲养间转移至测试房间适应,实验前用75%的乙醇清洁实验箱,将动物从饲养笼中轻轻取出,头朝开放臂方向置于箱子中央,摄像机记录5 min,每只动物实验结束后需用75%酒精再次清洁实验箱。使用ANY-MAZE软件分析视频数据,输出小鼠在开放臂的停留时间、运动距离和进入次数等。
1.3 免疫荧光染色
将小鼠随机分为4组:OVR组、Sham组、RS组、Ctrl组。OVR组、Sham组模型构建同1.2;RS组模型构建同1.1.2;Ctrl组将小鼠放入新笼,单独饲养,不做其他处理。2 h后将小鼠按以下步骤处理。1%戊巴比妥钠(1 mL/kg)经小鼠腹腔注射麻醉,经左心室灌流20 mL的4 ℃生理盐水后,用4%多聚甲醛灌流固定,剥离取出脑组织。将取出的脑组织放入4%多聚甲醛,并于4 ℃冰箱中固定6~8 h,30%的蔗糖溶液中脱水两次,包埋后使用冰冻切片机制备35 μm的冠状切片。配制含有10%正常驴血清、1%牛血清白蛋白、0.3% TritonX-100及1×磷酸盐缓冲液(PBS)的抗体稀释液,将切好的脑片置于含有兔抗cfos一抗(1∶2 000)(ABCAM,英国)的24孔板中,4 ℃摇床孵育过夜。孵育后PBS漂洗3次,每次10~15 min。加入驴抗兔二抗(1∶1 000)(Invitrogen,美国),室温孵育1 h,孵育后PBS漂洗3次,每次5 min。加入Hochest(1∶10 000)(Sigma,美国),复染细胞核10 min。待贴片风干后,使用含防荧光淬灭剂的封片液封片。Olympus荧光显微镜VS200(Olympus,日本)在相同的曝光时间下拍摄脑片,根据第3版小鼠脑图谱[11]利用Photoshop软件绘制脑区边界,Image J软件将获取荧光图像按照色彩通道分离,在得到的黑白图片中统计阳性细胞数。
1.4 统计学分析

2 结 果
2.1 行为学测试
2.1.1 旷场测试 OVR组小鼠在咬合升高后第7天进入旷场中央区域的次数、在中央区域的运动距离均低于Sham组(P<0.05),表明OVR组小鼠焦虑样行为显著增加,但两组间中心区域时间和总运动距离差异无统计学意义(P>0.05)(图1),表明在该时间段内咬合升高对小鼠运动能力及自发活动无明显影响。

A:中心区域时间;B:中心区域进入次数;C:中心区域运动距离;D:总运动距离;E:OVR组轨迹图;F:Sham组轨迹图;*:P<0.05,ns:P>0.05
2.1.2 高架十字迷宫测试 OVR组小鼠在咬合升高后第8天在开放臂的时间、在开放臂的运动距离均低于Sham组(P<0.05),两组间开放臂进入次数和总运动距离差异无统计学意义(P>0.05)(图2),同样表明OVR组小鼠焦虑样行为显著增加,咬合升高在该时间段对小鼠运动能力及自发活动无明显影响。
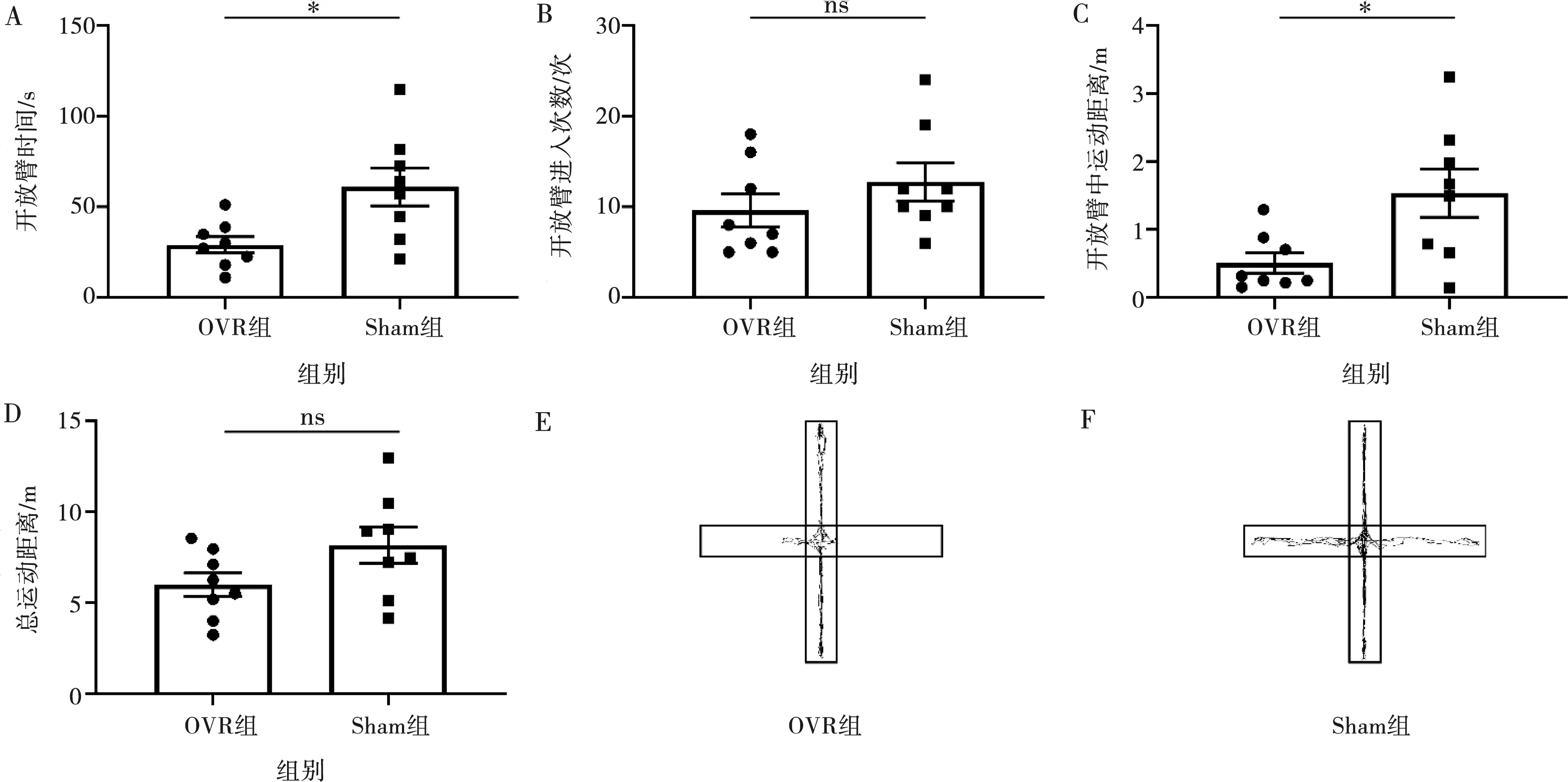
A:进入开放臂时间;B:开放臂进入次数;C:开放臂运动距离;D:总运动距离;E:OVR组轨迹图;F:Sham组轨迹图;*:P<0.05,ns:P>0.05
2.2 cfos表达变化
2.2.1 咬合升高后cfos表达变化 咬合升高2 h后,OVR组小鼠内侧前额叶(medial prefrontal cortex,mPFC)、扣带回皮层(cingulate cortex,Cg)、屏状核(claustrum,Cl)、岛叶皮层(insularcortex,INS)、伏隔核(nucleus accumbens,NAC)、外侧隔核(lateralseptal,LS),包括外侧隔核腹侧部分(LSV)和背侧部分(LSD)、下丘脑室旁核(paraventricular hypothalamic nucleus,PVN)、基底外侧杏仁核(basolateralamygdaloid nucleus,BLA)、中央杏仁核(centralamygdaloid nucleus,CeA)、外侧缰核(lateral habenula,LHb)、下丘脑背内侧核(dorsomedialhypoth-alamic nucleus,DM)、底丘脑旁核(parasubthalamic nucleus,PSTN)、臂旁核(parabrachial nucleus,PB)、孤束核(nucleus of the solitary tract,NTS)中cfos阳性细胞数较Sham组显著增加(P<0.05)(图3),提示这些脑区中神经元激活程度增加。
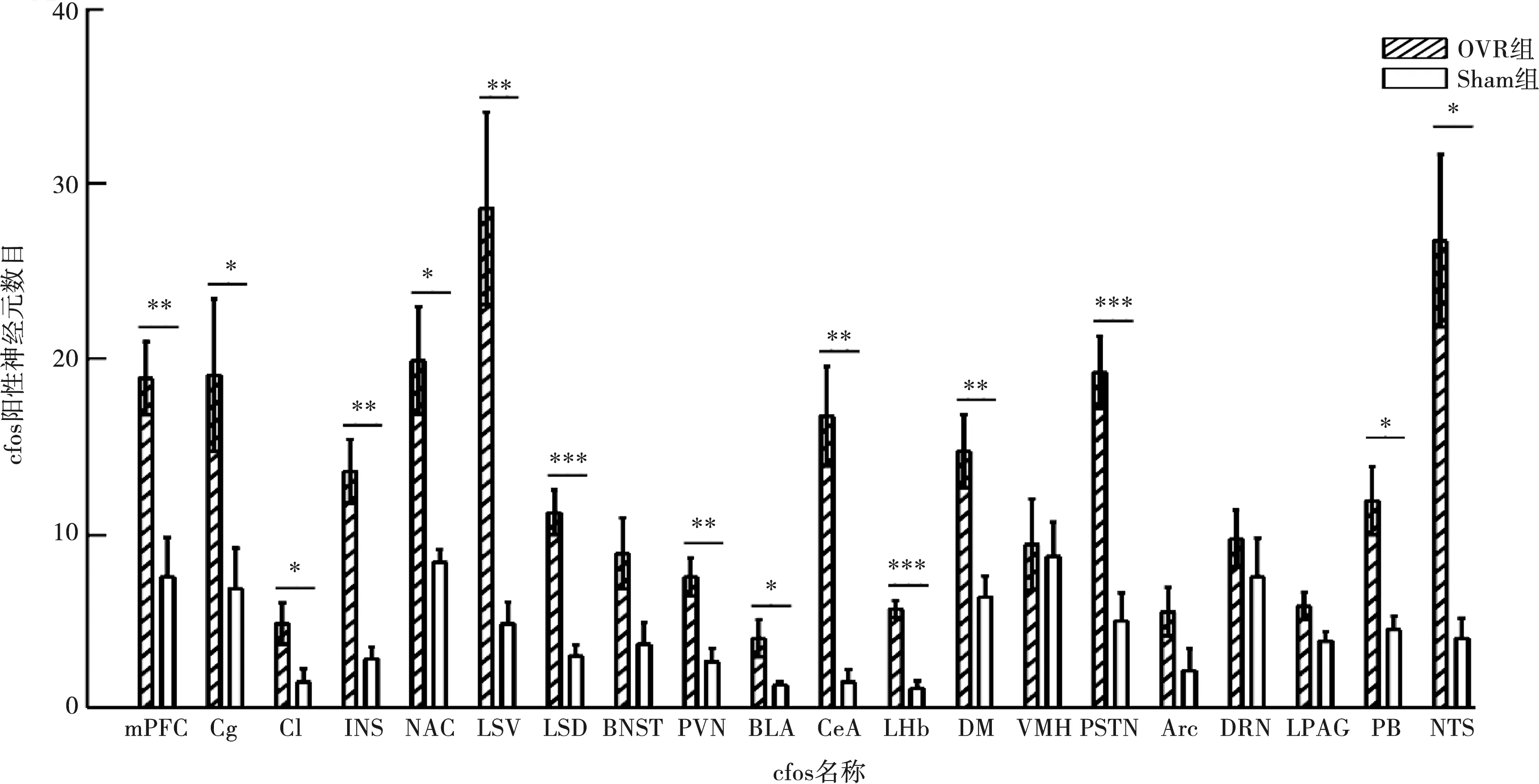
*:P<0.05,**:P<0.01,***:P<0.001
2.2.2 束缚刺激后cfos表达变化 RS组小鼠Cl、NAC、LS、PVN、弓状核(arcuatehypothalamic nucleus,Arc)、中缝背核(dorsalraphe nucleus,DRN)、NTS中cfos阳性细胞数较Ctrl组显著增加(P<0.05)(图4)。Cl、NAC、LS、PVN、NTS中cfos阳性细胞数在OVR组及RS组均显著增加,提示这些脑区中神经元在两种不同的刺激中激活程度均增加(图4、5)。

*:P<0.05,**:P<0.01,***:P<0.001

A:咬合升高后cfos表达情况;B:束缚刺激后cfos表达情况;图中为免疫荧光染色(色彩通道分离后),虚线为脑区边界
3 讨 论
本研究发现咬合改变会导致小鼠焦虑样行为增加,咬合升高后mPFC、Cg、Cl、INS、NAC、LS、PVN、BLA、CeA、LHb、DM、PSTN、PB、NTS等部位表达cfos蛋白的神经元数目增加。尚琳等[10]对小鼠进行咬合升高后发现,手术后第7、14天小鼠焦虑样行为增加,PB及CeA中神经元被激活,与本实验结果一致。但本研究观察到在急性咬合改变操作之后,全脑中还有其他被激活的神经元,这些神经元分布的部位与目前认为调控焦虑的神经环路有很多重叠[12],重叠的部位可能是咬合改变与焦虑症状联系的关键。
旷场实验是利用小鼠对明亮开放区域厌恶的天性衡量小鼠的焦虑水平,焦虑增加的小鼠更倾向于靠近边缘区域[13]。高架十字迷宫实验利用动物对新异环境的探究特性和对高悬开放臂的恐惧形成矛盾冲突行为测试动物的焦虑状态[14]。咬合改变后小鼠进入旷场中央区域的次数和在中央区域的运动距离,在高架十字迷宫开放臂的时间以及在开放臂的运动距离均显著减少,说明咬合改变可以导致小鼠的焦虑样行为增加,这与临床中咬合操作和焦虑症的关联一致[1]。
束缚刺激是常用的诱导焦虑样行为方法,研究显示急性束缚后啮齿类动物的焦虑样行为增加[15],cfos蛋白是神经元活化的标志物,其在各种刺激后短暂且快速地表达,刺激后2 h表达水平最高[16]。本实验利用束缚刺激中被激活的神经元做对照,观察该刺激中激活的神经元与咬合改变刺激中被激活神经元的重叠部分,这些在两种刺激中均显著激活的部位可能是咬合改变导致焦虑症的致病机制。急性束缚刺激2 h后Cl、NAC、LS、PVN、Arc、DRN、NTS等部位表达cfos蛋白的神经元数目增加。Cl、NAC、LS、PVN、NTS在两种刺激中表达cfos蛋白的神经元数目均显著增加。既往研究显示这些部位与焦虑样情绪的产生密切相关。Cl在机体暴露于急性应激源时激活,被认为在控制由压力引起的焦虑行为中至关重要[17];NAC是大脑奖赏和动机系统的重要组成部分,是啮齿动物焦虑行为神经环路的重要环节[18];LS虽然在某些研究中显示其输出的功能具有抗焦虑的作用,但是最近也有研究显示LS中表达Ⅱ型促肾上腺皮质激素释放因子受体(CRFR2)神经元的激活可产生持续性的焦虑,并可导致血液中的皮质醇水平增加[19];PVN是HPA轴的重要组成部分,PVN中促肾上腺皮质激素释放激素(CRH)神经元可沿HPA轴启动激素级联反应应对压力状态[20];NTS中大量表达糖皮质激素受体,该受体的功能抑制可以降低大鼠高架十字迷宫中开放臂的探索行为[21]。
大脑对咬合改变与束缚刺激这两种应激状态的反应也存在差异,咬合改变后mPFC、Cg、INS、BLA、CeA、LHb、DM、PSTN、PB显著被激活,而束缚刺激后上述脑区并未明显激活,而Arc、DRN在束缚刺激后显著激活。差异性表达的脑区提示两种刺激引起的应激反应有所差异[10,22-23]。对这些脑区的关注可能可以从其他角度理解咬合改变对机体的影响。
综上所述,本研究从神经元的活动水平初步发现咬合改变后与焦虑行为相关部位的神经元显著激活,但这些神经元的激活是否直接导致小鼠的焦虑样行为尚不明确,今后可通过神经元的功能操纵,如利用光遗传学或化学遗传学的方法进一步对其功能进行探索和验证。
