CAZy-AA3家族酶及其在生物传感器中的应用研究进展*
2022-07-25张振宇公维丽马耀宏朱思荣王丙莲韩庆晔陈彦儒
张振宇 公维丽 马耀宏 朱思荣 王丙莲 韩庆晔 陈彦儒
(齐鲁工业大学(山东省科学院)生物研究所,济南 250103)
碳水化合物活性酶数据库(CAZy,http://www.cazy.org/)概括了能够合成或者分解复杂碳水化合物和糖复合物的酶类,即糖苷水解酶(GH)、多糖裂解酶(PL)、碳水化合物酯酶(CE)、糖基转移酶(GT)及非催化活性碳水化合物结合模块(CBM)[1]。基于氨基酸序列相似性,CAZy酶类被归入不同蛋白质家族。近年来,随着研究的深入,研究者认为植物细胞壁多糖(如甲壳素、纤维素或淀粉)的高效降解不仅需要经典糖苷水解酶的水解作用,而且离不开部分氧化裂解酶的协同催化。
目前,在CAZy数据库中氧化裂解酶被独立划分为“辅助活性”(auxiliary activities,AA)酶家族,其中AA3 家族的酶具有大量不同类型的辅助活性,在医疗、环境、食品等多个领域广泛应用。基于前人研究,本文对AA3 家族酶的来源、分子结构及改造,及其部分酶在电化学生物传感器领域的应用等进行了系统的归纳、总结,以期为AA3家族酶的后续研究和应用提供参考。
1 CAZy-AA3家族酶特征及分类
AA3 家族酶属于葡萄糖-甲醇-胆碱(glucosemethanol-choline,GMC)氧化还原酶大家族,基于对114个已被表征的AA3家族酶序列系统发育分析,AA3家族被进一步细分为4个亚家族:AA3_1(包括纤维二糖脱氢酶)、AA3_2(芳醇氧化还原酶和葡萄糖1-氧化还原酶)、AA3_3(醇氧化酶)和AA3_4(吡喃糖氧化酶)(图1)。
这类酶的典型特征是具有一个黄素腺嘌呤二核苷酸(FAD)结合结构域和一个底物结合结构域[2]。部分家族成员可能包含结构上不同的环甚至额外的域(图2)。FAD 结合结构域高度保守,显示典型的Rossmann折叠或β折叠或sm单核苷酸结合基序,与FAD 的ADP 部分相互作用。但是底物结合结构域的序列和结构保守性较低,这反映了该家族作用底物的多样性。尽管这类酶的作用底物多样,但它们整体反应机制相似。底物氧化涉及从底物直接转移氢负离子到FAD 异丙嗪部分的N5原子,形成FADH2(还原半反应)。FADH2随后被O2或其他电子受体重新氧化(氧化半反应),产生H2O2或还原态金属离子(图2)。下面对每一亚家族进行了详细综述。
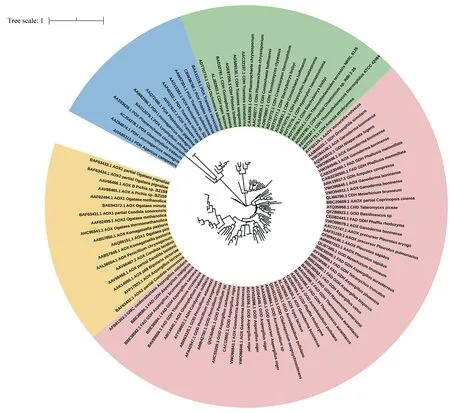
Fig.1 CAZy-AA3 family enzyme phylogenetic tree图1 CAZy-AA3家族酶系统发育树
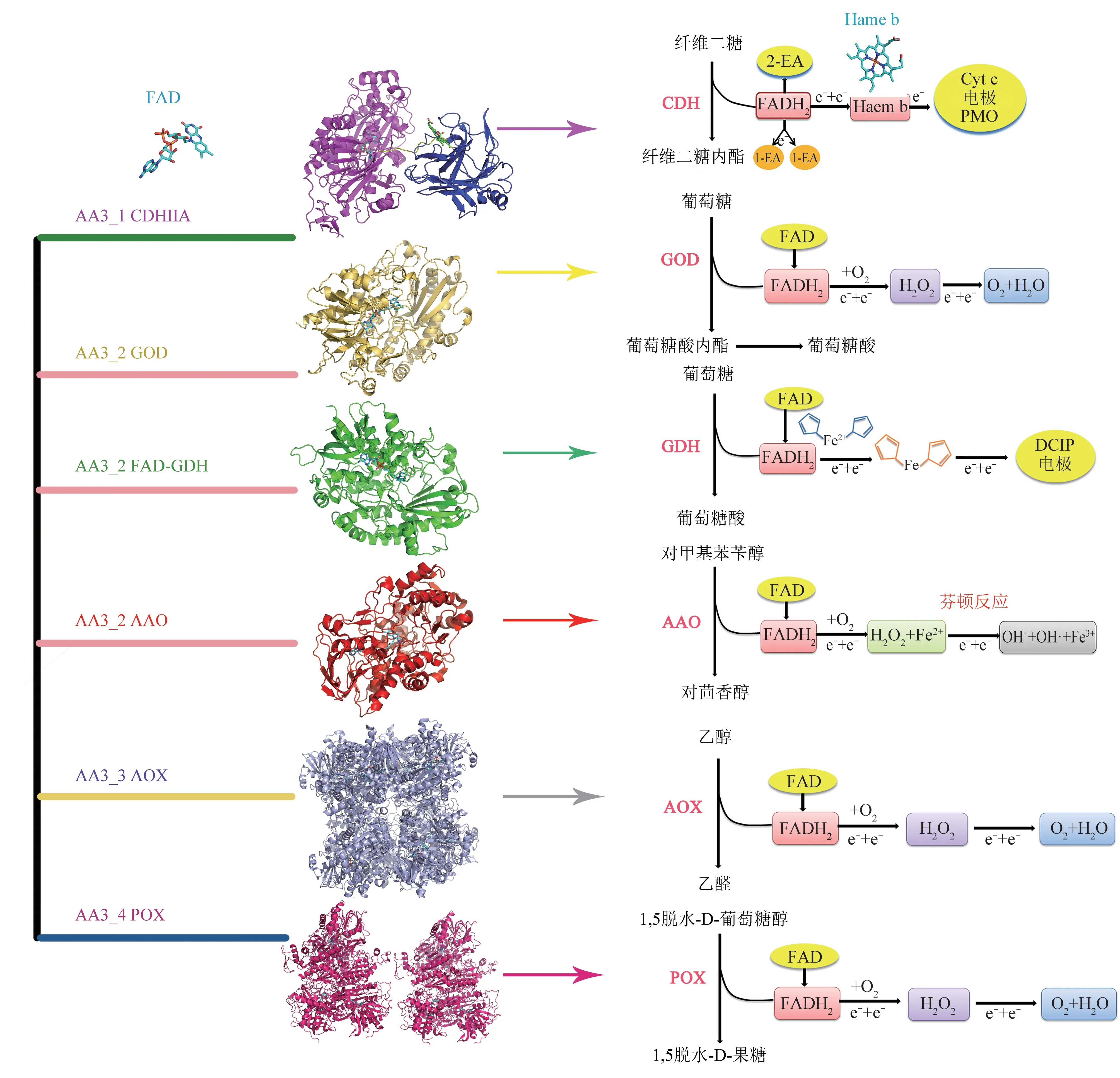
Fig.2 The structure and reaction mechanism diagram of the four subfamily enzymes of AA3图2 AA3 4个亚家族酶的结构及反应机理图
1.1 AA3_1-纤维二糖脱氢酶
1.1.1 CDH来源及分类
纤维二糖脱氢酶(CDH,EC 1.1.99.18),是由一些降解木质纤维素的丝状真菌分泌的胞外酶,也是迄今为止唯一已知的胞外血黄素蛋白[3]。CDH最早是在1974 年由Westermark 和Eriksson 从软腐菌(Sporitrichum thermophile) 残体中提取得到的[4]。目前,随着基因组测序技术的发展,CDH基因出现在许多真菌中。可产生CDH 的担子菌及子囊菌列于表1。
目前已知的CDH 基因,根据酶分子结构特征和催化特性系统发育分析可分为4大类(表1),第Ⅰ类CDH 序列只在担子菌亚门中发现,而第ⅠⅠ类、第Ⅲ类和第Ⅳ类CDH序列只在子囊菌亚门中发现。第Ⅰ类CDHs对纤维素有很强的亲和力,可通过脱氢酶结构域表面的纤维素结合位点结合。这种纤维素结合位点在其他CDH 类中不存在。在第Ⅱ类CDHs 中,与纤维素的结合取决于序列C 端是否具有CBM,根据CBM 的有无,Ⅱ类CDHs 又被分为A、B 亚类。第Ⅰ类和第Ⅱ类CDHs 的主要差异在于它们的底物特异性和直接电子转移的最适pH,而第Ⅲ类和第Ⅳ类CDHs,目前尚未得到表达和性质测定。

Table 1 CDH classification,source and characteristics表1 CDH分类、来源及特征
1.1.2 CDH分子结构及功能
CDH 是一种单体糖蛋白,其分子质量大约为100 ku,糖基化程度可达20%。CDH有两个辅基基团:细胞色素b型血红素基团和FAD基团,两个辅基基团分别存在于N 端细胞色素结构域(CYTCDH)和C 端脱氢酶(DHCDH)结构域中,其中DHCDH结构域的糖基化程度远高于CYTCDH结构域,两个基团由大约20~35 个氨基酸构成的柔性连接肽相连,因此CDH结构域具有显著的流动性,并导致CDH的结构具有开放和封闭两种构象[5]。
CDHs 氧化纤维二糖、纤维糊精或乳糖的C-1位还原端,生成相应的内酯[6]。Zamocky 等[3]发现其他半纤维素和淀粉衍生的低聚糖,如木聚糖、甘露糖或麦芽寡糖等也可被一些CDHs氧化,但催化效率较低。CDHs氧化糖的动力学常数表明,其优先选择二糖或者是稍大的低聚糖。CDH 氧化葡萄糖的Kcat值是其氧化纤维二糖的1/10,氧化葡萄糖的KM值是氧化纤维二糖的10 000 倍。对糖链长的选择特异性也是CDH 的一种功能特点,比如纤维三糖和纤维四糖比纤维二糖多了葡糖残基,CDH 对它们氧化的Kcat值与纤维二糖相比变化不大,但是KM值明显比纤维二糖的大,这种特异性可能是由糖苷键的立体结构不同导致的。
CDHs 结合纤维二糖等底物的位点位于DHCDH结构域中,靠近FAD 的异丙嗪部分,可通过12 Å长的分子隧道到达[7]。Tan 等[5]在2005 年发现,在CDH 呈现封闭式构象时这一结合位点仍可结合底物。作为还原性半反应的结果,DHCDH结构域中的两个电子随后可以转移到可同时接受两个电子的受体(例如,通常用于活性测定的2,6-二氯吲哚酚(DCⅠP))或一次仅接受一个电子的受体(例如,CYTCDH中的血红素b 基团)[8]。在上述电子传递链下游,还原态血红素b 可以依次还原终端电子受体,例如铜依赖性裂解多糖单加氧酶LPMOs[9-10],与LPMOs 协同催化结晶纤维素、半纤维素和淀粉中的糖苷键断裂[11-13]。CDH-LPMO 系统通过先前未知的机理提高纤维素结晶区的降解效率[14-15]。
1.2 AA3_2-亚家族酶
1.2.1 AA3_2-芳醇氧化酶/脱氢酶
1988 年Bourbonnais 和Paice[16]首次从不同侧耳属植物中分离到了芳香醇氧化酶(AAO;EC 1.1.3.7),AAO 是由许多木材降解真菌分泌的一种单体双结构域酶,含有非共价连接的FAD。通常催化一系列芳香族和脂肪族的不饱和醇,将伯醇基团氧化为相应的醛。
Pleurotus eryngii来 源 的PeAAO (2.55 Å,PDB 3FⅠM)是迄今为止研究最全面的AAO 酶,PeAAO 具有高催化效率,与茴香醇的反应速度可达5.23×106mol-1·L·s-1[17]。最近对朱砂绿脓杆菌(Pycnoporus cinnabarinus)组学研究显示,在降解生物质过程中它可分泌4种AA3_2酶,其中一种是葡萄糖脱氢酶,另外3 种与PeAAO 序列同源性高达44.5%~48.7%[18-19]。它们在氧化一系列芳香醇的还原半反应中表现出与其他AAO 类似的活性,例如, 催 化p-茴 香 醇 的 效 率 为 0.631×103~16.9×103mol-1·L·s-1,p-茴香醇也是这3种酶的最适底物。然而,它们对一些电子受体的反应性方面存在显著差异。其中一种酶对氧气没有任何活性,另外两种酶的氧反应活性与其他电子受体,如p-对苯醌或DCⅠP,相比也较低,脱氢酶与氧化酶活性约为50∶1[20]。因此,这些酶不是真正的氧化酶,而是脱氢酶,它们被称为芳基醇醌氧化还原酶(AAQO)。AAO和AAQO不仅参与木质素的降解,还减少了漆酶在木质素降解过程中形成的苯氧基自由基。
1.2.2 AA3_2-葡萄糖氧化酶和葡萄糖脱氢酶
在AA3_2 中发现两种不同的FAD 依赖性酶,葡萄糖1-氧化酶(GOD) 和葡萄糖1-脱氢酶(GDH),两者在系统发育上亲缘关系较为接近。但在催化底物的方式上有所不同,GOD 以O2作为最终电子受体氧化β-D-葡萄糖为D-葡糖内酯(D-葡萄糖酸-1,5-内酯),并将O2还原为H2O2,而FAD-GDH对O2的活性很低,但可利用一系列电子媒介体作为电子受体。
a.GOD来源及结构特征
GOD最早是由Muller[21]从黑曲霉和灰绿青霉的无细胞提取液中分离出来的,并将其命名为葡萄糖氧化酶(β-D-葡萄糖:氧1-氧化还原酶,EC 1.1.3.4)。GOD 是同二聚体糖蛋白,相对分子质量在147~180 ku 之间,这取决于其糖基化程度。每个单体在距酶表面~15 Å处深埋FAD或FADH2辅因子。FAD 与GOD 以非共价键进行牢固紧密结合。两个亚基之间由疏水作用力、盐桥和氢键进行连接。底物进入活性中心的口袋孔径约为10 Å×10 Å,足够容纳葡萄糖。GOD 整个酶分子大小约为60 Å×52 Å×77 Å,等电点在4.3左右[22]。
真菌表达的GOD,在催化葡萄糖的过程中,葡萄糖与周围氨基酸形成12 个氢键,与邻近FAD的芳香族残基形成3个疏水键,从而稳定结合葡萄糖。在FAD 结构末端将氧化葡萄糖产生的电子传递给氧,最终生成H2O2。由于H2O2能氧化GOD关键的蛋氨酸残基而使酶失活,因此GOD 主要的抑制剂也是H2O2[23]。同时,伴随着D-葡萄糖内酯分解成葡萄糖酸导致外界pH 的降低,也抑制了酶的活性[24]。GOD的最大优势和特征是它对β-葡萄糖的高特异性。虽然GOD也可以氧化其他种类的糖,如半乳糖、甘露糖等,但反应速度较慢[25]。
GOD的来源广泛,目前已知的主要包括红藻、柑橘类水果、细菌、昆虫、植物、动物和真菌等(表2)。其中细菌和真菌具有产酶量高和使用各种碳源的能力,通常被认为是工业化生产GOD 的首选。但在细菌,如大肠杆菌中进行表达生产,常常形成无活性GOD 的包涵体,并且在体外以较低的产率溶解,即使经复性后与天然酶性质相似,但有活性的非糖基化酶依旧无法满足高效表达的目的。由真菌自然产生的GOD 会产生一种糖基化程度超过10%的胞外酶。在酿酒酵母(Saccharomyces cereνisiae)和多形性汉逊酵母(Hansenula polya)中重组表达GOD 往往会导致高糖基化,并伴随酶活性的降低[26]。目前常用甲醇营养酵母Pichia basoris进行目的蛋白的高效诱导表达,并被证明是表达GOD 的有效宿主,虽然它产生了大量中等程度的高糖基化酶,其性质与天然酶略有不同,但仍然可以通过后期去糖基化等操作进一步提高GOD的活性。
b.FAD-GDH来源及结构特征
FAD-GDH在系统发育和结构上与GOD有着密切的关系,因此显示出与GOD 相同或相似的结构域和保守的催化残基。由于FAD-GDH 与GOD 共享大部分活性位点,因此对葡萄糖具有较高的底物特异性。
根据已报道的FAD-GDH 来源可分为3 大类:细菌中的bFAD-GDHs、真菌中的fFAD-GDHs和来自昆虫的FAD-GDHs。FAD-GDHs最早的来源报告中称:在曲霉亚种中存在一种能够利用某些电子受体但不能利用氧气氧化葡萄糖的酶[27-39]。通过对米曲霉来源的GDH进行表征,鉴定了它是FAD依赖型的GDH[30]。利用GOD 活性位点序列基序对真菌基因组数据库进行筛选,发现它们位于不同的系统发育分支。通过对GOD 活性位点与fFADGDH 活性位点结构模型的比较表明,两者与葡萄糖的5个羟基中每一个相互作用的相关残基基本一致,从而阻止葡萄糖的同分异构体在活性位点结合[31]。与GOD 对葡萄糖高底物专一性不同的是,fFAD-GDH 对D-木糖(XYL)也显示出显著的活性。通过对蛋白质结构的分析,fFAD-GDH对葡萄糖识别位点高度保守,fFAD-GDH识别葡萄糖的残基与GOD 识别葡萄糖的残基之间没有显著差异。通过对甲壳类的fFAD-GDHs研究报道发现[32],其催化结构中发现了一个独特的空腔,该空腔可能是fFAD-GDH与GOD底物特异性差异的关键。然而,fFAD-GDH 缺乏D-葡萄糖酸-1,5-内酯(D-glucono-1,5-lactone,LGC)/葡萄糖第六羟基附近的残基。由于没有识别葡萄糖第六羟基的残基,并且在活性部位存在一个显著的空腔,这可能是其对木糖具有活性的原因。
bFAD-GDH 通过电子转移亚基促进了催化亚基辅因子和人工电子介体之间的电子转移,使该酶具有与PQQ-GDH 相似甚至更高的催化活性。其FAD 的主要电子受体为3Fe-4S 簇,这一部分参与电子从FAD 到电子转移亚基的分子内和分子间转移过程。与fFAD-GDH 结构类似,bFAD-GDH 活性位点有一个很大的空腔支持其识别麦芽糖作为底物[35]。因此,bFAD-GDH 具有相对广泛的底物特异性,可以催化麦芽糖等双糖,生成相应的内酯。对催化亚基活性位点的蛋白质工程研究已经成功地特异性消除了酶对双糖的活性,从而使其本质上成为对葡萄糖专一的酶。

Table 2 Main sources and characteristics of GOD and GDH表2 GOD及GDH主要来源及特征
1.3 AA3_3-醇氧化酶
醇氧化酶(AOX)最早是由Jassen 等[36]于1965年在担子菌Spongipellis unicolor子实体培养物中发现。它是第一种被发现的与甲醇酵母甲醇氧化途径相关的酶类,它们以氧分子作为电子受体,把小分子、低质量的醇类,如甲醇、乙醇、丙醇等短链醇,氧化成相应醛类。
AOX 是甲醇营养型酵母(毕赤酵母、假丝酵母、汉逊酵母)的关键酶,它位于这些酵母的过氧化物酶体中,可占这些生物体细胞总蛋白质的30%[37]。2016 年,来 自Pichia pastoris的AOX(PpAOX)的结构已通过晶体学和X射线衍射以及冷冻电子显微镜解析出[38-39]。PpAOX 是一种同八聚体蛋白,每个亚基携带一个非共价连接的FAD,该FAD 的异咯嗪部分可以通过自催化反应修饰阿拉伯酰基,这与通常的核糖醇基修饰是完全不同的。研究者认为,这种FAD 修饰主要通过降低与甲醇的KM值来提高对醇类底物的催化活性,并且FAD的修饰程度与菌体生长环境中甲醇浓度(5%~95%)呈负相关。
与酵母中的AOX 相比,来自担子菌或植物病原真菌中的AOX 研究较少。 从褐腐真菌Gleophyllum trabeum(GtAOx)的培养物中分离出的胞外AOX与其他酵母和真菌来源的AOX(包括PpAOX)显示出50%~53%的序列同源性[40]。其C端与酵母AOX 明显不同,也不含典型的N 端真菌信号序列,但免疫荧光和TEM免疫标记研究表明,GtAOX 是胞外定位的。甲醇是GtAOX 的首选底物,其 催 化 效 率 约 为6.78×103mol-1·L·s-1,与PpAOX相似。由于不同来源AOX结构的差距,导致其在功能上表现出不同的作用。来自酵母菌的AOX 主要在甲醇代谢和同化中起作用,而来自于其他真菌中的AOX,则被认为是为真菌攻击木质纤维素提供H2O2。
1.4 AA3_4-吡喃糖氧化酶
吡喃糖氧化酶(POX,EC 1.1.3.10)是与AA3家族成员亲缘关系最远的一类,不具有AA3 家族典型的高度保守基序,因此被归入GMC 家族最晚[41]。POX 在白腐真菌中广泛存在,特别是多孔菌目[42]。该酶最初从担子菌中分离和表征,后来又在许多其他木腐真菌、 部分放线菌(Arthrobacter siccitolerans)中分离出来。晶体结构表明,POX 是AA3 家族中结构特征最多样化的一类,与AA3 家族其他成员不同,大部分POX 是同四聚体蛋白,有些POX 是被糖基化的(图1)[43]。每个双结构域亚基都包含一个与亚基的His残基共价连接的FAD 辅酶活性位点。底物进入FAD 活性位点受到高流动性无规则卷曲形成的环形区的限制,从而限制了酶仅对单糖的催化。此外,底物只有通过由4个亚基形成的内部空腔隧道才能进入催化活性位点,每个亚基都带有一个功能未知的延伸“头部结构域”。其功能可能参与亚基聚合或与细胞壁多糖或其他蛋白质的相互作用[44]。
POX 首选底物为D-葡萄糖,但与GOD 相比(GOD 的活性仅限于α-D-葡萄糖),POX 既可以利用α-D-葡萄糖,又可利用β-D-葡萄糖。除了其最适底物D-葡萄糖以外,D-半乳糖、D-木糖、L-山梨糖、D-葡糖酸-1,5-内酯等单糖的C-2位也能被其氧化,生成相应的2-酮糖,同时将O2还原成对POX 的研究表明,它是以乒乓机制催化反应,整个反应分为还原性半反应和氧化性半反应两部分。在还原性半反应中,β-D-葡萄糖C-2位被氧化,生成2-酮-D-葡萄糖,FAD 辅基被还原为FADH2,底物酮糖被释放。在氧化性半反应中,O2被还原为H2O2,同时黄素辅基回到氧化态。与GOD 相比,在木质素降解过程中,POX 才是H2O2的主要来源,目前认为,POX 主要是作为白腐真菌木质素降解体系的一个组分,为过氧化物酶提供H2O2。
A组:静脉注射5000U肝素,瑞替普酶100 mg在90 min内静脉给予:先静脉注入15 mg,继而30 min内静脉滴注50 mg,其后60 min内再滴注35 mg。之后静脉持续每小时滴注700~1000U肝素,滴注时间48h;之后改为每12h皮下注射7500U肝素;连用2~5 d。B组:将150万U尿激酶溶解于5%,100ml葡萄糖中静脉滴注,滴注时间为30min;对患者ACT进行检查,恢复至正常对照的1.5~2倍后,静脉持续滴注肝素48h,之后改为每12h皮下注射7500U肝素;连用2~5 d。
2 CAZy-AA3家族酶在传感器中应用
氧化还原酶在催化底物的反应中涉及电子转移,因此可以将其固定到传感器电极表面把化学信号转换为电信号,实现对底物的快速检测。随着新鉴定以及分子改造的氧化还原酶作为底物识别元件,结合新的高效酶固定化纳米导电材料的发展,氧化还原酶与电极之间电子传递效率不断提高,传感器的检测限逐渐降低至fmol/L 浓度,灵敏度、特异性和稳定性也大大提高。根据氧化还原酶与电极之间电子传递方式的不同,酶生物传感器的发展主要划分为3个阶段。
第一代酶传感器称为无介质安培型生物传感器,它以自然物质如氧气作为酶与电极之间的电子通道,通过氧电极或过氧化氢电极测量氧的消耗或过氧化氢的产生来测定底物。这种传感器的优点是制作简单、无人工介体。但由于是间接测定,检测时受溶解氧波动的影响较大,响应时间较长,易受试样中共存的氧化还原性电活性物质干扰,导致传感器的灵敏度和抗干扰能力相对较差。为克服以上问题,自20世纪70年代起,人们开始用小分子电子媒介体代替氧,通过检测媒介体电流来测定底物浓度。因此,第二代酶传感器又被称为介体安培型生物传感器。与第一代相比其检测灵敏度、实用性明显提高。随着纳米技术的发展,研究者将纳米技术与生物传感器结合,设计出了灵敏度更强、化学稳定性更高、生物相容性更好的第三代酶生物传感器-纳米生物传感器。由于第三代酶传感器缩短了酶与电极之间的传递距离,使酶和电极之间实现直接电子传递(DET),因此,这类传感器的电子转移效率更高,受到的干扰更少,准确性更高,应用前景更可观。
而AA3 家族酶作为一类重要的氧化还原酶,由于其高效的表达量,高度稳定的催化能力,多样的作用底物,被广泛的应用于酶传感器中,特别是对葡萄糖、乳糖、乙醇的检测成为应用热点。
2.1 葡萄糖生物传感器
葡萄糖的定量测定在食品工业、临床医学、生化分析等领域都具有重要意义。葡萄糖传感器是生物传感器领域中研究最多、商品化最早的生物传感器。葡萄糖传感器的发展历史与葡萄糖传感所用酶的发现和工程的历史是密切相关的,因此,在数十年的发展中随着葡萄糖传感器检测用酶的设计改造及固定化材料的改进,葡萄糖传感器的检测性能得到巨大提升。
GOD 是最早应用于葡萄糖生物传感器中的一类酶,自第一支葡萄糖氧化酶传感器问世以来就被应用于葡萄糖的检测。然而,利用氧作为电子受体的第一代传感器主要面临着如下几个问题:a.需氧的反应条件造成酶电极电信号与溶解氧的关系很大,极易引起信号的波动,难以对高含量的葡萄糖进行测定;b.过高的检测电位(氧电位)使其他电活性物质容易产生信号干扰;c. 氧化还原产物H2O2浓度过高会使GOD 失去活性等。这些问题大多归因于GOD 自身的结构性质或者是反应机理。通过对GOD蛋白结构的解析,基于基因工程改造,改变活性中心的电子传递方向来改善GOD 对氧的依赖性及其反应过程中电子转移效率,实现对GOD 在电化学上的应用进行重新设计,成为发展第二代、第三代葡萄糖氧化酶传感器的主要研究内容(图3)。Klinman 等[46]利用突变技术用氯化物取代天然黄素中7和8位甲基,对黑曲霉(A.niger)来源的GOD 进行了改造并对其在氧化过程中的O2效应反应进行了监测(图3 中a1),发现改造后GOD 的KM比天然的高25 倍。为了进一步降低GOD 对O2的竞争效应,Tremey 等[47]使用了这种黄素类似物制作了GOD 生物电极,并通过将新的类似物嵌入到锇导电聚合物中制备修饰电极,结果表明,改造后的GOD 对O2的灵敏度降低了90%,当葡萄糖浓度<10 mmol/L时,在几乎不受O2浓度影响的情况下,FADCL2-GOD 电极的电流密度比天然酶高,电子转移率提高了1.3 倍,有效避免了GOD对氧气的过度依赖。Sode等[48]在确定了参与氧化半反应中与O2相互作用的关键氨基酸后,将参与氧化半反应的Ser96 残基进行突变,降低了GOD 对O2的敏感性。但这项工作中也指出,这种突变也将影响还原半反应,并在一定程度上降低了GOD 的活性。Tremey 等[49]在分析了尼崎青霉菌的X 射线结构后,从黄素中发现了类似的缬氨酸,它们为O2激活提供了正电荷。在含铁乙醇的均相溶液中进行筛选,得到了以极性丝氨酸S取代非极性氨基酸Ⅴ时降低O2敏感性的最佳突变体;动力学分析表明,与天然GOD 相比,该突变体只影响氧化半反应,而未影响还原半反应(图3 中a2)。他们用新的突变体和锇氧化还原水凝胶制备了修饰电极。在2 mmol/L葡萄糖和1 atm O2条件下,突变电极的电流密度比用天然酶制成的电极高27%。由于产生的H2O2数量有限,改性电极比天然GOD 电极稳定4.7 倍。然而,25%的电子仍然丢失给了氧化还原介质。为了进一步完善系统,他们将该突变与活性位点入口袋(蓝色)附近的K424E 突变结合(图3 中a2)。双突变体K424E-Ⅴ464S 在整个葡萄糖浓度范围内不依赖于氧气。该突变体结合增强了电子转移,因为在活性位点口袋的入口处有带负电荷的谷氨酸,而在FAD附近有一个极性丝氨酸,使O2的影响最小化[49]。由于天然GOD的活性中心深埋在蛋白质外壳内,通过对蛋白质活性中心的表面入口处进行定点突变不仅能降低酶活性降低的风险,还能改善对氧的极性作用,电子直接转移到电极表面,降低对氧的结合。
制约第三代GOD 传感器发展及应用的另一个因素是如何缩减活性中心处产生的电子转移到电极界面的距离,提高GOD 和电极表面之间的电子转移率。研究表明,酶与电极之间的距离每减少0.8 Å,电子转移速率将提高2.71 倍[50]。虽然在电极制作过程中对固定的蛋白质进行去糖基化处理,也能有效缩减活性中心到电极界面的距离,增强电子转移速率。但从酶分子表达的源头缩短酶的氧化还原中心与电极表面的距离是提高电子转移速率最直接、最简单的办法。据GOD蛋白结构推测,从GOD的氧化还原位点到酶表面最短的电子转移路径存在于靠近C端的577位的天冬酰胺(Asn577)处,因此,Demin等[51]在GOD 的C 端添加了一个His6序列,并将表达的蛋白质有效且定向固定在含次氮基三乙酸修饰的玻碳电极表面,使酶最大限度的保持最佳催化效率(图3中b1)。在无氧条件下测量发现,电子转移率高达350 s-1,比无酶的FAD快两个数量级;在含O2干扰的条件下,电子转移率降低至160 s-1,这可能仍与氧与活性中心的His相互作用有关。为了获得更高的电子传递速率,进而引入了氧化还原介质(金纳米颗粒、锇导电聚合物)。Xiao等[52]报道了重组FAD 功能化的黑曲霉GOD 在1.4 nm AuNP中的电极表面催化反应,这是首次使每个GOD特异性固定一个AuNP的例子(图3中b2)。该生物传感器的电子转移速率为5 000 s-1,是原生酶与O2反应的7倍,也是迄今为止文献报道的最高比率。Holland等[53]在此基础上,使用了早期开发的催化性能优于天然酶的双突变体GOD(T56Ⅴ/T132S),将其活性位点附近一个游离的半胱氨酸(C521)突变为缬氨酸,防止不必要的AuNPs 附着,并在活性中心约13.8 Å ~28.5 Å 处的5 个位置分别引入突变的Cys残基。结果显示,其中FAD与Cys 之间距离最短的突变体(H447C)具有最大DET 潜力(图3 中b2)。Suraniti 等[54]使用锇导电聚合物作为GOD 氧化还原介质研究发现,在锇基氧化还原聚合物中固定化的GOD比GOD在均相溶液中的动力学要差,其氧化电流降低了35%。他们将这种差异归因于GOD 入口周围缺乏带负电荷的氨基酸。通过对入口处的K424、Q75、Q184 和G423 突变为E 或D,发现所有突变体在均相溶液中都表现出相同的活性。但在氩气(Ar)条件下,K424E 突变体电极的氧化电流比天然酶增加了2.4倍,在O2条件下增加了1.4倍。通过在活性位点入口附近引入负电荷,能增加正电荷锇和酶之间的相互作用(图3 中b3)。这些结果表明,通过重新设计酶的入口,可以使GOD 与氧化还原介体更好的进行相互作用,从而提高电子转移的速度。
fFAD-GDH 由于对O2和麦芽糖不敏感,因此被认为是用于葡萄糖生物传感器的最佳候选酶类。它作为第二代酶传感器的主要传感元件,电子介体的选择尤为重要,氯化六氨合钌(Ⅲ)具有较低的氧化还原电位和较高的贮存稳定性,是一种非常理想的酶介质。然而,与GOD 相比,fFAD-GDH 不能利用六铵合钌(Ⅲ)作为电子受体[55]。Okurita等[56]在比较FAD-GDH和GOD结构的基础上,构建了一个能够利用六铵合钌(Ⅲ)作为电子受体的黄曲霉来源的突变体——AfGDH-H403D,在通向FAD 辅助因子的通路入口处引入一个带负电荷的谷氨酸残基,吸引带正电的六氨合钌(Ⅲ),并引导电子受体进入通路(图3中c1)。而野生型GOD中相应的氨基酸是带负电荷的,这解释了GOD 可以利用六氨合钌(Ⅲ)作为电子受体的原因。电化学测量结果显示,AfGDH-H403D和六氨合钌(Ⅲ)对10 mmol/L 葡萄糖的响应电流为46.0 μA,与野生型AfGDH 和铁氰化物(47.8 μA)的响应电流类似。因此,AfGDH-H403D适合于以六氨合钌(Ⅲ)为介质构建的酶电极。利用这种改造的fFAD-GDH可加快血糖监测传感器的发展,提高监测准确性。
发展第二代、第三代葡萄糖传感器的另外研究内容是通过对葡萄糖脱氢酶、纤维二糖脱氢酶等可以氧化葡萄糖的酶进行分子改造,实现葡萄糖的高效检测[57-59]。构建DET 型fFAD-GDHs 最先进和最具挑战性的方法是构建一种融合fFAD-GDH 和CYTCDH结构域的融合蛋白(图3 中c2)。Ⅰto 等[60]报道了利用PcCDH 和AfGDH 构建细胞色素b 融合蛋白。PcCDH 是一种已知的具有DET 功能的单分子酶,根据结构预测,PcCDH 的血红素b 结构域在AfGDH 的N 端融合。由于PcCDH 的血红素b 结构域可能存在于AfGDH 的FAD 附近,因此,FAD和血红素之间可以实现分子内电子转移,从而实现DET。实验结果表明,细胞色素b融合的AfGDH表现出分子内电子转移和DET 能力,且保持原始底物特异性。pH 值的降低和二价阳离子的存在改善了分子内电子转移,但远不如CDH 自身的分子内转移。此外,CDH可将细胞色素b作为“内置”氧化还原介质,在FAD 和外部电子受体之间传递电子,因此产生了利用CDH 来直接检测葡萄糖的新想法(图3 中d)。嗜热型纤维二糖脱氢酶(CtCDH)在底物结合域通过半胱氨酸与酪氨酸交换,提高了对葡萄糖的催化能力,使葡萄糖检测灵敏度提高了10倍[61]。

Fig.3 Glucose biosensor development map图3 葡萄糖生物传感器发展历程图
基于第一代酶传感器原理,本实验室自主研发的SBA 系列生物传感分析仪于1989 年开始应用,是目前中国唯一的商品化工业酶电极分析系统,在食品发酵、生物医药和科研教学等领域已广泛应用[62]。为克服传统酶分子传感元件随机固定导致酶传感器稳定性不高、均质性差异大的问题,促进原有葡萄糖生物传感器升级换代和新型传感器研制,最近,本实验室采用生物信息学、分子生物学等生物技术,定向设计和高效表达带有CBM 亲和肽的融合酶(GOD-NL-CBM2,GDH-NL-CBM2)分子,实现酶分子传感元件在电极表面有利空间取向可控固定,使葡萄糖传感器的传感性能(灵敏度、检测限、稳定性、重现性)显著提高。在此基础上,建立融合酶传感元件标准化操作工艺和质量控制体系,使传感器件具有良好均质性、高效和稳定的酶化学和电化学(换能器)催化活性,可有望实现新型融合酶生物传感器的商品化应用[63-64]。
2.2 乳糖生物传感器
乳糖是牛奶中的主要碳水化合物,浓度为4%~5%(w/ν),母乳中约为8%,在人类饮食中占有重要作用。然而许多人对乳糖具有不耐受症,因此食品中乳糖含量的精准控制至关重要。在过去几十年中,几种用于乳糖测定的酶生物传感器已经得到了开发。其中,CDH 可以特异催化乳糖,并且可以将催化乳糖产生的电子直接转移到电极上。因此,CDH成为开发第三代乳糖生物传感器的重要酶类。
为了增强CDH 与电极间直接电子传递效率,促进第三代乳糖传感器的发展,人们利用新的电极材料、纳米材料(单/多壁碳纳米管、金纳米粒子、石墨烯)和化学修饰电极表面,以增加CDH 结合的有效表面积,或者通过控制CDH 在表面上的适当取向来增加电流密度、提高DET 速率。CDH 的糖基化程度约为9%~16%,与GOD 类似。基于前期研究,研究者将来源于黄孢原毛平革菌(Pc)和白腐菌(Cs)中的CDH,经甘露糖苷酶和糖苷内切酶处理后,获得去糖基化酶[65]。在底物存在时,用去糖基化PcCDH和CsCDH修饰的石墨电极的最大电流比用相应糖基化CDH 修饰的电极高40%~65%,并提高了酶对乳糖的专一性,这可能归因于去糖基化促使电极表面电活性CDH 分子数量的增加,并使酶的尺寸缩小,从而促进直接电子传递(图4 中a1,a2)。此外,电极和蛋白质表面(负责DET的部分表面)之间的静电兼容性对建立高效DET 通道起着关键作用,氧化还原酶/电极界面的极性极大地影响酶分子在电极上的吸附和取向,有时不促进DET 过程,甚至阻碍酶的吸附。针对这一问题,研究者已经深入研究了酶-酶和酶-界面的相互作用,发现小的多价阳离子,例如,Mg2+或Ca2+,可以促进带负电荷的蛋白质和电极之间DET的能力[66-68]。这可以归因于Ca2+在DHCDH和CYTCDH的界面上被天冬氨酸和谷氨酸的羧基络合,从而导致两个结构域更紧密的相互作用和更高的DET速率(图4中b1,b2)。
随着基因工程的发展,优化DET 速率或解决DET 问题最常用的方法之一是通过定点突变来定向固定氧化还原酶。例如,Ma 等[69-70]将单个Cys残基引入到嗜热肉豆蔻球菌纤维二糖脱氢酶(MtCDH)的DHCDH表面,不同变体的Cys 残基能够以不同的取向与多壁碳纳米管电极表面的修饰马来酰亚胺基团共价偶联(图4中c1~4)。DHCDH直接面对电极的取向是很困难的,因为CYT 也在底物通道上以闭合构象与DH相互作用,接受催化FAD辅因子的电子。因此,研究者选择了靠近蛋白质界面但不干扰结构域相互作用的残基E501(图4 中c1);另外,底物通道右侧引入一个突变E653C(图4中c2)。逆定向是通过突变T680C DHCDH底部实现的,以获得CYT 血红素辅助因子与电极之间的最远距离(图4中c3)。CDH碳水化合物结合模块(CBM)上的突变D792C是CDH在纤维素上的自然取向,在电极上以顶部定向共价固定(图4中c4)。研究表明,与非定向固定相比,这种固定方法使固定在电极上的电接触(活性)酶量增加了4~5 倍。在30 mmol/L Ca2+存在下,DET 速率均有所增加,其中,E501C 和D792C 的电流分别增加了14.4倍和4.8倍;由于D792C中CYT距离电极表面最远,因此电子传递速率最低。但血红素b辅因子的氧化还原电位不受酶取向的影响。
2.3 乙醇生物传感器
在医疗、化工、交通等多个领域都需要对乙醇进行高灵敏度、高选择性和高准确度的定量检测。目前,常用的检测乙醇浓度的方法有气相色谱法、分光光度法和呼气法[71-72]等。虽然其中一些方法精确可靠,但它们复杂且耗时,利用酶传感器法可以克服这些缺点。迄今为止,几乎所有基于AOX的乙醇传感器都是基于对O2消耗或H2O2生成进行监测(表3)。
Clark 电极是最常见的O2监测电极,它由一个铂电极和一个参比电极(通常是Ag/AgCl)组成,该参比电极浸入电解液中,并被一个半透膜覆盖,O2通过该半透膜扩散。当铂电极上施加相对于Ag/AgCl 的-600 mⅤ电位时,O2减少,并产生与O2浓度成正比的电流。基于氧气检测的乙醇传感器具有不受其他样品化学成分干扰的优点,但存在背景信号高、精密度低和重复性差等问题。基于以上一些缺点,H2O2的检测是克服这些缺点最常用的替代方法。
1974 年,Giubault 和Lubrano[73]描述了AOX基于H2O2检测的第一个乙醇安培传感器。该传感器是由来自于担子菌的可溶性AOX 构成,基于在铂电极上的酶促反应过程,并且发生在相对于Ag/AgCl的+600 mⅤ的高电位上。在这项开创性工作之后,许多乙醇传感器都是基于H2O2检测,与其他类型的传感器相比,H2O2传感器具有较低的检测线和较宽的线性范围,制作方便等优点。目前市场上乙醇传感器多基于H2O2的检测。
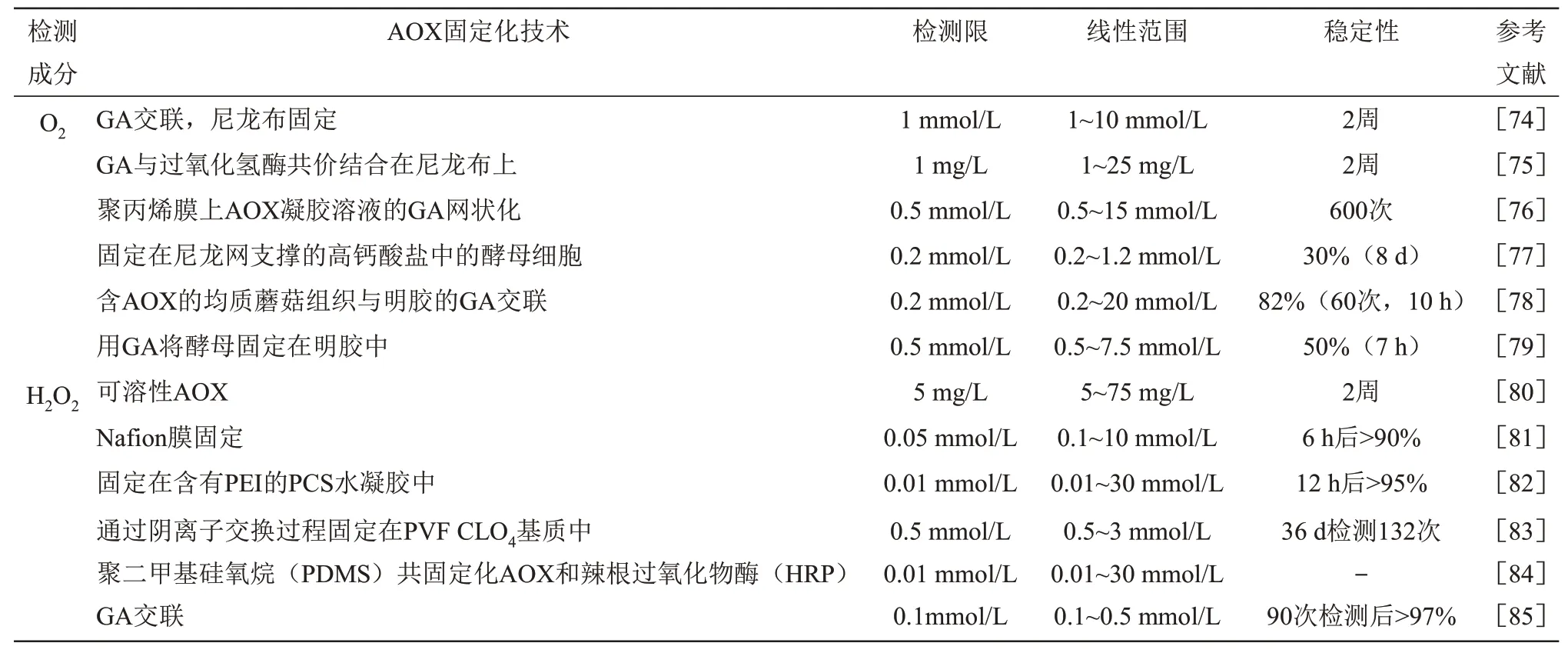
Table 3 Electrode performance based on O2 and H2O2 detection表3 基于O2和H2O2检测的电极性能
2.4 AA3家族其他酶应用前景
AAO 氧化催化系列芳香族和一些脂肪族的含共轭伯羟基的多不饱和醇。由于AAO 催化底物范围广和它的立体选择性机制,使这类酶作为工业生物催化剂具有良好的性能,目前在染料脱色、纸浆漂白、香料合成、仲醇除乙酰化和糠醛氧化、生物聚合物前体合成等多个方面都有应用,而作为生物传感器敏感元件的研究尚未见报道[86]。目前AAO的使用能力主要受限于异源表达水平不高,为此多项研究集中于探索建立AAO 的异源表达体系(宿主菌、表达载体、信号肽类型、启动子类型)或通过定点突变技术提高AAO 催化活性、稳定性等性能[87-89]。随着研究的深入,不同来源AAO 的结构和生化性质正在逐步被揭示,这对理解AAO 的结构-功能关系并促进其产业化应用具有重要意义。
基于对吡喃糖的催化特异性,POX 已被应用于葡萄糖、半乳糖、木糖等碳水化合物的传感检测。Lidén 等[90]首次将来自黄孢原毛平革菌的PcPOX 与HRP 共固定在碳糊电极(CPE)上,该双酶传感器可同时检测H2O2和葡萄糖,对葡萄糖(840 nA,30.2 μA·cm-2·mmol-1·L)、木糖(80 nA)、半乳糖(36 nA)均有良好反应。此后,基于POX的生物传感器主要用于食品和饮料的分析和各种食品发酵过程的监测。2008 年,Odaci 等[91]将来自于革盖菌属的CsPOX 固定在CPE 上,用于红酒样品中葡萄糖含量的检测。然而,与标准DNS 法相比,由于酶的特异性低,它能够有效地氧化除葡萄糖以外的几种糖类,因此这可能会损害其在选择性葡萄糖监测中的使用,测得的葡萄糖含量值有些低(差别最大可达7%)。此外,研究人员还将CsPOX固定于金电极上制备生物传感器并用于酿酒酵母在生物反应器中的培养过程监测,分析结果与以高效液相色谱法为参考的葡萄糖含量测定结果具有良好的相关性。但该生物传感器的稳定性不高,当存储在缓冲溶液一个月后,活性损失至初始活性的72%[92]。随后进一步的研究报告了构建基于CsPOX 的生物传感器,这些传感器利用CsPOX 自身的优势,既可氧化α 型葡萄糖,又可氧化β型葡萄糖,通过在电极表面电沉积金属纳米粒子,用于分析几种饮料中的葡萄糖,如软饮料、冰茶、能量饮料、牛奶和果汁,所有这些传感器与参考方法相比都取得了良好的结果[93]。
由于POX 广泛的底物特异性,其应用范围正在逐步扩大,研究也逐渐向新型POX 的发现、理想型酶突变体的改造以及在电极上的有效固定化等方面深入。随着人们对利用基于POX 的设备检测各种生物分子的兴趣不断增长,以POX 作为生物敏感元件的传感器有望为食品和饮料行业、疾病诊断、生物过程监测和环境污染物筛选等领域创造巨大的应用价值。
3 展 望
近几十年来,CAZy-AA3家族酶作为生物电化学传感器的识别元件一直发挥着重要作用。生物传感器是化学、生物化学和物理学的交叉领域,酶作为传感器的核心元件,其自身性能决定了生物传感器的性能和应用范围。目前,具有高灵敏度和高选择性的电化学生物传感器在临床、制药、环境和工业等多个领域显示出巨大的应用潜力。但是天然酶本身具有不稳定性和易变性等缺点,并且测定其性质通常在均匀溶液中,底物、氧化还原介质和酶都是游离的,没有浓度分布差异且氧化还原介质、底物将通过最佳接触点接近酶。而当酶被固定在电极表面应用时,酶的部分构象会改变,并且可能会出现浓度梯度,从而改变其对底物和/或氧化还原介质的反应性、稳定性、对其他化学物质的耐受性等许多性质。因此到目前为止,很难找到一种天然酶能满足构建理想生物传感器所需的全部特性(高灵敏度、高选择性、高稳定性),也没有建立一种通用的工程方法来有效固定氧化还原酶以改进其电化学应用。
当前,蛋白质工程已经在设计具有特定功能特性的氧化还原酶方面发挥了重要作用。国内外已有很多优秀的专家学者针对传感器用酶,进行特定的基因工程改造,利用蛋白质工程学帮助研究人员按其需要量身定制特定的生物酶应用到生物传感器中,通过模仿自然进化过程,结合不同的诱变方法来产生酶变体,或利用突变特定的位点赋予酶特定属性,以产生具有所需催化性能的酶变体[60,94-96]。部分研究结果显示,通过系统筛选氨基酸的突变位置和类型会产生具有增强或特殊性质的酶,例如,提高对特定分析物的亲和力,增强稳定性,提高电子转移速率,以及提供定向或更稳定的固定。但是有些情况为特定目的而专门设计的突变可能会在电化学生物传感器应用中产生另一种不利影响。解决这些问题的关键是结合蛋白质工程和生物传感器领域的科学知识指导酶分子传感元件理性设计。随着大数据时代对酶分子序列、结构、功能的深入认识,可以借助计算模拟/分子对接等方式根据功能需求全面预测氨基酸大小、极性、电荷和氧化还原电位等性质并结合蛋白质工程技术、氧化还原介质/聚合物合成和电化学方面的专业知识实现理性改造。目前,蛋白质工程改造酶的生物传感器研究仍处于起步阶段,尤其是国内大部分优良商品化酶的来源依赖于国外进口,虽然有些研究采用了自制酶,但离实用性要求相差甚远,因此更应加大酶分子传感器用酶的研究和开发力度,实现可适用的生物传感设备产业化制造,促进中国从生物传感器研究大国向生物传感器制造强国的转变。