醛固酮通过ROS/NLRP3/Smad通路促进肝纤维化研究
2022-07-12黄珊王国振蔡双明张文雍金思一宁佐伟
黄珊,王国振,蔡双明,张文雍,金思一,宁佐伟
肝纤维化是严重威胁人类生命健康的疾病。每年有数百万病人由自身免疫性肝炎、病毒性肝炎、酒精性肝病等疾病发展为肝纤维化,肝纤维化进一步发展,可进展为肝硬化、肝癌[1-3]。目前肝纤维化的发病机制不明,并且缺乏特异性治疗方法。因此,进一步研究并明确肝纤维化的发生机制,寻找有效治疗方法,有着重要的临床意义。
醛固酮是肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)重要成分,既往被认为是经典的血压以及容量调节激素,在调节水电解质平衡方面有着重要作用。近年来发现其参与了器官纤维化的发生发展过程[4-6]。NLRP3炎症小体由Nod-like receptor3(NLRP3),apoptosis-associated speck-like protein(ASC)以及caspase-1(Casp1)组成,当炎症、缺氧等因素刺激NLRP3活化后,可与ASC、Casp1前体pro-Casp1结合,剪切Casp1前体pro-Casp1形成有活性的Casp1。 NLRP3、ASC、Casp1进一步组成活化的NLRP3炎症小体复合物,剪切IL-1β的前体pro-IL-1β,生成IL-1β[7-9]。本课题组既往的研究中证实醛固酮可以促进NLRP3炎症小体活化,IL-1β生成导致肝纤维化发生[10]。但醛固酮是如何引起NLRP3炎症小体活化,以及IL-1β如何促进肝纤维化发生等机制仍未完全阐明[11-13]。
活性氧(reactive oxygen species,ROS)活化堆积导致氧化应激(oxidative stress,OS),这一过程与肝纤维化[14-16]以及NLRP3炎症小体[17-19]活化密切相关。Smad通路是肝纤维化中经典通路,Smad2、3活化后与Smad4结合,促进肝纤维化发生[20]。为进一步明确醛固酮引起NLRP3炎症小体通路活化及明确其下游通路,本课题使用了敲除NLRP3基因的小鼠建立四氯化碳(CCl4)模型,并且通过分离野生型及NLRP3基因敲除小鼠肝原代星状细胞,拟证明:醛固酮通过ROS活化NLRP3炎症小体,引起IL-1β生成,并通过Smad2、3通路活化促进肝纤维化发生这一结论。
1 材料与方法
1.1 材料试剂
醛固酮(aldosterone)、依普利酮(醛固酮拮抗剂,eplerenone)、螺内酯(醛固酮拮抗剂,spironolactone)、DPI(ROS拮抗剂,diphenyleneiodonium)、NAC(ROS拮抗剂,N-acetylcysteine)、IL-1β抑制剂、四氯化碳由Sigma-Aldrich(St. Louis, MO)公司提供,IL-1β由ProSpec(Protein Specialists, Rehovot, Israel)公司提供。
1.2 动物模型
南方医科大学动物实验伦理委员会批准了小鼠实验方案。南方医科大学动物中心提供野生型雄性C57小鼠(6~8周龄,18~22 g),Jackson实验室(B6.129S6-Nlrp3tm1Bhk/J)提供NLRP3敲除小鼠(雄性,6~8周龄,18~22 g)。动物在南方医科大学动物实验中心饲养。18只野生型小鼠随机分为两组:野生型对照组、野生型模型组。野生型对照组小鼠每隔5 d皮下注射5 mL/kg橄榄油1次,连续3个月;野生型四氯化碳模型组小鼠每隔5 d注射5 mL/kg 20%四氯化碳1次,连续3个月。同样,将18只NLRP3基因敲除小鼠随机分为NLRP3基因敲对照组和NLRP3基因敲除四氯化碳模型组,NLRP3基因敲除对照组小鼠每隔5 d皮下注射5 mL/kg橄榄油1次,连续3个月;NLRP3基因敲除四氯化碳模型组小鼠每隔5 d注射5 mL/kg 20%四氯化碳1次,连续3个月。3个月后分离肝星状细胞,并留取肝组织石蜡、冰冻标本。
1.3 原代肝星状细胞分离与细胞培养
依据既往发表的文章中方法分离野生型及NLRP3基因敲除对照组C57小鼠原代肝星状细胞[21]。使用含20%胎牛血清的DMEM培养基进行培养。细胞生长至75%后,在无血清培养基中培养1 d,分别使用螺内酯(10-5M)、依普利酮(10-5M)、DPI(5 μM)、NAC(10-3M)、IL-1β (2 ng/mL)或IL-1β 抑制剂(10 ng/mL)刺激60 min后,加入醛固酮(10-7M)刺激24 h。
1.4 指标检测方法
1.4.1 免疫组织化学
肝组织经福尔马林溶液固定后,分别使用75%、80%、85%、90%、95%、95%、100%、100%乙醇脱水30 min,二甲苯Ⅰ和二甲苯Ⅱ各浸泡15 min。然后,将组织进行石蜡包埋,并切成4 μm石蜡切片。在60 ℃烘箱中烤片2 h。
切片按以下顺序进行二甲苯脱蜡和梯度乙醇水化:二甲苯Ⅰ、Ⅱ、Ⅲ各15 min,100%乙醇Ⅰ、100%乙醇Ⅱ、95%乙醇Ⅰ、95%乙醇Ⅱ、85%、75%乙醇和去离子水各5 min。
使用柠檬酸盐进行抗原修复。封闭液进行封闭后,使用一抗(1∶100)4 ℃孵育切片过夜。洗片后使用二抗室温孵育1 h,洗片后进行DAB染色,封片。
1.4.2 过氧化氢含量测量
5~10 mg肝组织与100 μL裂解液(S0051,Beyotime,中国)混合,12 000 g离心5 min,收集上清。用裂解液稀释标准样品。然后,50 μL上清液或标准样品与100 μL过氧化氢检测试剂混合。在环境温度下放置30 min后,使用酶标仪560 nm波长检测样品。肝原代细胞过氧化氢检测同上。
1.4.3 蛋白质印迹分析
用裂解液(89900,Thermo Fisher Scientific)将肝组织研磨均匀,并在4 ℃离心以收集上清。使用Pierce BCA蛋白质分析试剂盒(23225,Thermo Fisher Scientific)测定蛋白质浓度,并将上清液与5倍上样缓冲液混合,煮沸变性。电泳后,蛋白质转移到硝化纤维素膜上。封闭液封闭1 h,使用Ⅰ型胶原、Smad2/3、NLRP3、IL-1β, ASC、caspase-1和α-SMA的一抗(1∶1000;Cell Signaling Technology)或β-actin一抗(1∶700;Santa Cruz Biotechnology)4 ℃孵育过夜。二抗(1∶7 500)室温孵育1 h后,用荧光分析仪定量荧光强度。
1.5 统计分析
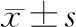
2 结果
2.1 CCl4模型组小鼠肝组织中H2O2含量增加
与野生型对照组相比,野生型 CCl4模型组中小鼠肝脏组织中H2O2含量明显增加(图 1A),两组间差异具有统计学意义(图1A)。提示ROS可能参与肝纤维化过程。
2.2 NLRP3炎症小体活化后促进IL-1β及 Smad2/3表达
免疫组化提示,与野生型对照组相比野生型CCl4模型组小鼠肝组织中IL-1β以及Smad2/3蛋白表达明显增高(图1B)。NLRP3基因敲除CCl4模型组与野生型CCl4模型组相比,IL-1β以及Smad2/3的蛋白表达降低(图1B)。上述蛋白含量改变差异具有统计学意义。提示NLRP3通过IL-1β以及Smad2/3作用于肝星状细胞,促进肝纤维化发生。
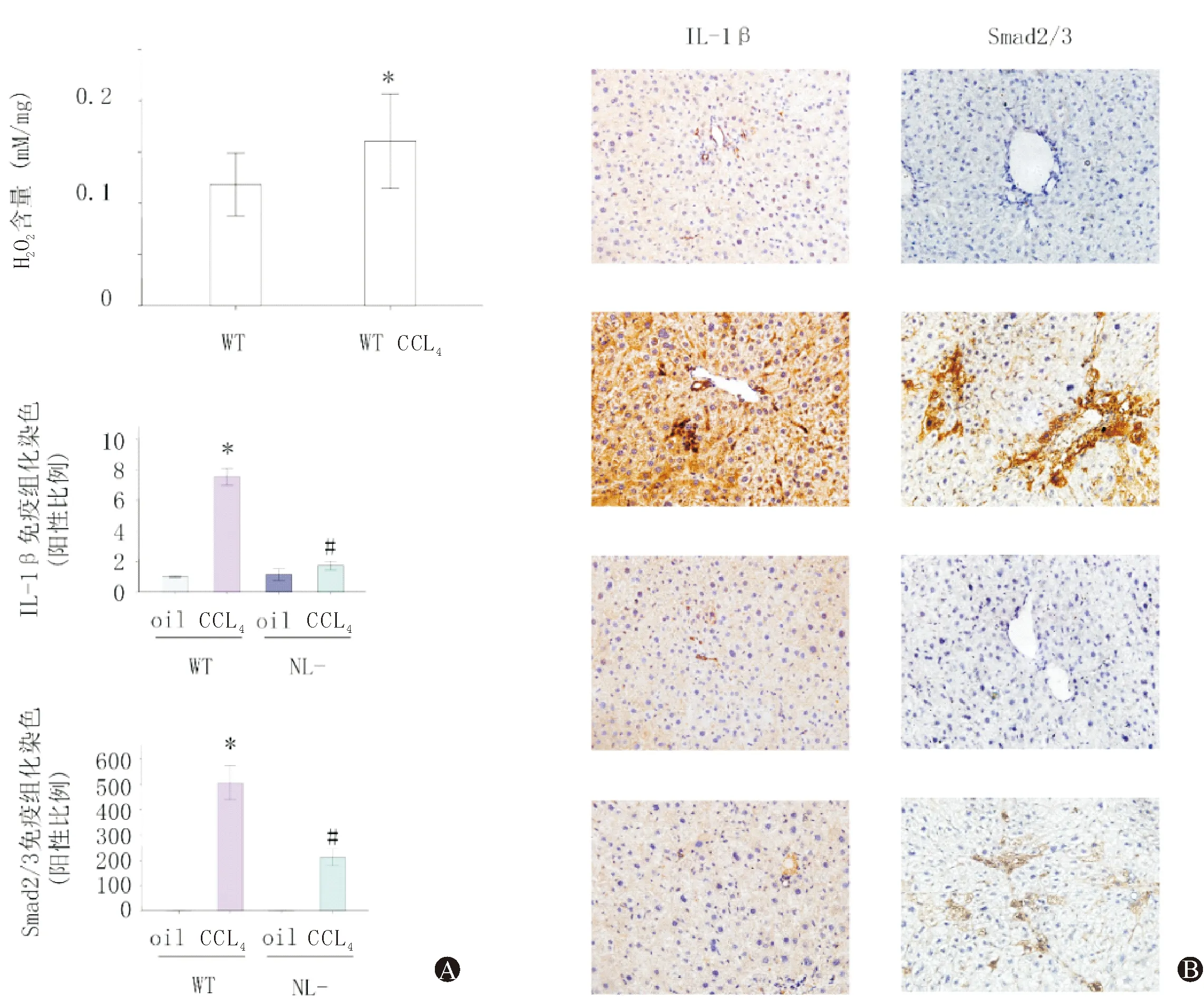
图1 野生型CCl4模型小鼠中ROS、IL-1β、Smad2/3含量升高,抑制NLRP3炎症小体后IL-1β、Smad2/3含量降低 A:野生型CCl4模型组中肝组织ROS含量; B:野生型及NLRP3敲除小鼠对照组及CCl4模型组肝组织中IL-1β、Smad2/3含量改变。*与野生型对照组相比,P<0.05,#与野生型CCl4模型组相比,P<0.05
2.3 醛固酮促进原代肝星状细胞活化以及Ⅰ型胶原生成
为了进一步研究醛固酮对肝纤维化的影响,我们用醛固酮及其抑制剂(螺内酯以及依普利酮)刺激由野生型小鼠肝脏分离的原代肝星状细胞,使用螺内酯及依普利酮刺激1 h后加入醛固酮培养24 h。与对照组相比,醛固酮刺激组中α-SMA以及Ⅰ型胶原蛋白含量增加,抑制醛固酮后可以抑制上述蛋白含量增加(图2A),差异具有统计学意义。提示醛固酮可以促进星状细胞活化,肝纤维化发生。
2.4 醛固酮通过ROS调节NLRP3炎症小体活化,α-SMA以及Ⅰ型胶原合成
用醛固酮抑制剂(螺内酯以及依普利酮)刺激由野生型小鼠肝脏分离的原代肝星状细胞1 h后,加入醛固酮。与对照组相比,醛固酮刺激组中的H2O2含量上调。抑制醛固酮后可以抑制H2O2含量上调(图2B)。差异具有统计学意义。提示醛固酮促进ROS生成。
在野生型肝原代星状细胞中,使用NAC以及DPI抑制ROS合成后,加入醛固酮。NAC、DPI可以抑制醛固酮引起的ASC、caspase-1、IL-1β、Ⅰ型胶原、α-SMA蛋白含量增加(图2C),差异具有统计学意义。提示醛固酮通过ROS引起NLRP3炎症小体激活,星状细胞活化,肝纤维化发生。
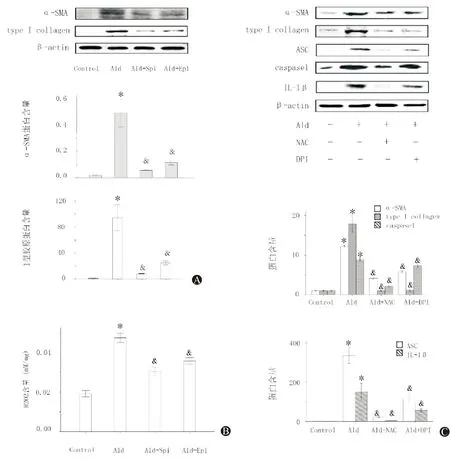
图2 醛固酮通过ROS调节NLRP3炎症小体/IL-1β活化,α-SMA以及Ⅰ型胶原合成 A:醛固酮及其抑制剂刺激野生型肝原代星状细胞后,α-SMA以及Ⅰ型胶原蛋白含量改变; B:醛固酮及其抑制剂刺激野生型肝原代星状细胞后H2O2含量改变; C:醛固酮及ROS抑制剂刺激野生型肝原代星状细胞后, ASC、caspase-1、IL-1β、Ⅰ型胶原、α-SMA蛋白含量改变。*与对照组相比,P<0.05。&与醛固酮刺激组相比,P<0.05
2.5 IL-1β通过Smad2/3信号通路促进α-SMA、Ⅰ型胶原表达
通过醛固酮刺激野生型原代肝星状细胞后,使用IL-1β阻断剂抑制IL-1β表达。与醛固酮刺激组相比,抑制IL-1β表达后,使NLRP3炎症小体组分、Ⅰ型胶原、磷酸化Smad2/3以及α-SMA蛋白表达下调(图3A),差异具有统计学意义。提示醛固酮通过IL-1β刺激Smad2、3活化,星状细胞活化、肝纤维化发生。
使用IL-1β分别刺激野生型以及NLRP3敲除小鼠分离的肝原代星状细胞。与野生型对照组相比,野生型IL-1β刺激组中NLRP3、ASC、Caspase1、α-SMA以及Ⅰ型胶原蛋白含量上调(图3B)。与野生型IL-1β刺激组相比,NLRP3敲除IL-1β刺激组中上述蛋白表达降低(图3B)。差异具有统计学意义。提示IL-1β刺激Smad2、3活化,星状细胞活化、肝纤维化发生。IL-1β可能会反作用于NLRP3炎症小体活化,促进肝纤维化发生。

图3 IL-1β通过Smad2/3信号通路促进α-SMA、Ⅰ型胶原表达 A:醛固酮及IL-1β抑制剂刺激野生型肝原代星状细胞后,相关蛋白含量改变; B:IL-1β刺激野生型以及NLRP3敲除肝原代星状细胞后相关蛋白含量改变。*与野生型对照组相比,P<0.05。#与野生型醛固酮刺激组相比,P<0.05
3 讨论
本文利用NLRP3敲除小鼠构建CCl4肝纤维化模型,通过分离野生型及NLRP3基因敲除小鼠肝原代星状细胞证明:醛固酮通过ROS导致NLRP3炎症小体活化,通过IL-1β/Smad2、3通路促进肝纤维化发生。
非病毒性肝纤维化多是由脂肪肝、酒精性肝炎、自身免疫性肝炎等多种疾病发展而形成。肝纤维化最终可发展成为肝硬化、肝癌[22-23],严重威胁人类生命健康。我国是肝病大国,肝纤维化发病率较高。肝纤维化病情隐匿,多无明显临床症状,多发展为失代偿期肝硬化等疾病后可出现临床症状。但目前肝纤维化的确切发病机制不明,缺乏有效的特异治疗方法,因此进一步研究阐明肝纤维化的发病机制,进一步寻找潜在治疗靶点,寻找有效治疗方法有着非常重要的临床意义[24]。
醛固酮是经典的水钠调节激素,既往认为醛固酮有着保水、保钠、排钾等作用,醛固酮抑制剂多在高血压等疾病中应用。但近年来证据证明,醛固酮与器官纤维化密切相关。醛固酮可以通过NLRP3炎症小体活化导致器官损伤。Bai等[25]证明醛固酮引起的NLRP3炎症小体活化,活化的NLRP3炎症小体可以进一步导致肾脏损伤;Xiao B等[26]证实MnTBAP治疗可以通过调节NLRP3炎症小体活化,从而减轻醛固酮引起的肾脏损伤;Bruder-Nascimento等[27]证明醛固酮引起的NLRP3炎症小体活化在血管损伤方面有着重要的作用。在既往实验中,本课题组证明醛固酮可以通过NLRP3炎症小体活化促进肝纤维化发生[10]。然而,醛固酮如何引起NLRP3炎症小体活化的呢,目前仍为具体阐明。
氧化应激是由于活性氧(ROS)以及抗氧化物(antioxidant)失衡,导致活性氧堆积,从而造成组织器官损害。机体生成活化ROS后,其可以通过多种机制引起器官损伤,如炎症小体通路活化机制、自噬机制、内质网损伤机制等等[28-29]。那么,醛固酮导致的NLRP3炎症小体活化是否是由ROS引起的呢?在本文体内实验中,与野生型对照组相比,野生型CCl4刺激组中,ROS含量明显增加。初步提示ROS与肝纤维化相关。在体外实验中,醛固酮刺激野生型肝原代星状细胞后,与野生型对照组肝星状细胞相比ROS含量增加。抑制醛固酮可以抑制ROS生成。这些结果提示醛固酮促进ROS生成。醛固酮刺激野生型肝原代星状细胞后,抑制ROS可以抑制NLRP3炎症小体活化,抑制IL-1β生成,抑制肝纤维化发生,提示醛固酮通过ROS促进NLRP3炎症小体活化,促进肝纤维化发生。
NLRP3炎症小体活化可以导致pro-IL-1β生成增多,并剪切pro-IL-1β形成IL-1β,促进肝纤维化发生。但是IL-1β如何促进肝纤维化发生,目前相关机制仍未完全阐明。Smad通路是TGF-β信号通路经典的下游通路,Smad通路蛋白可以分为2类,刺激性Smad(R-Smad)以及抑制性Smad(I-Smad)。R-Smad包括Smad2、Smad3、Smad4等。在磷酸化后,Smad2,Smad3蛋白与Smad4蛋白结合,形成Smad蛋白复合物,促进肝星状细胞活化[30],导致肝纤维化发生。在本文中,我们验证了IL-1β通过Smad通路促进星状细胞活化,促进肝纤维化发生。在体内实验中,我们发现野生型模型组中IL-1β,Smad2/3蛋白表达升高,初步提示IL-1β,Smad2/3与肝纤维化相关。体外实验中,醛固酮刺激野生型肝脏原代星状细胞后,阻断IL-1β可导致Ⅰ型胶原,P-Smad2/3,α-SMA表达降低,提示IL-1β通过Smad2/3通路促进肝纤维化发生。有趣的是,当IL-1β被阻断后,NLRP3炎症小体通路蛋白表达也降低了,利用IL-1β刺激肝原代星状细胞可以导致NLRP3炎症小体活化,提示IL-1β可能对NLRP3炎症小体有反作用,可以促进NLRP3炎症小体活化。IL-1β以及NLRP3炎症小体的相关作用需要进一步研究。
综上所述,醛固酮通过ROS导致NLRP3炎症小体/IL-1β/Smad2、3通路活化,促进肝纤维化发生。
